ņä£ ļĪĀ
ņ×¼ļŻī ļ░Å ļ░®ļ▓Ģ
ņłśļ░ĢļŹ®ĻĄ┤ņ¬╝Ļ╣Ćļ│æĻĘĀ ĻĘĀņŻ╝
ņĀæņóģņøÉ ņżĆļ╣ä
ņŗØļ¼╝ņ▓┤ ņżĆļ╣ä
ņłśļ░ĢļŹ®ĻĄ┤ņ¬╝Ļ╣Ćļ│æĻĘĀ ņĀæņóģ
ņłśļ░Ģ ļŹ®ĻĄ┤ņ¬╝Ļ╣Ćļ│æ ļ│æņĪ░ņé¼
ĒåĄĻ│äļČäņäØ
Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
ņłśļ░ĢļŹ®ĻĄ┤ņ¬╝Ļ╣Ćļ│æĻĘĀ ĻĘĀņŻ╝ļōżņØś ļĀłņØ┤ņŖż ļÅÖņĀĢ.
Fig.┬Ā1.

Table┬Ā1.
| Isolate | Genotype | Race | |||
|---|---|---|---|---|---|
| Sugar baby | Charleston gray | Calhoun gray | PI-296341-FR | ||
| KACC 40902 | 3.8┬▒0.5 b S c | 1.5┬▒0.7 MR | 0.8┬▒0.4 R | 0.5┬▒0.5 R | 0 |
| HA | 3.5┬▒0.7 S | 1.9┬▒1.2 MR | 0.8┬▒0.6 R | 0.8┬▒0.8 R | 0 |
| NW1 | 3.8┬▒0.4 S | 2.9┬▒1.1 S | 0.5┬▒0.7 R | 0.3┬▒0.5 R | 1 |
| NW2 | 3.1┬▒0.6 S | 2.8┬▒1.2 S | 0.5┬▒0.5 R | 0.4┬▒0.5 R | 1 |
| CW | 3.5┬▒0.7 S | 3.1┬▒1.0 S | 1.0┬▒1.2 R | 0.9┬▒1.4 R | 1 |
| KACC 40901 | 2.9┬▒0.7 S | 3.1┬▒1.0 S | 1.0┬▒0.5 R | 0.5┬▒0.7 R | 1 |
| KACC 40905 | 4.0┬▒0.0 S | 3.5┬▒0.8 S | 3.6┬▒0.8 S | 0.8┬▒0.4 R | 2 |
a Ten-day-old seedlings of four watermelon cultivars with different genotype were inoculated with each isolate of F. oxysporum f. sp. niveum by dipping the roots of seedlings in spore suspension of 1.0├Ś106 conidia/ml for 30 min. The inoculated plants were incubated in a dew chamber at 25┬░C for 24 hr and then transferred to a growth room at 25┬░C with 12 hr light a day. Three weeks after inoculation, disease index of each seedling was investigated on a scale of 0-4, where 0=represents no disease symptom; 1=discoloration of vascular system, normal growth; 2=discoloration of vascular system, stunting; 3=discoloration of vascular system, yellowing and severe stunting; 4 = death.
ņłśļ░ĢļŹ®ĻĄ┤ņ¬╝Ļ╣Ćļ│æĻĘĀ 7Ļ░£ ĻĘĀņŻ╝ņØś ļ│æņøÉļĀź
Fig.┬Ā2.
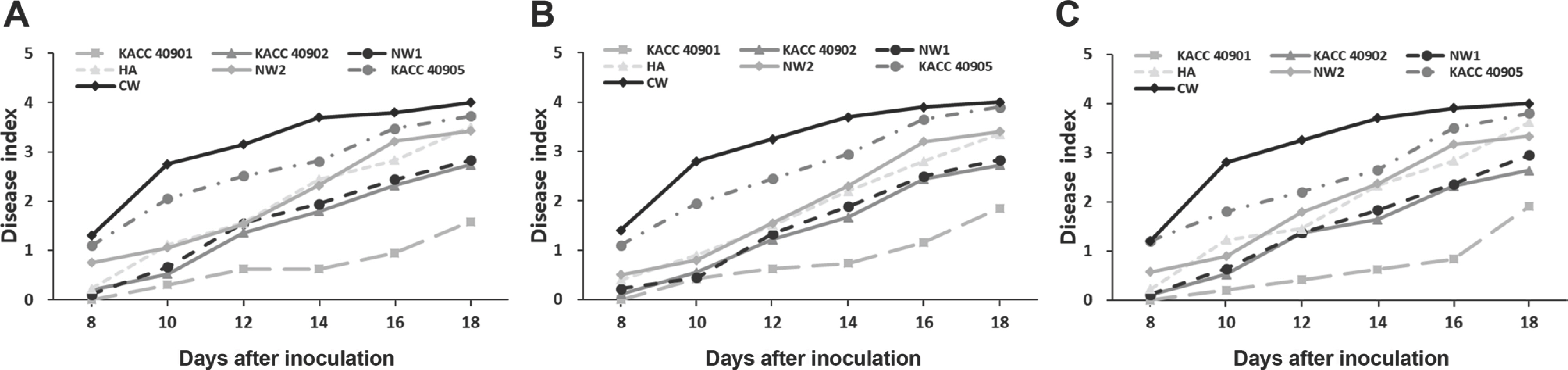
Fig.┬Ā3.

Table┬Ā2.
| Cultivar | Isolate | ||||||
|---|---|---|---|---|---|---|---|
| KACC 40901 | KACC 40902 | NW1 | HA | NW2 | KACC 40905 | CW | |
| Seotaeja | 1.2┬▒1.0 b a c | 2.5┬▒0.7 b | 2.6┬▒0.7 b | 3.2┬▒0.4 c | 3.3┬▒0.5 c | 3.5┬▒0.6 d | 3.9┬▒0.2 e |
| Nunettine | 1.2┬▒0.6 a | 2.5┬▒0.7 b | 2.6┬▒0.8 b | 3.2┬▒0.5 c | 3.2┬▒0.5 c | 3.6┬▒0.4 d | 4.0┬▒0.0 e |
| Kamchunkkul | 1.4┬▒0.5 a | 2.6┬▒0.7 b | 2.6┬▒0.7 b | 2.9┬▒0.5 c | 3.3┬▒0.4 c | 3.7┬▒0.2 d | 4.0┬▒0.0 e |
| Mean | 1.3 a | 2.6 b | 2.6 b | 3.1 c | 3.3 c | 3.6 d | 3.9 e |
a Fourteen-day-old seedlings of three watermelon cultivars were inoculated with 7 isolates of F. oxysporum f. sp. niveum by cutting the roots with a scalpel, and then 10 ml of spore suspension (3.0├Ś106 conidia/ml) was applied into soil. The inoculated plants were incubated in a humidity chamber at 25┬░C for 24 hr and transferred to a growth room at 25┬░C with 12 hr light a day. Eighteen days after inoculation, disease severity of the seedlings was investigated on a scale of 0-4, where 0=represents no disease symptom; 1=discoloration of vascular system, normal growth; 2=discoloration of vascular system, stunting; 3=discoloration of vascular system, yellowing and severe stunting; 4=death.
ņłśļ░Ģ ĒÆłņóģņØś ļŹ®ĻĄ┤ņ¬╝Ļ╣Ćļ│æņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ ĒŖ╣ņä▒
Table┬Ā3.
| Cultivar | Isolate | ||||||
|---|---|---|---|---|---|---|---|
| KACC 40901 | KACC 40902 | NW1 | HA | NW2 | KACC 40905 | CW | |
| Soknorankkul | 0.0 b a c | 0.0 ab | 1.0 bc | 1.4 cb | 2.0 d | 2.6 eb | 2.8 e |
| Chodangkkul | 2.0 a | 2.1 ab | 2.4 bb | 2.8 bc | 3.0 c | 3.3 cd | 3.4 d |
| Seotaeja | 1.9 a | 2.4 ab | 2.6 bb | 2.8 bc | 3.0 c | 3.2 cd | 3.4 d |
| Calhoun gray | 0.0 a | 0.0 ab | 0.0 ab | 0.0 ab | 0.0 a | 2.6 bb | 0.0 a |
| ShinFR-bulsajo | 0.0 a | 0.0 ab | 0.0 ab | 0.0 ab | 0.0 a | 0.0 ab | 0.0 a |
| Mean d | 1.0 a | 1.1 ab | 1.7 bb | 2.1 bb | 2.5 c | 3.0 cb | 3.1 c |
a Fourteen-day-old seedlings of each cultivar were inoculated with 7 isolates F. oxysporum f. sp. niveum by cutting the roots with a scalpel, and then 10 ml of spore suspension (3.0├Ś106 conidia/ml) was applied into soil. The inoculated plants were incubated in a humidity chamber at 25┬░C for 24 hr and transferred to a growth room at 25┬░C with 12 hr light a day. Eighteen days after inoculation, disease severity of the seedling was investigated on a scale of 0-4.
b Each value represents the mean disease index┬▒standard deviation of two runs with 10 replicates each.
Table┬Ā4.
| Cultivar | Isolate | ||||||
|---|---|---|---|---|---|---|---|
| KACC 40901 | KACC 40902 | NW1 | HA | NW2 | KACC 40905 | CW | |
| Soknorankkul | 0 b a c | 0 ab | 05 b | 07 bb | 12 c | 16 cd | 19 d |
| Chodangkkul | 10 ac | 12 ab | 20 b | 25 bb | 28 c | 30 cb | 33 d |
| Seotaeja | 11 ac | 13 ab | 21 b | 25 bc | 28 c | 31 cd | 35 d |
| Calhoun gray | b0 ac | 0 ab | 00 a | 00 ab | 00 a | 11 bb | 00 a |
| ShinFR-bulsajo (rootstock) | b0 ac | 0 ab | 00 a | 00 ab | 00 a | 00 ab | 00 a |
| Mean d | b5 ac | 6 ab | 13 b | 16 bb | 20 c | 23 cb | 26 d |
a Fourteen-day-old seedlings of each cultivar were inoculated with 7 isolates F. oxysporum f. sp. niveum by cutting the roots with a scalpel, and then 10 ml of spore suspension (3.0├Ś106 conidia/ml) was applied into soil. The inoculated plants were incubated in a humidity chamber at 25┬░C for 24 hr and transferred to a growth room at 25┬░C with 12 hr light a day. Eight to eighteen days after inoculation at 2-day intervals, disease severity of the seedling was investigated on a scale of 0-4.
b




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






