 |
 |
| Res. Plant Dis > Volume 26(2); 2020 > Article |
|
ABSTRACT
Acknowledgments
Fig. 1

Fig. 2
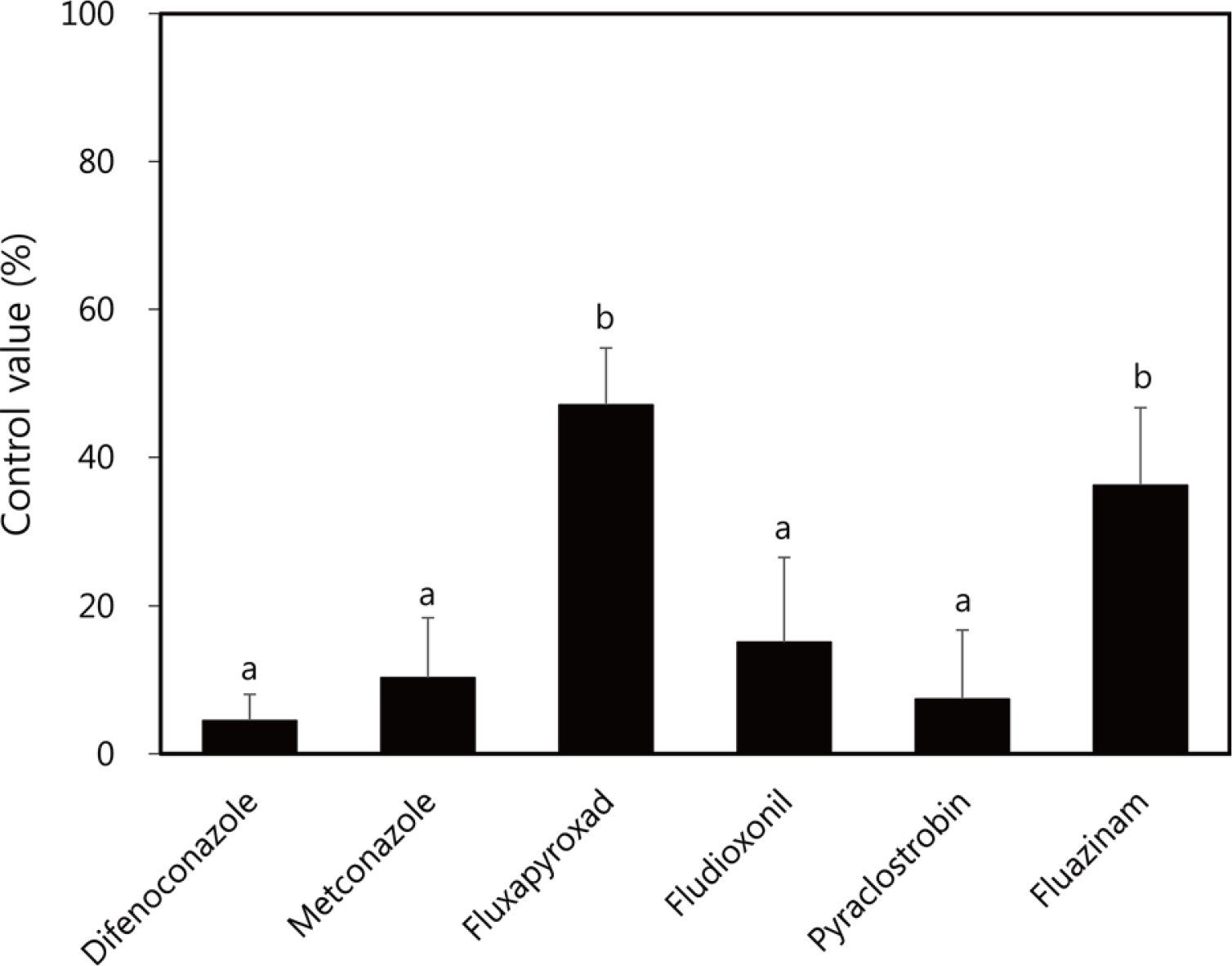
Fig. 3
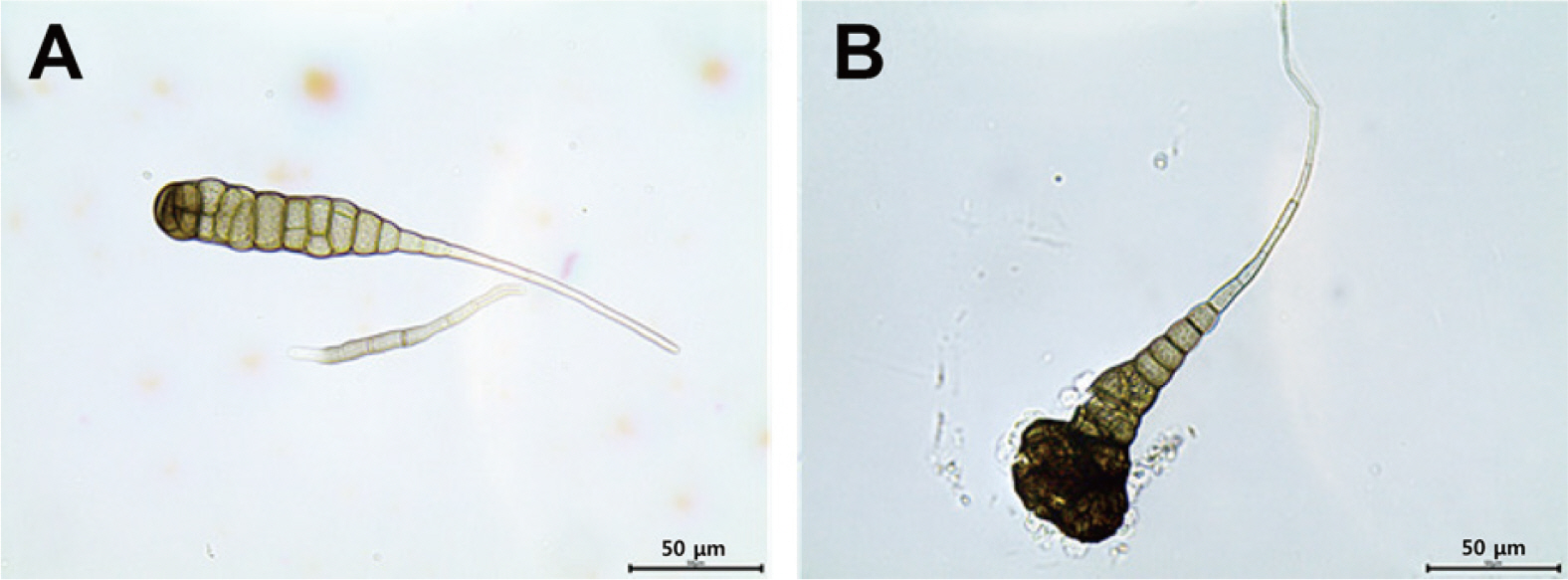
Fig. 4

Fig. 5
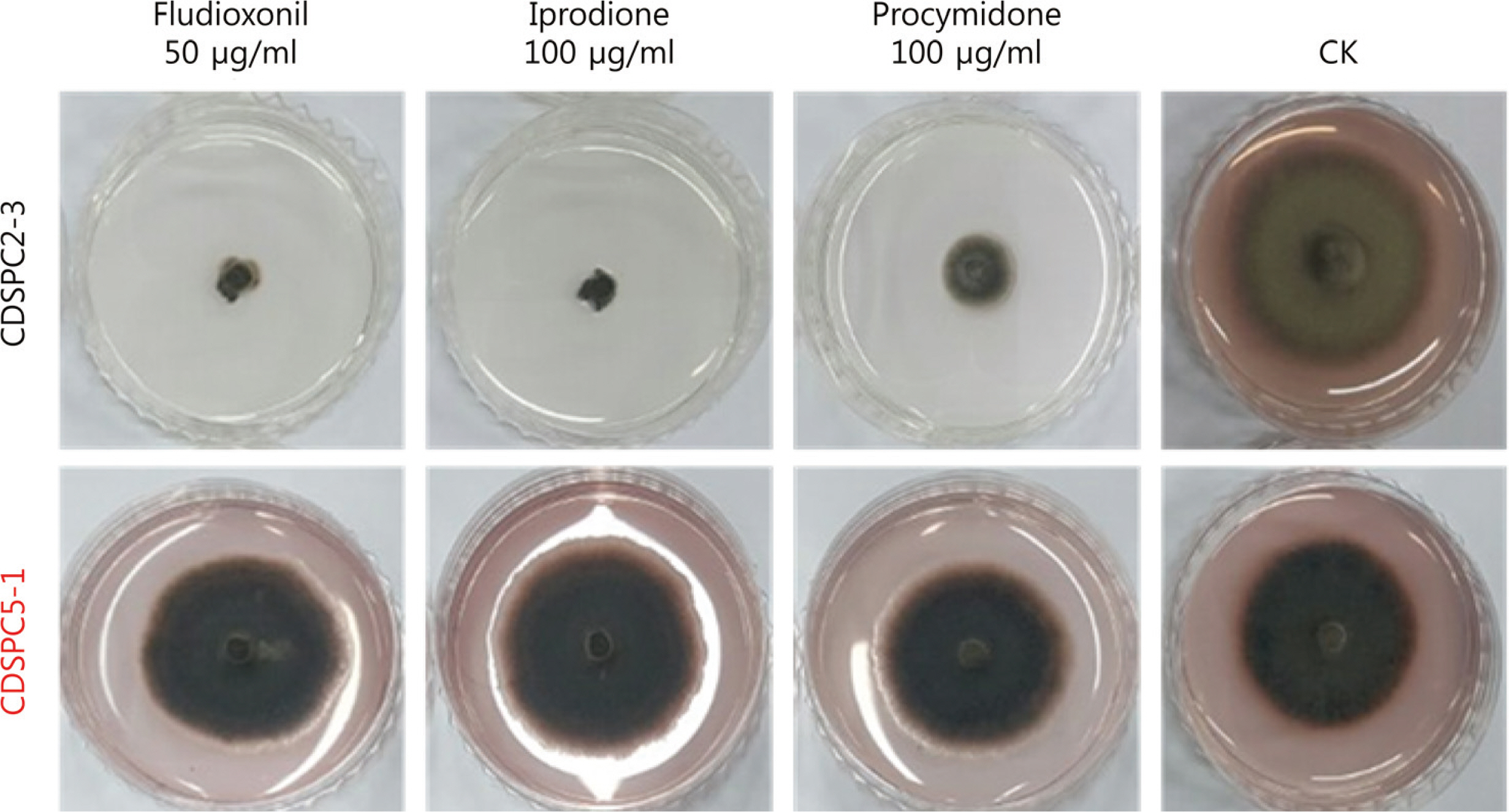
Table 1
| Groups | Fungicides | Active ingredient (%) and formulationsa |
|---|---|---|
| Chloronitrile | Chlorothalonil | 75.0, WPa |
| Phenylpyridinamine | Fluazinam | 50.0, WG |
| Guanidine | Iminoctadine tris-albesilate | 40.0, WP |
| Quinone | Dithianon | 75.0, WG |
| Phthalimide | Folpet | 50.0, WP |
| DMI | Difenoconazole | 10.0, WG |
| Metconazole | 20.0, SC | |
| SDHI | Fluxapyroxad | 15.3, SC |
| Boscalid | 49.3, WG | |
| Strobilurin type | Pyraclostrobin | 22.9, EC |
| Phenylpyrrole | Fludioxonil | 20.0, SC |
| Dicarboximide | Iprodione | 50.0, WG |
Table 2
| MOA | MOA code | Fungicides |
EC50a (μg/ml) |
MICb (μg/ml) |
|---|---|---|---|---|
| Multi-site fungicide (protectant) | M5 | Chlorothalonil | 5.292 | >100 |
| M7 | Iminoctadine tris-albesilate | 0.185 | >100 | |
| M3 | Propineb | 1.701 | 100 | |
| M4 | Folpet | 5.423 | >100 | |
| M9 | Dithianon | >100 | >100 | |
| Respiration | C2 | Isopyrazam | 0.579 | 100 |
| C2 | Fluxapyroxad | 0.053 | 10 | |
| C2 | Boscalid | 0.155 | >100 | |
| C2 | Floupyram | 1.443 | >100 | |
| C2 | Flutolanil | >100 | >100 | |
| C3 | Pyraclostrobin | 1.174 | >100 | |
| C3 | Azoxystrobin | >100 | >100 | |
| C3 | Kresoxim-methyl | >100 | >100 | |
| C3 | Trifloxystrobin | 35.930 | >100 | |
| C5 | Fluazinam | 0.083 | >100 | |
| Sterol biosynthesis in membrane | G1 | Difenoconazole | 0.002 | 100 |
| G1 | Metconazole | 1.055 | 100 | |
| G1 | Tebuconazole | 0.190 | 100 | |
| G1 | Hexaconazole | 0.005 | 100 | |
| G1 | Fluquinconazole | 0.265 | >100 | |
| G1 | Prochloraz | 0.002 | 100 | |
| G3 | Fenhexamid | 2.631 | >100 | |
| Signal transduction | E2 | Fludioxonil | 0.059 | >100 |
| E3 | Iprodione | 0.426 | >100 | |
| E3 | Procymidone | 1.274 | >100 | |
| Cytoskeleton and motor proteins | B1 | Carbendazim | >100 | >100 |
| B1 | Benomyl | >100 | >100 | |
| B1 | Thiophanate-methyl | >100 | >100 | |
| B1+B2 | Carbendazim+diethofencarb | >100 | >100 | |
| Cell wall biosynthesis | H4 | Polyoxin B | >100 | >100 |
| H4 | Polyoxin D | >100 | >100 | |
| Lipid synthesis and membrane integrity | F2 | Isoprothiolane | >100 | >100 |
Table 3
a Inhibition rate (%) was determined by comparing the growth of Alternaria dauci KACC42997 in the untreated control and the treatment with each fungicide.
b The inhibitory effect of the fungicides on the spore germination was investigated after incubating the conidia of A. dauci on cellophane membrane placing on potato dextrose agar at 25°C for 6 hr. Just only spores with a germination tube longer than the spore width were considered as germinated spores. In each replicate of all treatments, 100 spores were examined.
Table 4
| Fungicides | Regionsa | EC50 valueb (μg/ml) | Rf valuec | ||
|---|---|---|---|---|---|
|
|
|||||
| Minimum | Mean | Maximum | |||
| Difenoconazole | GM | 0.018 | 0.207 | 00.946 | 053.0 |
| JJ | 0.044 | 0.262 | 00.762 | 017.4 | |
| PC | 0.032 | 0.190 | 00.384 | 011.9 | |
| Metconazole | GM | 0.111 | 0.280 | 00.685 | 006.2 |
| JJ | 0.098 | 0.329 | 00.801 | 008.2 | |
| PC | 0.042 | 0.465 | 01.682 | 039.7 | |
| Tebuconazole | GM | 0.146 | 0.788 | 02.383 | 016.3 |
| JJ | 0.218 | 0.794 | 01.953 | 009.0 | |
| PC | 0.209 | 1.205 | 04.302 | 020.6 | |
| Prochloraz | GM | 0.002 | 0.155 | 00.443 | 241.4 |
| JJ | 0.007 | 0.175 | 00.320 | 047.3 | |
| PC | 0.003 | 0.144 | 00.476 | 160.7 | |
| Fenhexamide | GM | 1.649 | 7.215 | 14.583 | 008.8 |
| JJ | 4.703 | 8.378 | 29.996 | 006.4 | |
| PC | 3.006 | 7.848 | 14.029 | 004.7 | |
a To examine the sensitivity of Alternaria dauci to fungicides inhibiting ergosterol biosynthesis, isolates of A. dauci were collected from 3 regions such as Gumi (GM), Jeju (JJ), and Pyeongchang (PC) where carrots were cultivated.
Table 5
| Fungicides | Regionsa | EC50 valueb (μg/ml) | Rf valuec | ||
|---|---|---|---|---|---|
|
|
|||||
| Minimum | Mean | Maximum | |||
| Isopyrazam | GM | 28 | 0.537 | 02.252 | 006.492 |
| JJ | 23 | 0.499 | 02.332 | 004.818 | |
| PC | 21 | 0.369 | 02.500 | 006.431 | |
| Fluxapyroxad | GM | 28 | 0.527 | 01.640 | 003.926 |
| JJ | 23 | 0.485 | 01.857 | 003.054 | |
| PC | 21 | 0.343 | 01.416 | 002.802 | |
| Boscalid | GM | 28 | 1.164 | 14.716 | 085.500 |
| JJ | 23 | 1.033 | 09.420 | 026.450 | |
| PC | 21 | 3.413 | 17.466 | 124.967 | |
| Pyraclostrobin | GM | 28 | 0.587 | 10.587 | 032.966 |
| JJ | 23 | 3.060 | 15.300 | 042.944 | |
| PC | 21 | 1.497 | 09.359 | 030.359 | |
a To examine the sensitivity of Alternaria dauci to fungicides inhibiting the respiration, isolates of A. dauci were collected from 3 regions such as Gumi (GM), Jeju (JJ), and Pyeongchang (PC) where carrots were cultivated.
References
- TOOLS



 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




