사과 주 재배지 경북 청송 지역 사과 탄저병원균의 살균제에 대한 감수성 조사
Research to Fungicide Sensitivity of Colletotrichum spp. Isolated from Apple Fruits in Cheongsong, Korea
Article information
Abstract
2018년, 경상북도 청송군 소재 7개의 읍면리의 13개 사과 과원에서 채집한 탄저병 감염 과실로부터 39개 탄저병 균주를 분리한 후 이 균주들을 대상으로 국내에 등록된 12개의 사과 탄저병 살균제에 대한 균자생장 억제, 포자발아 억제율을 조사하여 각각의 살균제에 대한 감수성 정도를 한천희석법을 이용한 실내검정법으로 조사하였다. 살균제 감수성 실내검정 결과 captan, dithanon, fluazinam, metconazole, tebuconazole에서는 저항성 균주가 나타나지 않았으나, trifloxystrobin, kresoxim-methyl 살균제에서는 모든 지역에서 저항성을 보이는 균주가 관찰되었다. 이를 통해 일부 지역에서 살균제의 지속적인 처리로 인하여 균주 집단 내 살균제 내성이 발현되었음을 알 수 있었다. 저항성이 발현된 strobilurin 계통의 살균제를 관리하기 위하여 연용 살포를 하지 말아야 하며, 살포기간에 유용미생물로 인한 대체 살포 등 관리가 필요하다.
Trans Abstract
Apple grower in the Cheongsong region, Korea has reported the increased loss of apple yield due to severe bitter rot incidence. We noticed that this indience is because the Colletotrichum population has developed resistance to commonly used fungicides. We isolated 39 Colletotrichum isolates from 13 orchards in Cheongsong, and all the isolated Colletotrichum species were identified as C. siamense or C. fructicola. These 39 strains were tested for mycelial growth and conidial germination against 12 fungicides. trifloxystrobin (30–55% in recommended concentrations) was shown lower inhibitory effect on mycelial growth. However, the inhibition of conidial germination was shown higher than mycelial growth (62–100%). Kresoxim-methyl was shown lower inhibitory effect on mycelial growth (29–55%). conidial germination inhibitory effect was shown 51% to 96%. dithianon was shown diversity response to inhibition of mycelial growth (43–100%). tebuconazole was shown high inhibitory effect on mycelial growth (84–100%) and conidial germination inhibitory effect was shown to be 64 to 100%. metconazole has been found to display with high inhibitory effect on mycelial growth (79–100%) and conidial germination (70–80%). fluazinam was shown to possess high inhibitory effect on mycelial growth (87–100%) and conidial germination (94–100%). This study provides basic information for the effective management of apple bitter rot.
서 론
국내 사과 재배면적은 34,603 ha를 차지하고 있으며, 이 중 경상북도는 약 59.78%인 20,685 ha를 차지하고 있다. 이 중 청송지역은 경북 사과 재배 면적 중 13.69%인 2,831 ha를 차지하고 있으며, 경북에서 사과 주산지 중 하나이다(Statistics Korea, 2020). 이러한 사과 재배 중 사과 생산에 직접적으로 영향을 미치는 병해인 사과 탄저병은 과실에 직접적인 피해를 일으켜 품질과 수량을 저하시켜 경제적으로 큰 손실을 일으킨다. 우리나라에서는 과실에 대한 탄저병의 원인 병원균으로 Colletotrichum속이 보고되어 있다(Kim 등, 2018; Park 등, 2018). 사과 탄저병은 7월 초순부터 발병하기 시작하며 수확기까지 발병한다. 병징은 과실 표면의 병반부위가 함몰되며 병반포면에는 둥근 무늬로 분생자층이 형성되며, 과실이 부패되는 것이 가장 큰 특징이다. 또한 과실의 단면을 자르면 과심을 중심으로 V자 형태로 과실이 부패되는 것을 볼 수 있다(Cheon과 Jeon, 2015). 특히 장마철 이후 온난 다습한 상태가 지속될 때 급격히 발생한다(Biggs와 Miller, 2001).
Colletotrichum에 의한 사과 탄저병을 방제하기 위해서는 경종적인 방법과 화학적 또는 생물적 방법 등이 사용된다(Lee 등, 2019). 가장 일반화되어 있는 방법은 살균제를 사용하는 화학적 방법이다(Saxena 등, 2016). 102개의 살균제 품목이 사과 탄저병 방제용 약제로 등록되어 있다(Korean Crop Protection Association, 2022). 그러나 등록된 살균제는 5가지 계통의 살균제만 등록이 되어 있다(Fungicide Resistance Action Committee, 2022). 그렇기 때문에 살균제 방제력을 확립하고자 할 때, 살균제 선택이 제한적이다. 살균제 저항성 관리 차원에서도 작용기작이 다른 다양한 살균제가 사용되어야 한다.
‘다3’군(quinone outside inhibitor, QoI; MoA code, C3)에 속하는 strobilurin 살균제는 1996년에 개발된 azoxystrobin을 비롯하여 2002년까지 서로 다른 유효성분을 가진 6종의 살균제가 등록되어 사용되기 시작하였다(Balba, 2007). 이 QoI 계통 살균제는 식물 병원성 곰팡이의 미토콘드리아 내막에 존재하는 cytochrome bc1 복합체의 한 부분인 cytochrome b에 부착하여 미토콘드리아의 호흡을 저해하는 특이한 작용기작을 갖는다(Bartlett 등, 2002). Strobilurin계 살균제는 저항성 균이 비교적 쉽게 나타날 수 있는데, 살균제 저항성은 cytochrome b 유전자의 143번째 아미노산이 glycine (GGT)에서 alanine (GCT)으로 치환되는 점 돌연변이에 의해서 발생한다(Dowling 등, 2020). Colletotrichum속의 strobilurin계 살균제에 대한 저항성 균의 발생은 캘리포니아의 피칸 탄저병을 일으키는 C. fioriniae, 플로리다에서 딸기 탄저병을 일으키는 C. nymphaeae, 캘리포니아에서 블루베리와 복숭아의 탄저병을 일으키는 C. siamense, 일리노이에서 사과 탄저병을 일으키는 C. siamense 등 다양한 Colletotrichum속의 병원균이 strobilurin계 살균제에 대한 저항성 균들이 보고되었다(Chechi 등, 2019; Forcelini 등, 2016; Hu 등, 2015).
‘다5’군(MoA code, C5; FRAC code, 21)에 속하는 살균제는 대표적으로 fluazinam이 있으며, 이는 ATP 합성효소의 직접적인 억제를 통해 에너지 생산 과정을 억제하는 아미노피리딘이다(Vitoratos, 2014). 최근 연구에서도 이 fluazinam에 대한 저항성이 보고된 사례는 존재하지 않는다.
‘사1’군(demethylation inhibitor, DMI; MoA code, G1; FRAC code, 3)에 속하는 triazole계 살균제는 스테롤 생합성 억제제로 14 α-demethylase를 표적으로 하는 탈 메틸화 억제제이다. triazole계 살균제는 CYP51A 및 CYP51B 유전자의 발현과 관련이 있다(Wei 등, 2020).
‘카’군에 속하는 다중 작용기작 살균제로는 퀴논계의 dithia-none (MoA code, M; FRAC code, M09), 트리할로메칠치오계의 캡탄(MoA code, M; FRAC code, M04) 등 다양한 살균제가 이용되고 있다.
‘차1’군(MoA code, P01; FRAC code, P01)에 속하는 식물 방어 유도 살균제로는 benzothiadiazole계에 속하는 acibenzolar-S-methyl (ASM) 살균제가 이용되고 있다.
단일 작용기작을 가진 살균제들의 저항성 균주들이 보고가 되어 있음에도 불구하고, 실제 농가현장에서는 유효성분이 다르지만 같은 작용기작을 가진 살균제들을 다른 살균제로 오인하며 사용하는 사례가 발생하고 있다. 이러한 현장의 문제를 방지하기 위하여, 작용기작이 같은 그룹에 속하는 살균제를 다양한 제형으로 선발하여 살균제 간의 교차 저항성 여부, 제형에 따른 살균제 효력을 명확하게 규명하여야 할 필요가 있다.
살균제 효과를 검정하는 방법으로는 병원균의 생장 억제 효과를 직접 조사하는 방법과 식물체에서 병 발생을 억제하는 병 방제 효과를 조사하는 방법 등이 있다(Lee 등, 2014; Park 등, 2014; Park과 Kim, 2022). 병원균에 대한 살균제의 효과를 배지에서 검정할 때에는 일반적으로 한천희석법을 사용하여 균사 생장에 대한 억제 효과를 조사하는데, 병원균에 대한 균사생장 억제효과는 떨어지지만 포자발아 억제효과가 우수한 살균제의 효과를 정확하게 검정할 수 없는 한계를 가지고 있다. 포자발아 억제 검정법은 세포의 생존에 영향을 미치는 살균제의 효과를 검정할 수 있는 조사 방법중의 하나이다. 이는 보호살균제에 대한 검정방법으로 주로 사용되는 방법이다. Lee 등(2014)에 따르면 미토콘드리아의 호흡을 억제하는 QoI 계통의 살균제의 경우 보호살균제로 사욛되기 때문에 균사생장 억제 효과보다는 포자발아 억제효과를 보는 것이 더욱이 중요하다. 이처럼 살균제마다 적절한 방법을 사용하여 살균제 효과를 검정해야 한다.
국내에서는 경북지역을 중심으로 사과 재배지역의 병해 발생예찰 및 저농약 방제체계가 확산되고 있으나 균주들의 살균제 감수성 모니터링 작업은 미흡하다. 본 실험에서는 청송지역에서 분리한 사과탄저병원균을 해당 과원에서 사용하는 살균제를 선발하여 실내에서 한천희석법과 포자발아 억제 방법을 이용하여 조사하였다. 또한 현재 사용되는 살균제를 과원에 살포하는 농도로 사용하여 억제력을 검정하고, 분리된 종 간의 억제력 차이가 있는지를 규명하고자 하였다.
재료 및 방법
병원균의 분리 및 동정
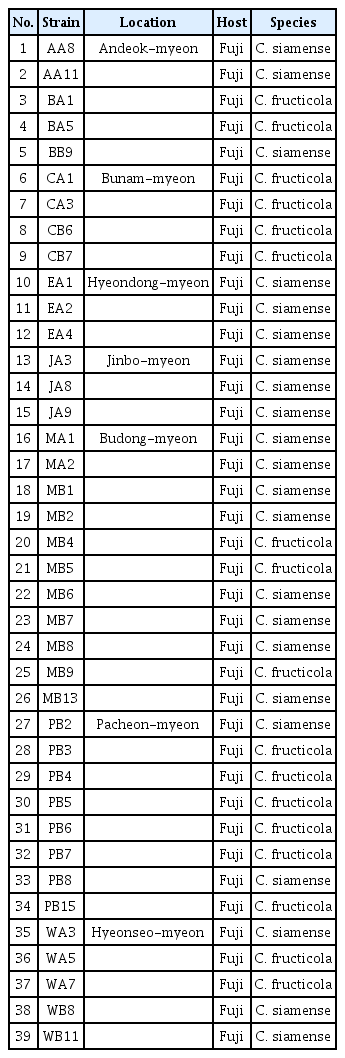
2018년 청송 7개의 읍면리(부남면, 부동면, 안덕면, 파천면, 진보면, 현동면, 현서면)에서 각각 2개의 과원(현서면은 1개)를 선발하여 총 13개의 사과 재배 지역에서 턴저병이 발생한 사과 열매를 채집하고, 분리하였다. 병원균을 분리하기 위해 탄저병 병징 부위를 메스로 잘라 1% 차아염소산나트륨 용액으로 30초간 침지하고 멸균수로 충분히 세척 후 필터페이퍼를 이용하여 물기를 제거한 후 감자한천배지(potato dextrose agar, PDA)에 치상하여 25°C 인큐베이터에서 배양하였다. 배양 2–3일 후 PDA에 형성된 균사 선단을 떼어내어 새로운 PDA에 배양하며 배양적 특징을 통해 탄저병균을 분리하였다. 분리한 균주들은 새로운 PDA에 접종하여 25°C 인큐베이터에서 7일간 배양하고, 균총의 균사 선단부에서 지름 3 mm의 균사 조각을 떼어내어 멸균된 20% glycerin 용액에 현탁하여 –80°C에서 보관하였고 PDA 사면배지에 배양하면서 사용하였다.
병원균을 동정하기 위하여 PDA 배지에서 병원균을 일주일간 배양한 후 HIGENE Genomic DNA Prep kit (BIOFACT, Daejeon, Korea)을 이용하여 total genomic DNA를 추출하였다. 이후 ITS1/ITS4 (White 등, 1990)과 T1/T2 (O’ Donnell과 Cigelnik, 1997) primer 세트를 이용하여 각 internal transcribed spacer (ITS)와 β-tubulin (TUB2) 유전자를 증폭하였다. 증폭된 poly-merase chain reaction (PCR) product를 HIGENE Gel & PCR purification Kit (BIOFACT)를 사용하여 정제한 후 Solgent (Solgent Co., Daejeon, Korea)에 의뢰하여 염기서열을 분석하였다.
분석된 염기서열 정보를 분자계통학적 유연관계를 분석하기 위해 NCBI GenBank database (National Center for Biotech-nology Information)에 등록되어 있는 Colletotrichum gloeosporioides complex에 속하는 모든 종의 type stain을 수집하여 ITS 및 TUB2 유전자의 염기서열을 결합하여 분석하였다. 계통수는 MEGA X program을 이용하여 maximum likelihood 방법을 사용하였다.
실험에 사용된 살균제
살균제 감수성 시험에 사용된 살균제는 시판되는 12 종류의 살균제(단제 및 합제)를 선발하여 사용하였다. 시험에 사용된 살균제는 ‘다3’군 (C3)에 속하는 trifloxystrobin과 kresoxim-methyl, ‘다5’군(C5)에 속한 fluazinam, ‘사1’군에 속한 tebuconazole과 metconazole, ‘카’군(M)에 속하는 dithianon과 captan, ‘차1+카’군(P01+M)에 속하는 혼합제는 ASM+dithianon과 ASM+chlorothalonil을 선발하여 실험을 진행하였다. 이들 농약의 살균 작용 기작에 대해서는 Fungicide Resistance Action Committee (2022)의 코드에 의해 알려져 있다. 살균제의 선발은 청송 지역의 과원에서 농민들이 주로 사용하는 살균제를 설문조사하여 이를 위주로 선발하였다(Table 1).
한천 희석법에 의한 살균제별 균사생장 억제 실험
경상북도 청송군 내 13개 사과 재배 지역의 탄저병 이병과로부터 분리된 39개 균주를 대상으로 12개 살균제에 대한 약제 감수성을 조사하였다. 살균제배지를 조제하기 위해 1 liter 삼각플라스크에 마그네틱 바를 함께 넣은 500 ml PDA를 고압멸균기로 121°C 에서 15분간 살균하였다. 이후 40–50°C 정도로 식힌 후 실험에 사용할 살균제를 작물보호 협회에 등록된 작물보호 지침서에 등재된 실제 농과원 살포농도를 기준으로 반량, 정량, 배량의 희석 배율로 조정하여 최종농도가 되게 희석하였으며, 세균의 오염을 방지하기 위하여 300 μ g/ml의 streptomycin을 첨가하였다. 각 농도로 희석된 PDA에 교반기를 이용하여 고르게 혼합한 다음 90 mm Petri dish에 분주하여 살균제 배지를 제조하였다. 이번 실험에서 분리한 39개의 사과 탄저병균을 PDA에 접종하여 25°C 7일간 배양한 후 균주의 균총을 직경 3 mm의 cork borer를 이용하여 agar plug를 준비하고, 각각의 살균제 배지와 무첨가 PDA 배지(대조구)에 배양하였다. 모든 처리구는 3반복으로 진행하였다. 25°C 인큐베이터에서 7일간 배양 후, 생장한 균사의 직경 길이를 측정하여 살균제에 의한 균사생장억제율을 조사하였다. 균사생장 억제율은 다음과 같은 계산식으로 산출하였다.
살균제별 포자발아 억제 실험
39개 균주의 포자 형성을 위해 병원균을 25°C PDA 배지에서 7일간 배양한 후, 멸균한 슬라이드글라스로 공중균사를 제거한 후 상온에서 포자 형성을 유도하였다. 형성된 포자는 멸균증류수를 부어 수확한 후, 멸균된 거즈에 여과하여 균사조각을 제허나 포자 현탁액을 얻었다. 포자 현탁액은 3,000 rpm으로 20분간 원심분리한 후, 다시 멸균수에 현탁하여 포자의 최종 농도가 2×105 conidia/ml가 되도록 조절하였다. 멸균된 슬라이드글라스 위에 15 mm×15 mm로 잘라 멸균한 셀로판막을 올려놓고 실시하였다. 셀로판막 위에 한천희석법에 사용한 동일한 농도가 될 수 있게 포자현탁액과 살균제를 희석하여 10 μ l를 셀로판막 위에 접종한 후 커버글라스를 덮은 뒤, 습실처리된 Petri dish 에 넣어 24시간 동안 25°C 인큐베이터에서 배양한 후 발아한 포자수를 세었다. 모든 처리는 3반복으로 실시하였다. 포자발아 억제율은 아래의 식으로 계산하였다. 이때 포자의 발아여부는 발아관이 포자의 장경보다 길게 발아한 경우만 발아한 것으로 판단하였다.
사과탄저병원균의 살균제 반응 경향성 조사
실험에 사용된 39균주와 12종의 살균제 감수성 정도를 조사하기 위하여, 균사생장, 포자발아 억제율에 대한 각 처리구의 억제율을 통하여 EC50 값을 R 프로그램 EC50estimator Package (Ritz 등, 2015)를 이용하여 측정하였다. 농과원에서 실제로 사용되고 있는 희석배율의 살균제 효과를 이용하여 heatmap 그래프를 R 프로그램 ggplot2 Package (Wickham 등, 2016)를 이용하여 그린 후 살균제 저항성 반응의 경향성을 분석하였다.
통계처리
실험실에서 실시한 각 살균제의 방제효과는 처리별로 3반복으로 진행하였으며, 각 처리별 그래프는 Sigma-Plot for Windows version 10.0 (Systat Software Inc., San Jose, CA, USA)를 이용하였으며 EC50 값의 계산은 R studio version 2022.02.3 (R Development Core Team, 2009)에서 진행하였다.
결과 및 고찰
병원균의 분리 및 동정
2018년 경상북도 청송군에서 분리된 39개의 사과탄저병 균주를 시험에 사용하였다(Table 2). 이 균주들을 ITS, TUB2 유전자를 이용해 계통발생학적 분석을 하였다. 그 결과 17 균주는 C. fructicola ICMP:18581와 그룹이 이루어졌고, 22 균주는 C. siamense ICMP:18578와 그룹이 이루어졌다(Fig. 1). 기존에 보고된 사과 탄저병의 병원균은 C. gloeosporioides였으나, Park 등(2018)에서 보고된 바와 같이 기존에 국내에 보고된 사과탄저병원균은 C. gloeosporioides species complex의 C. siamense와 C. fructicola로 동정되었다. 최근 보고된 사례에서 C. siamense, C. fructicola, C. gloeosporioides, C. nymphaeae, C. frioriniae 5종이 사과탄저병 병원균으로 동정 되었으나, C. siamense와 C. furcticola 2종이 국내에서 우점중인 사과탄저병 원인 병원균으로 판단된다(Oo 등, 2018)

A phylogenetic tree construbed using sequences of 39 Colletotrichum gloeosporioides complex from apple bitter rot symp-toms in Cheongsong combined internal transcribed spacer (ITS) and β-tubulin (TUB) genes. Bootstrap values >50% (1,000 replication) are given at the nodes. Colletotrichum acutatum was used as the outgroup. T, ex-type or ex-epitype isolates in GenBank.
분리 균주의 살균제 감수성 실험
한천희석법을 이용하여 총 12품목의 살균제를 실내 검정하였다. 살균제 희석 농도는 실제 필드 사용 농도를 기준으로 반량, 정량, 배량의 희석농도를 이용하여 진행하였다(Fig. 2).

The images of representative strain for fungicide sensitivity test using media method. The response of Colletotrichum fructicola MB5 on potato dextrose agar plates containing fungicides. Concentrations of various fungicides, such as trifloxystrobin, kresoxim-methyl, fluazinam, metconazole, tebuconazole, captan, dithianon, acibenzolar-s-methyl+chlorothalonil and acibenzolar-s-methyl+dthianon, were ad-justed to 1/2, 1, and 2 times of field concentration, respectively.
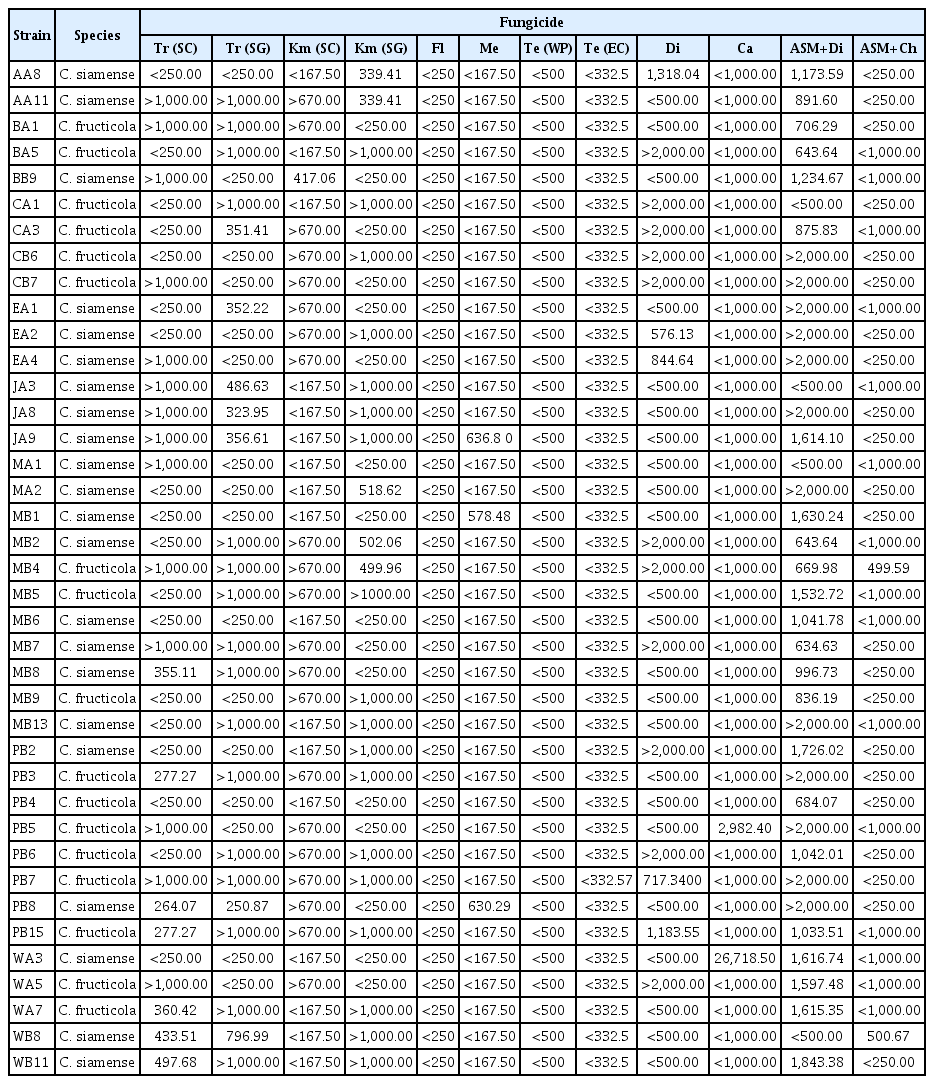
세포 호흡을 저해하는 QoI 계통의 살균제는 미토콘드리아 전자전달계의 복합체 III를 구성하는 cytochrome bc1 효소의 기능 저해제(‘다3’군, C3)인 trifloxystrobin 및 kresoxim-methyl 살균제를 선발하여 조사한 결과 균사생장 억제 효과에서는 60% 이하의 저항성 반응을 보였으나, 포자 발아 억제능력에서는 60% 이상의 중도저항성 반응과 80% 이상의 감수성 반응을 보였다(Figs. 3, 4). 제형 간의 차이는 보이지 않았다. 이러한 결과는 Lee 등(2014)에 따르면 QoI 계통의 호흡저해와 관련된 살균제들은 포자의 호흡을 저해하여 발아를 억제하는 기작이기 때 문에 포자발아 억제 효과에서 더 높은 효과가 나타났다(Fig. 4). 치료효과검정에서 청송군 내 모든 지역에서 저항성 반응을 보였지만, 예방효과에서는 감수성 반응과 중도저항성 반응이 나타났다(Table 3). 이 실험에 사용한 4개의 QoI 계통 살균제에서 예방효과에서 일부 다른 반응이 나타났다. Trifloxystrobin 22% SC는 13개의 과원 중 6개 과원(진보 B, 파천 A, 안덕 A, 현서 A, 청송 A, 부남 A)에서 중도저항성(억제율 60–80%)을 보이는 균주가 있으며 나머지 모든 지역에서는 감수성 반응이 나타났다. trifloxystrobin 50% SG는 13개의 과원 중 7개 과원(진보 A, 파천 A, 파천 B, 안덕 A, 현서 A, 부동 B, 부남 B)에서 중도저항성을 보이는 균주가 나타났다(Fig. 5). Kresoxim-Methyl 44.2% SC의 경우 13개의 과원 중 4과원(부동 A, 부동 B, 현동 A, 현서 A)에서 중도 저항성 반응을 보였다(Table 3). Kresoxim-methyl 50% SG 의 경우 13개의 과원 중 10과원(진보A, 진보B, 파천A, 파천B, 안덕A, 안덕B, 현서A, 부동A, 부남A, 부남B)에서 중도저항성 반응이 나타났다(Table 3).
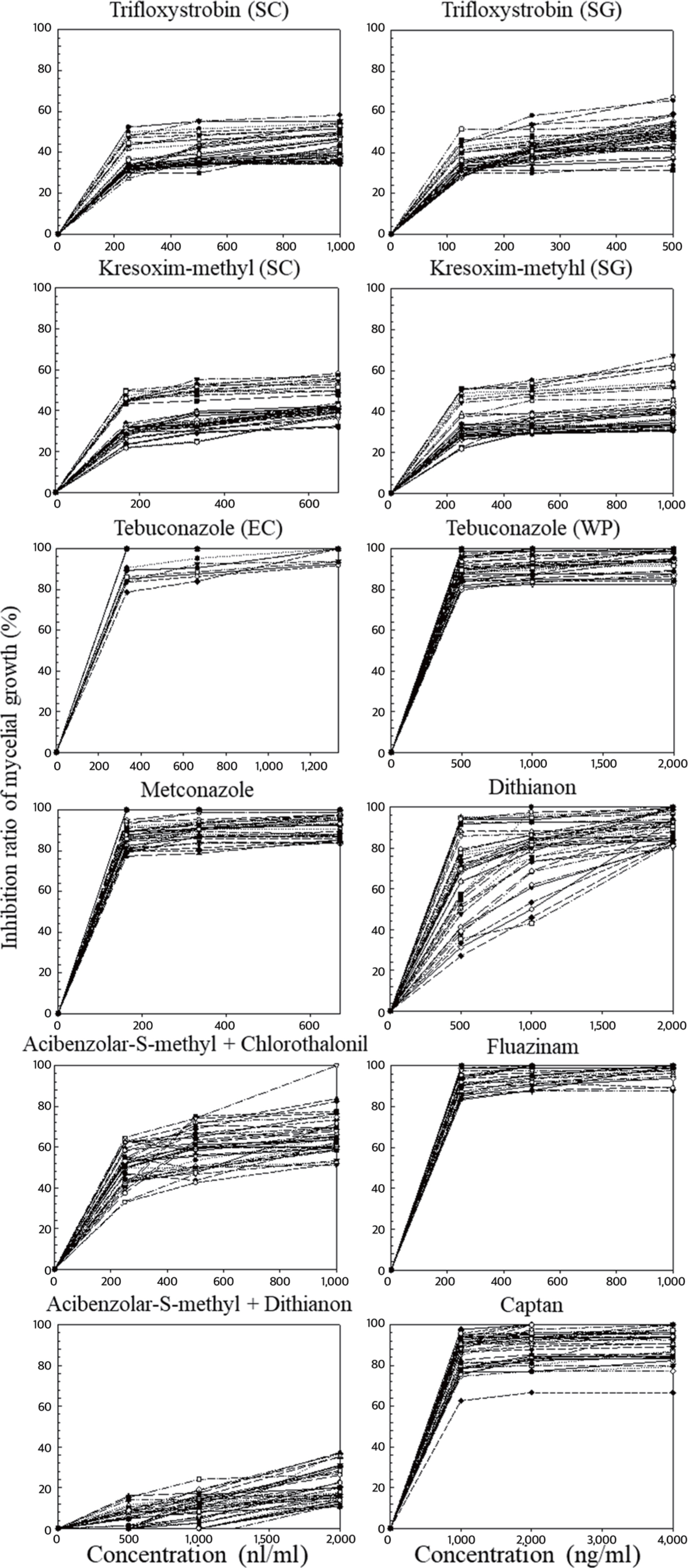
Inhibitory effect of several fungicides against the mycelial growth of Colletotrichum spp. The test was conducted on potato dextrose agar using an agar dilution method. Each line is the response of each isolate of Colletotrichum spp. causing apple bitter rot to the concentration of the fungicide.
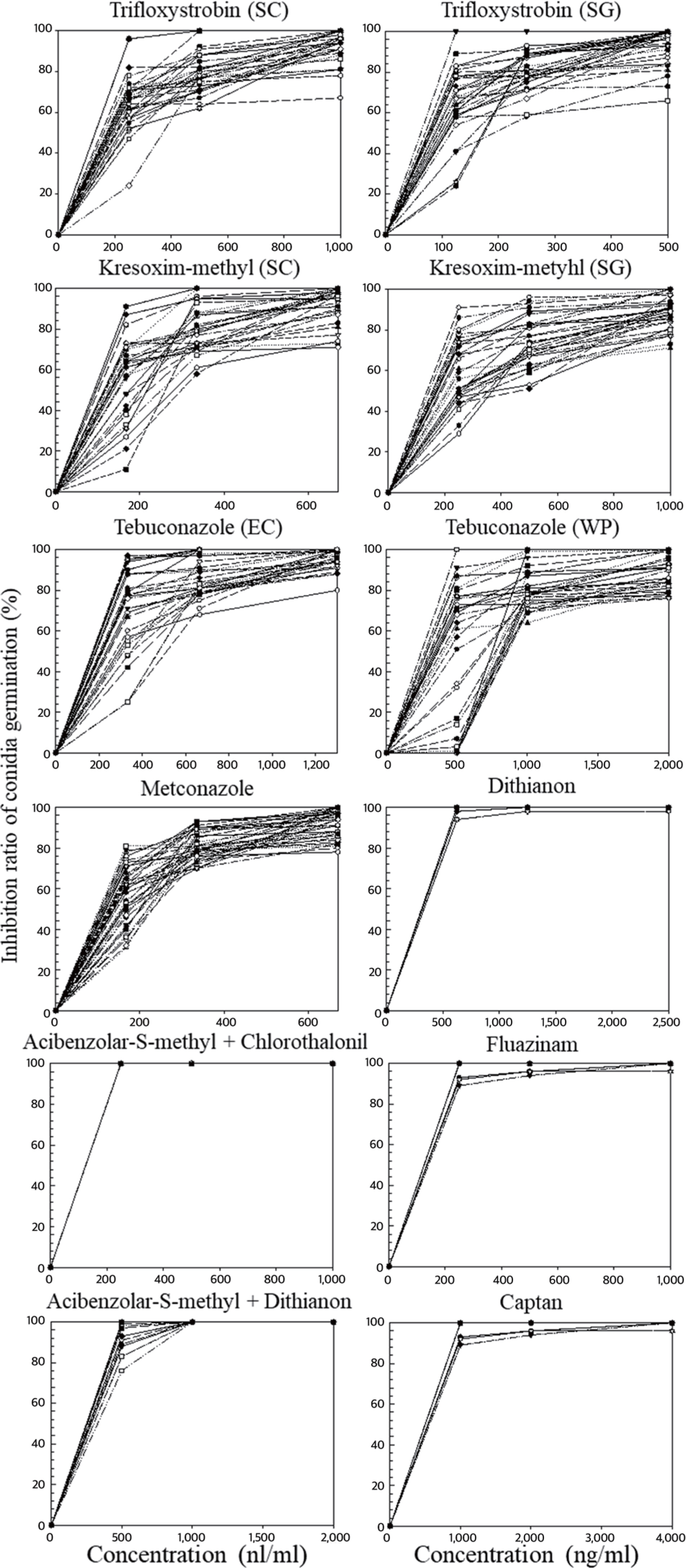
The inhibitory effect of several fungicides against the conidial germination of Colletotrichum spp. The test was conducted on glass slide placing mixture of both fungicide and conidial sus-pensions. Each line is the response of each isolate of Colletotrichum spp. to the concentration of the fungicide.
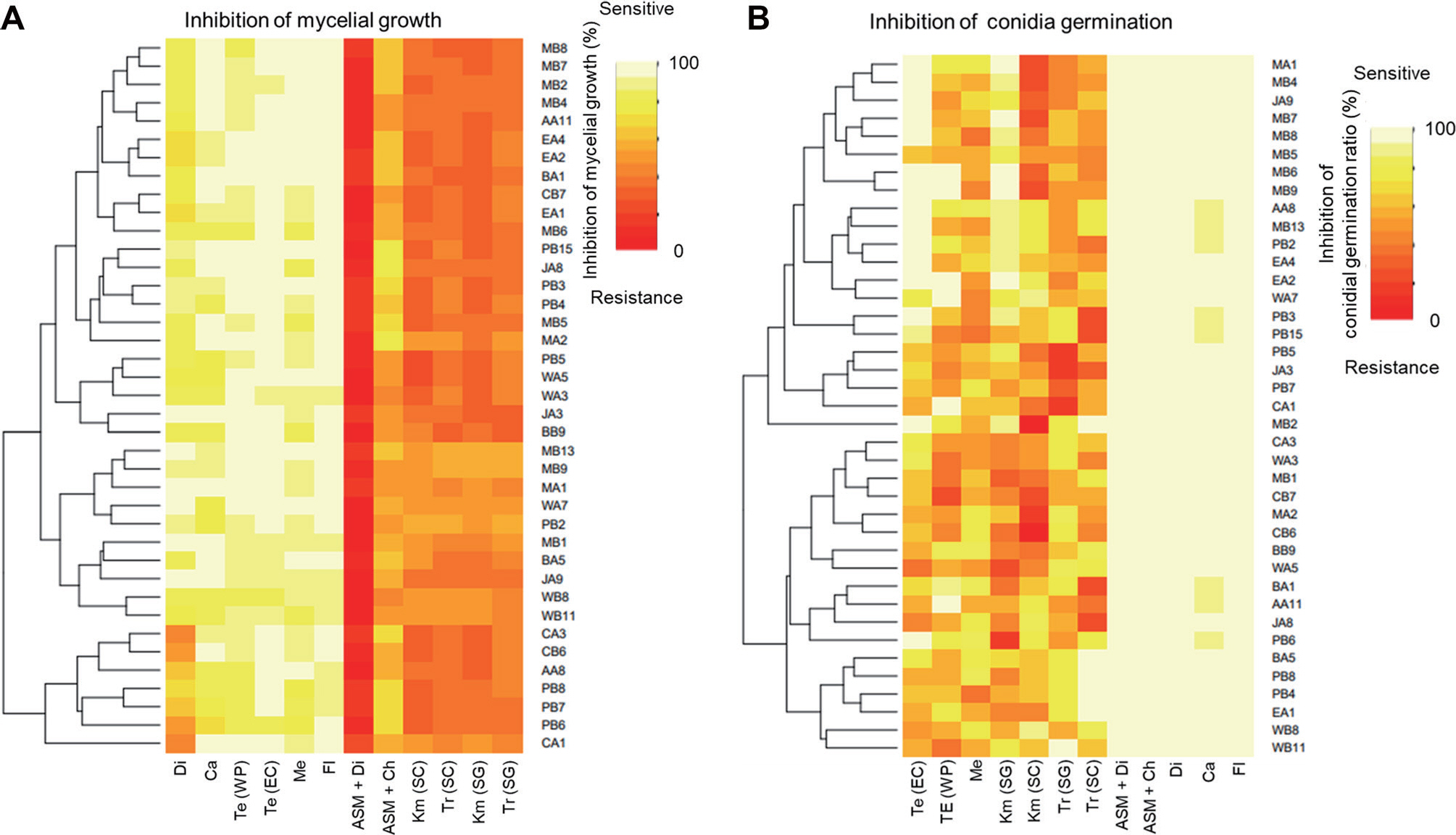
Heat map of fungicides sensitivity test in response to treatment with recommended concentrations against the growth of 39 strains. (A) Inhibition of mycelium growth. (B) Inhibition of conidia germination. The heat map was generated using ggplot2 package in R. Resistance indicates high orange/light-red indicates moderated resistance and white indicates highly sensitive to fungicides. Tr, trifloxystrobin; Km, kresoxim-methyl; Fl, fluazinam; Me, metconazole; Te, tebuconazole; Di, dithianon; Ca, Captan; ASM, acibenzolar-S-methyl; Ch, chlorothalonil.
‘다5’군(C5)에 속하는 fluazinam 살균제는 미토콘드리아 내막에서 H+ 이온의 이동을 억제하는 살균제이다. Fluazinam 살균제는 실험 농도 범위에서 80% 이상을 보였으며, 포자 발아억제능력에서도 90% 이상의 높은 억제효과를 보였다(Figs. 3, 4). 동일하게 호흡을 저해하는 살균제라고 하더라도 병원균의 종류와 미토콘드리아의 전자전달 과정에서 활성을 억제하는 작용점 효소가 달라짐에 따라서 균사 생장을 억제하는 효과는 크게 달라졌다(Do 등, 2020). 동일한 세포기관을 작용하는 경우에도 살균제의 화학 구조에 따라서 효과는 달라졌다. Fluazinam 역시 종간의 반응 차이는 없었으며, 적용농도의 1/2에서도 높은 억제율을 보여 실제 처리되고 있는 살균제가 필요 이상으로 고농도임을 알 수 있다(Figs. 3, 4). 치료효과와 예방효과 모두 우수하며, 청송군 13개 과원에서 모두 높은 감수성 반응을 보였다(Table 3)
DMI 계통에 속하는 ‘사1’군(G1)의 metconazole과 tebuconazole 살균제는 탈메틸 효소의 활성을 억제하여 에르고스테롤 생합성을 억제하는 살균제이다. 이 살균제들은 균사생장 억제에서 실험 농도에서 80% 이상의 높은 억제 효과를 보였다 (Fig. 3). 반면, 포자발아 억제 실험에서는 농도에 대한 차이가 보였으며, 적용농도의 1/2에서는 낮은 방제율을 보였다(Fig. 4). Tebuconazole의 경우 유제(EC)로 처리하였을 때는 대부분이 100%의 억제율을 보였지만, 수화제(WP)로 처리하였을 경우에는 80–100%의 유제보다 낮은 억제율을 보여주었다(Fig. 2). 실험에 사용한 ‘사1’군에 속하는 살균제 중 tebuconazole (EC)가 가장 효과가 우수하였다. 실험에 사용한 3개의 DMI 계통 살균제에서 높은 균사생장 억제 효과가 나타났다(Table 3). 예방효과예서는 사용한 약제 별로 다른 효과가 나타났는데, metconazole 20% SC에서는 13개의 과원 중 6개의 과원(진보 A, 진보 B, 파천 A, 파천 B, 부동 B, 현서 A)에서 중도저항성 반응을 보였다. Tebuconazole 25% WP에서는 13개의 과원 중 5개의 과원(파천 B, 현동 A, 안덕 A, 안덕 B, 현서 A)에서 중도저항성 반응이 나타났으며, tebuconazole 25% EC에서는 모든 지역에서 감수성 반응이 나타났다(Table 3).
다점 작용기작을 가진 ‘카’군에 속하는 captan (M04)과 dithianon (M09)살균제를 선발하여 실험을 진행하였다. 균사생장 억제실험에서 captan의 경우 한 균주를 제외하고 80% 이상의 높은 효과를 보였으나, dithianon의 경우 40–100%의 다양한 억제율을 보였다(Fig. 3). 반면에 포자발아 억제 실험에서는 모든 처리 농도에서 대부분의 균주가 100% 억제되었다(Fig. 4). Dithianon 살균제는 보호살균제로 사용하는 것이 바람직하다고 판단된다. 실험에 사용한 2개의 살균제 모두 우수한 치료효과를 가지고 있으며, dithianon 살균제에서는 부동 A 과원에서 저항성 반응이 나타났고 이외에 4개의 과원(부동 B, 부남 A, 부남 B, 현동 A)에서 중도저항성 반응이 나타났다(Table 3). Captan 살균제에서는 현동 A 지역에서만 중도저항성 반응이 나타났다(Table 3).
Systemic acquired resistance (SAR) 경로를 활성화시킴으로써 작물에 병 저항성이 유도되는 ‘차1’군(P01)에 속하는 ASM과 ‘카’군에 속하는 dithianon, chlorothalonil과의 혼합제인 ASM+dithianon과 ASM+chlorothalonil살균제를 선발하여 실험을 진행하였으며, ASM+chlorothalonil의 경우 균사생장 억제 실험에서 30–80% 낮은 억제율이 나타났다(Fig. 3). ASM+dithianon의 경우 모든 처리 농도에서 30% 이하의 현저히 낮은 억제율이 나타났다(Fig. 3). 반면에, 포자발아 억제 실험에서는 두 살균제 모두 적정농도 이상에서 포자 발아를 100% 억제했다(Fig. 4). 이는 ASM 살균제의 경우 식물체의 병 저항성을 유도하는 기작을 가진 살균제 이기 때문에 배지를 이용한 균사생장 억제 방법이나, 포자 현탁액을 이용한 포자 발아 억제효과를 검정하기 힘들다. 따라서 이들의 억제 효과는 dithianon과 chlorothalonil 살균제의 효과로 보는 것이 바람직하다. 예방효과에서 모든 지역에서 감수성 반응이 나타났다(Table 3). 모든 결과의 요약은 다음 표로 간략히 정리하였다(Table 3).
병원균의 살균제 저항성 경향성 분석
각 살균제의 권장농도에서의 균사생장, 포자발아 억제율을 바탕으로 저항성 경향성을 알아보기 위하여 Boxplot을 이용하여 분석하였다 (Supplementary Fig. 1). EC50값의 경우 실내시험에서 사용되는 농도와 실제 필드 사용농도가 상이하기 때문에, 높은 억제율을 보였다. 이에따라, 권장농도에서의 억제율을 기준으로 저항성을 평가하였다. 80% 이상 억제할 경우 ‘감수성’, 60% 이상 80% 미만의 경우 중도저항성, 60% 미만 억제할 경우 저항성을 기준으로 평가하였다. 계산된 EC50값은 다음과 같이 표시하였다(Tables 4, 5).

EC50 value (μg/ml or nl/ml) of several fungicides against conidial germination of Colletotrichum spp.
실제 사과 과원에서 사용할 수 있는 사과 탄저병 방제용으로 등록된 살균제의 경우 5 가지 계통이 있다(Korean Crop Protection Association, 2022). 이 중 세 가지 계통인 QoI, methyl benzimidazole carbamate (MBC; MoA code, B1; FRAC code, 1), DMI 살균제에 대하여 저항성이 보고되었고 연구되고 있는 실정이다(Martin 등, 2022; Wei 등, 2020). MBC 살균제(benzimidazole 계통)에 대한 약제 저항성이 보고된 이후, QoI 등 타 계통의 살균제를 이용하여 방제력을 유지하고 있지만, QoI 계통의 살균제에서도 저항성 발현이 보고됨에 따라 방제력 설정이 더욱 더 어려운 실정이다. 가장 많이 재배하는 품종인 ‘후지’품종을 기준으로 경북지방에서는 최소 12회 살균제 살포가 이루어지는데 이 중 9회가 사과 탄저병 살균제이다. 이 중 strobilurin 살균제와 benzimidazole 살균제는 저항성 발현이 확인되고 있으나, 대체할 살균제를 선발하지 못하고 있다. 만약 해당 살균제에 저항성이 발현되었을 경우 저항성 균이 과원에 그대로 남아 방제 효과가 미미할 수 있다. 저항성이 발현된 살균제에 대하여 무작정 다른 계통의 살균제로 대체하기에는 같은 시기에 발병하는 겹무늬썩음병과 같은 다른 병해도 방제해야 하기 때문에 고려할 사항이 많다.
저항성이 발현되고 있는 살균제를 관리하기 위해 같은 계통의 살균제를 연용 하지 말하야 하며, 사과탄저병에 대하여 방제력을 설립할 때 저항성 발현이 진행되고 있는 살균제를 특별 관리해야 한다. 저항성이 발현된 살균제에 대하여 무작정 다른 계통 살균제로 대체하는 것보다 유용미생물을 이용한 대체제를 선발하는 것도 하나의 방법이 될 수 있다. 이 후 지속적으로 병원균의 분포와 살균제에 대한 저항성 발현 여부를 모니터링할 필요가 있다.
Electronic Supplementary Material
Supplementary materials are available at Research in Plant Disease website (http://www.online-rpd.org/).
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This work was supported by Korea Institute of Planning and Evaluation for Technology in Food, Agriculture, Forestry (IPET) through Crop Viruses and Pests Response Industry Technology Development Program, funded by Ministry of Agriculture, Food and Rural Affairs (MAFRA)(320042-5).