인공접종을 통한 국내 야생 장미과 식물의 화상병 감수성 검정
Determination of Fire Blight Susceptibility on Wild Rosaceae Plants in Korea by Artificial Inoculation
Article information
Abstract
Erwinia amylovora에 의해 발생하는 화상병은 2015년 국내에서 처음 보고된 이후 전국적으로 확산되고 있다. 화상병은 벌과 같은 화분매개충, 강한 바람을 동반한 강수와 이병주 전정작업에 의한 전파 등 많은 경로를 통해 병원균 감염이 진행되어 발생한다. 이 외에도 자생하는 개야광나무속, 산사나무속, 피라칸다속, 벚나무속, 마가목속 등의 장미과 식물이 E. amylovora 의 기주식물과 전파원이 될 수 있음이 보고되어 있다. 그러나, 국내에서는 아직까지 자생하고 있는 장미과 식물의 화상병 감수성에 관한 연구가 많이 다뤄지지 않은 상황이다. 본 연구에서는 2020년부터 2022년까지 3년간 국내에서 채집한 야생 장미과 식물 10속 25종을 대상으로 화상병 감수성 검정을 진행하였다. 108 cfu/ml 농도의 E. amylovora 균액을 이용하여 채집한 식물의 꽃, 잎과 가지, 과실에 접종하고, 화상병 유사 병징 발현을 관찰하고 PCR을 통해 접종 조직 내의 E. amylovora 검출 여부를 분석하였다. 그 결과, 병징 발현과 병원균 검출 결과가 동일한 14종의 야생 장미과 식물을 확인하였다. 이러한 결과는 향후 적절한 화상병 방제 정책 수립에 기여할 수 있을 것으로 생각된다.
Trans Abstract
The fire blight caused by Erwinia amylovora (Ea) is a devastating disease of Rosaceae plants, including commercially important apple and pear trees. Since the first report in Korea in May 2015, it has been spreading to neighboring regions gradually. Host plants can be infected by pollinators like bees, rainfall accompanied by wind, and cultural practices such as pruning. Many studies have revealed that wild Rosaceae plants such as Cotoneaster spp., Crataegus spp., Pyracantha spp., Prunus spp., and Sorbus spp. can be reservoirs of Ea in nature. However, wild Rosaceae plants in Korea have not been examined yet whether they are susceptible to fire blight. Therefore, the susceptibility to fire blight was examined with 25 species in 10 genera of wild Rosaceae plants, which were collected during 2020–2022, by artificial inoculation. Bacterial suspension (108 cfu/ml) of Ea type strain TS3128 was inoculated artificially in flowers, leaves, stems, and fruits of each plant species, and development of disease symptoms were monitored. Moreover, the presence of Ea bacteria from inoculated samples were checked by conventional polymerase chain reaction. Total 14 species of wild Rosaceae plants showed disease symptoms of fire blight, and Ea bacteria were detected inside of inoculated plant parts. These results suggest that wild Rosaceae plants growing nearby commercial apple and pear orchards in Korea can be Ea reservoirs, and thus they should be monitored regularly to minimize the damage by Ea infection and spreading.
서 론
화상병(fire blight)은 Erwinia amylovora에 의해 장미과 식물에 발생하는 심각한 식물병이다. 화상병은 18세기 후반에 미국에서 처음으로 보고된 이래(Van der Zwet 등, 2012), E. amylovora 감염으로 화상병이 발생할 수 있는 기주식물의 범위에 대한 연구가 많이 진행되어 왔다. 화상병은 주로 사과와 배가 속한 Malus속과 Pyrus속 식물에 발병하여 경제적 피해를 주지만, 기주식물이 매년 추가되어 과수와 같은 경제식물과 관목 등의 관상용 식물에 이르기까지 장미과 식물 총 40속 200여 분류군에서 발병되는 것으로 알려져 있다(Végh와 Palkovics, 2013).
화상병의 주요 병징은 꽃, 잎, 가지, 그리고 과실에서 확인할 수 있다. 꽃은 화분매개충에 의한 전파를 통해 E. amylovora 감염이 주로 일어나는 부위로 알려져 있다(Choi 등, 2022). 암술머리 표면에서 E. amylovora의 증식이 이루어지며, 병이 진전될수록 꽃이 본래의 색을 잃고 갈변하며, 탈락하게 된다(Malnoy 등, 2012). 잎은 감염 초기에 수침상과 암녹색 변화가 나타나며, 병이 진전될수록 시듦 증상과 암갈색으로 변색되어 가지 끝에서 떨어지지 않고 말라붙은 채로 남아있게 된다(Vrancken 등, 2013). 새순 및 가지에서는 암갈색으로 색이 변화함과 동시에 ‘ Sheperd’ s crook’이라고 명명된 선단부가 굽어지는 현상이 발생하게 된다(Gusberti 등, 2015). 과실의 경우 과경(pedicel or peduncle) 부위부터 병징이 진전되어 전체적으로 검게 변색되며, 심할 경우 우윳빛 또는 연한 황색을 띠는 균액(ooze)이 누출되는 모습을 보인다. 이러한 병징은 상대적으로 나이 많은 부위보다는 어린 부위에서 발생빈도가 높다고 알려져 있다. 화상병에 대한 저항성이 없는 사과 및 배와 같은 기주식물은 최종적으로 고사하며, 전염성이 매우 강하여 이병주를 방치할 시 과수원 전체로 전염되어 치명적인 경제적 손실을 유발하게 된다(Lee 등, 2018).
화상병은 국내에서 2015년 경기도 안성에 위치한 배 과수원에서 처음 발견되었으며, 같은 해에 사과에서도 병 발생이 확인되었다(Myung 등, 2016a; Park 등, 2016). 이후 전국적으로 확산되어 사과 및 배 과수농가에 심각한 경제적 손실을 유발하고 있다(Ham 등, 2020; Lee 등, 2022). 이에 정부와 지자체는 화상병의 전파를 막기 위하여 발생 과원내 모든 기주식물을 제거하는 공적방제 정책을 펼치고 있다. 이때, 사과와 배와 함께 모과나무(Chaenomeles sinensis), 야생 능금, 복사나무(Prunus persica), 살구나무(Prunus armeniaca), 산사나무(Crataegus pinnatifida) 등의 기주식물도 함께 제거하고 있다(Park 등, 2017). 이외에 화상병 예방을 위해 병이 주로 발생하는 개화기에 스트랩토마이신과 같은 항생제를 살포하고 있으며, 구리제, 옥솔린산 등 다양한 형태의 방제제들이 예방 목적으로 사용되고 있다(Ham 등, 2022). 더불어 생물학적 방제제 개발을 위한 다양한 연구들이 수행되고 있다(Kim 등, 2022; Park 등, 2022).
그러나 화상병이 발병할 수 있는 야생 기주식물들에 대한 국내 연구는 일부를 제외하면 미비한 상황이기에, 제거대상이 될 수 있는 기주식물의 범위에 대한 연구가 필요한 상황이다. 따라서, 본 연구는 국내에서 자생하고 있는 야생 장미과 식물 25종을 이용하여 화상병에 대한 감수성 검정을 실시하였으며, 이들 야생 장미과 식물의 병징 발현 특징을 조사하였다. 이를 바탕으로 최종적으로는 야생 장미과 식물에 의한 E. amylovora의 토착화 및 전파를 미연에 방지하는 데 기여하고자 수행되었다.
재료 및 방법
접종 균주 및 생장조건.
국내에서 자생하고 있는 야생 장미과 식물에 대한 화상병 감수성 검정을 위한 접종 실험에 사용할 대표균주로 E. amylovora TS3128을 사용하였다(Lee 등, 2018). E. amylovora는 MGY 배지(mannitol glutamate yeast extract; D-mannitol 10 g, L-glutamic acid 2 g, KH2 PO4 0.5 g, NaCl 0.2 g, MgSO4·7H2 O 0.2 g, yeast extract 1 g, agar 15 g/l, pH 7.0)에 접종하여, 배양기 내에서 2일간 26 o C 환경에서 배양 후 실험에 사용하였으며, polymerase chain reaction (PCR)을 통한 E. amylovora 검출을 위해 colony를 희석하여 이용하거나 gDNA를 추출하여 검사를 진행하였다.
야생 장미과 식물 목록 및 채집 지역
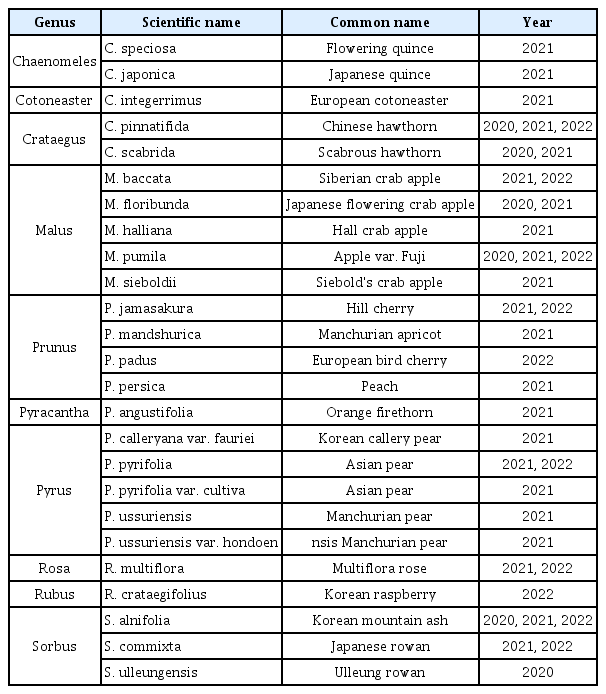
국내에 자생하는 장미과 식물에 대한 화상병 감수성 검정을 실시하기 위하여, 2020년부터 2022년까지 3년간 전국 16개 시∙군에서 총 10속 25종의 야생 장미과 식물을 채집하여 실험에 이용하였다(Fig. 1). 대조군으로 사용한 사과 ‘부사’는 경희대학교 국제캠퍼스 과수원에서 당일에 채집하여 사용하였다. 실험에 이용한 장미과 식물은 분류군에 따라 표로 정리하였다(Table 1). 재검정이 필요한 식물은 당해연도 또는 이듬해에 새롭게 채집하여 사용하였다.
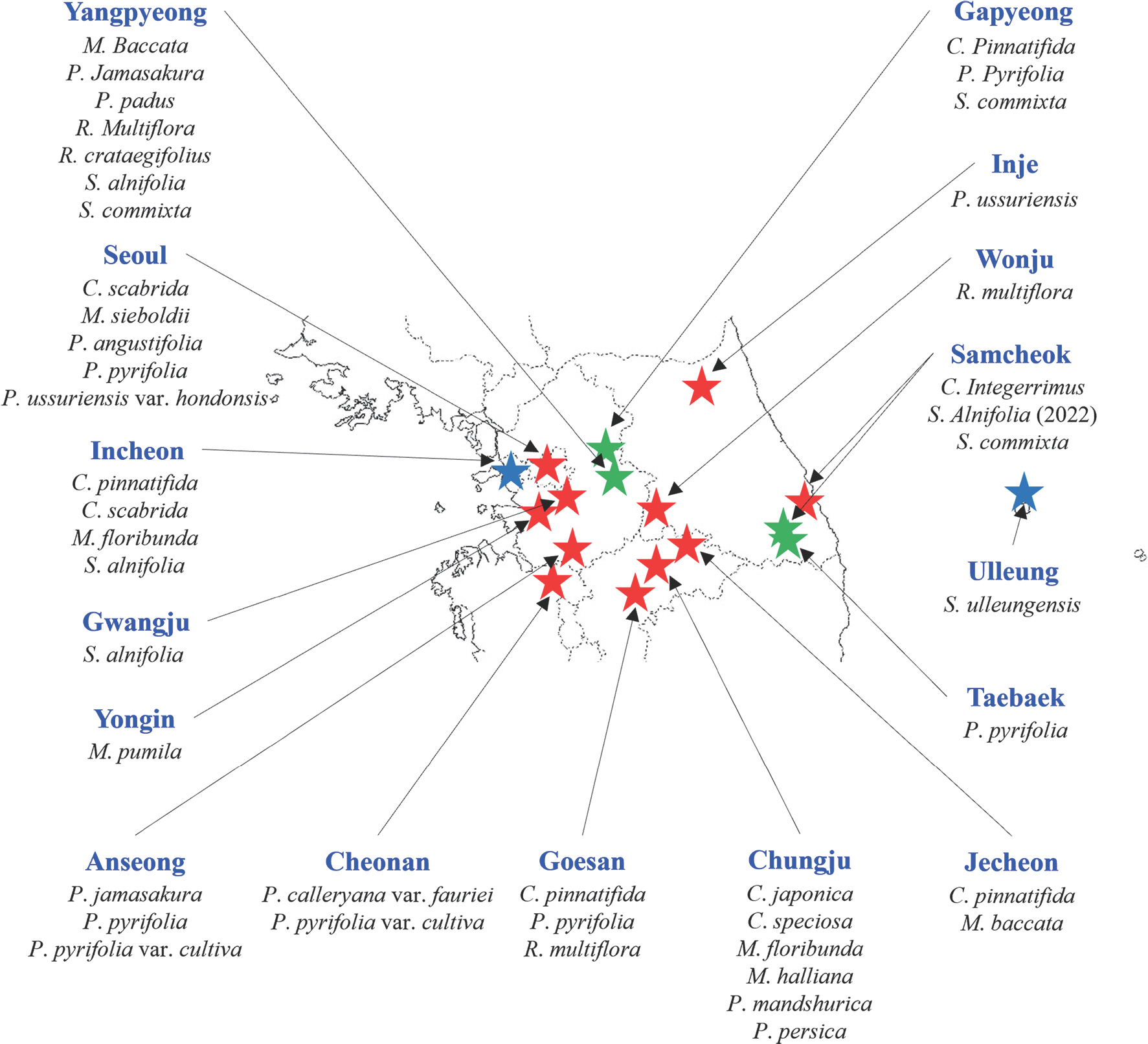
Geographical location of wild Rosaceae plants collected in Korea from 2020 to 2022. The blue, red, and green stars indicate the locations of collected plant samples in 2020, 2021, and 2022, respectively. The map was obtained from the National Geographic Information Institute (NGII) in Korea.
야생 장미과 식물에 대한 조직별 화상병 감수성 검정
채집한 야생 장미과 식물은 조직별로 나누어 감수성 검정을 실시하였다. 개화한 상태의 꽃을 꽃자루와 함께 가지로부터 절단하여, 매 접종 시 처리구별로 10여개 정도를 사용하였다. 채집한 꽃은 1% chlorine dioxide (ClO2)에 암술과 수술을 제외한 나머지 부분을 담가 살균하였으며, 잔여물을 제거하기 위해 멸균수(sterilized H2 O)에 두 번 세척하였다. 이 과정은 각 처리 단계마다 최소 30초씩 실시하였다. 세척한 꽃은 1.5 ml 또는 2 ml의 10% sucrose 용액을 넣은 2 ml microtube에 꽃자루가 잠길 수 있도록 하였다. 다음으로 0.01 % Silwet L-77 (MOMENTIVE Co., Ltd., Seoul, Korea)을 첨가한 108 cfu/ml의 E. amylovora 균액과 10 mM MgCl2를 각각 positive control과 negative control로 하여 준비한 꽃의 암술머리에 20 μ l씩 접종하였다(Fig. 2A). 접종 후 접종액이 다 마를 때까지 기다린 후 컨테이너 박스에 옮겨서 병 발생 여부를 확인하였다.
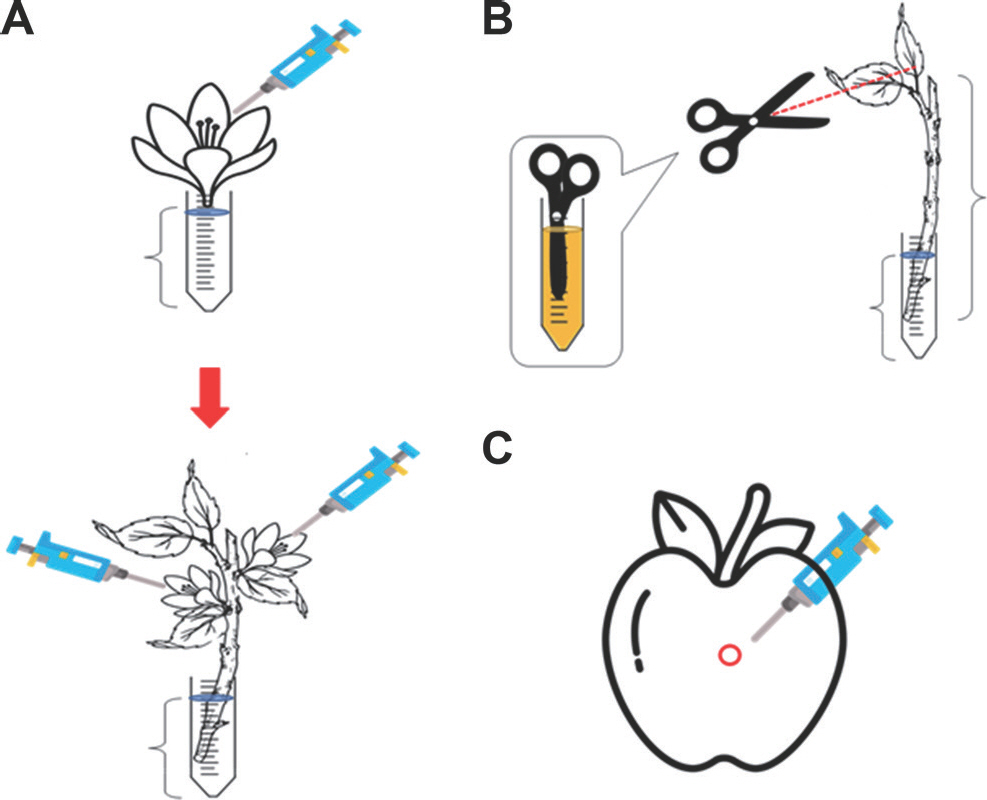
The scheme of the inoculation methods to confirm a fire blight susceptibility in wild Rosaceae plants. (A) The inoculation on the flower. The flowers were cut from the pedicel and placed into 2 ml of 10% sucrose solution, and then 20 μl of bacterial suspension (108 cfu/ml of Erwinia amylovora TS3128) was dropped on the stigma. In 2022, the method was modified, so that the flower clusters were detached from the twig and placed into 4 ml of sterilized tap water. (B) The inoculation on the leaf and twig. Young twigs with leaves were soaked in 4 ml of sterilized tap water. Leaves were cut in a diagonal direction with a scissor, which was sufficiently soaked in the bacterial suspension. (C) The inoculation on the fruit. Fruits were punched to make a hole by pipette tip or needle of a syringe. The 20 μl of bacterial suspension was dropped into the hole. All inoculated samples were kept in insulated moist plastic boxes at 26 o C.
야생 장미과 식물의 가지 및 잎에 대한 감수성 검정은 2년생 가지를 이용하여 진행하였다. 채집한 2년생 가지를 잎을 포함하여 약 10 cm 길이로 다듬어 사용하였으며, 이 때 잎은 최소 3장 이상은 남겨두었다. 표면소독을 위하여 가지의 잘린 끝 부분을 1% ClO2에 담가서 소독한 뒤 멸균수를 이용하여 두 번 헹궈주었으며, 각 단계마다 30초 이상 실시하였다. 이 때, 멸균 시에 사용한 용액이 접종에 주는 영향을 최소화하고자 잎이 용액에 닿지 않도록 주의하며 멸균을 진행하였다. 소독한 가지는 멸균한 수돗물 4 ml을 넣은 5 ml microtube에 꽂고, 0.01% Silwet L-77을 첨가한 108 cfu/ml의 E. amylovora 균액과 10 mM MgCl2를 가위에 묻혀, 잎을 비스듬하게 자르는 방식으로 접종하였다(Fig. 2B).
과실의 경우는 살균 및 소독한 후 0.01% Silwet L-77을 첨가한 108 cfu/ml의 E. amylovora 균액과 10 mM MgCl2를 과실 표면에 pipette tip을 이용하여 구멍을 낸 후, 20 μ l씩 주입하여 접종하였다(Fig. 2C). 산사나무와 미국산사(C. scabrida)의 경우 과실의 크기가 작고 과립형이었기에 개별 과실을 주사바늘로 찔러 구멍을 낸 후 용액에 담그는 방식으로 접종하였다. 접종한 과실은 그 크기에 따라 6, 12, 24 well plate (SPL, Pocheon, Korea)에 올려 고정시켰다.
접종이 끝난 꽃, 잎과 가지, 과실은 습도 유지를 위해 멸균처리한 수돗물을 적신 종이 혹은 티슈가 깔린 투명한 플라스틱 용기에 담아 26 o C의 실내에서 일정한 광조건(light/dark; 14 hr/10 hr)으로 과실은 약 7일간, 꽃, 잎, 그리고 가지는 약 10일간 보관 후 병징 발현 유무를 확인하였다.
야생 장미과 식물 내 E. amylovora 검출
과실은 접종 후 7일, 꽃과 잎, 가지는 접종 후 10일 후에 세균 분리를 실시하였다. 식물 내부에 존재하는 세균만을 검출하기 위하여 식물 표면을 1% ClO2로 살균 후 다음 과정을 진행하였다. 살균한 모든 야생 장미과 식물 부위를 잘게 마쇄한 뒤, 멸균수를 넣어 30분간 균을 추출하였다. 추출한 마쇄액은 cell strainer (SPL)를 이용해 이물질을 제거한 후 10-7배까지 단계적으로 희석 후, MGY배지에 농도별로 10 μ l씩 dotting하여 26 o C 조건에서 2일간 배양하였다. 배양 후 E. amylovora colony의 대표적인 특징인 점액성을 가진 유백색 colony들에 대해서 PCR을 실시하였다(Powney 등, 2011). 총반응액이 20 μ l가 되도록 2× Taqbasic PCR Master Mix 2 (Biofact, Daejeon, Korea) 10 μ l, 정방향 및 역방향 프라이머 A (5′-cggtttttaacgctggg-3′)와 B (5′-gggcaaatactcggatt-3′) 각 1 μ l, 배양한 균을 멸균수에 푼 균액 1 μ l, 그리고 positive control과 negative control로서 E. amylovora TS3128 균액과 멸균수를 1 μ l씩 이용하였으며, 총반응액량은 멸균수를 추가하여 조절하였다. PCR 과정은 2× Taqbasic PCR Master Mix 2에 동봉된 매뉴얼을 따라 실시하였다.
결과 및 고찰
국내 야생 장미과 식물에 대한 조직별 E. amylovora 접종 결과
2020년부터 2022년까지 3년간 국내에 자생하고 있는 장미과 식물들의 화상병에 대한 감수성 검정을 실시하였다. 전국에 위치한 16개 시∙군에서 총 10속 25종의 장미과 식물을 채집하여 실험을 진행하였다(Table 1, Fig. 1). 채집된 모든 야생 장미과 식물은 화상병 감수성 검정을 위해 E. amylovora 접종 후 병징을 확인하였다. 이후 병징 발현 유무와 관계없이 접종 표본 내에 E. amylovora가 존재하고 있는지 확인하고자 PCR 분석을 수행하였다. 검정 결과와 의미를 속별로 나누어 기술하였다.
명자나무속(Chaenomeles), 개야광나무속(Cotoneaster), 산사나무속(Crataegus) 검정 결과
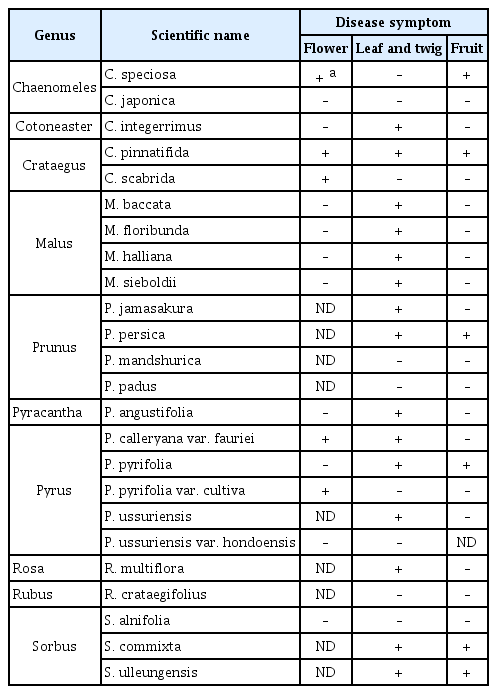
명자나무속 식물은 다른 장미과 식물과 함께 E. amylovora의 기주식물로 보고되어 있다(Van der Zwet 등, 2012). 명자나무(C. speciosa)의 경우 여러 품종에 E. amylovora를 인공 접종하였을 때, 품종에 따라 병징 발현 정도가 약 15–96%에 이를 정도로 차이가 큰 것으로 보고되었다(Bell 등, 2004). 국내에 자생하는 명자나무는 C. speciosa (Sweet) Nakai로(GBIF Secretariat, 2022; National Institute of Biological Resources, 2022), 화상병에 대하여 강한 저항성을 보인다는 연구 결과가 있다(Bell 등, 2004). 국내에서 채집한 명자나무 꽃과 과실에 10 mM MgCl2와 E. amylovora를 접종한 후 10일이 지난 뒤 병징을 확인한 결과, 꽃의 암술머리가 갈변하는 증상을 확인하였다(Table 2, Fig. 3). E. amylovora를 접종한 과실은 접종 부위 둘레에 암갈색의 병반이 발생하였으며, 증상이 진전될 경우 유백색의 균액 누출(ooze)이 관찰되었다. 가지와 잎에서는 화상병 유사 증상이 확인되지 않았으나, PCR 검사를 통해 잎, 가지에서 E. amylovora 를 확인하였다(Table 3, Fig. 4). 또한, 병징을 나타냈던 꽃과 과실에서도 E. amylovora가 검출되었으며, 과실에서 누출된 균액에서도 E. amylovora가 검출되어, 균액 누출이 접종균에 의해 발생한 것임을 확인하였다. 실험을 통해 명자나무는 접종을 통한 병징이 뚜렷하고 접종 부위 내에서 E. amylovora가 검출되었음을 확인하였다. 이와 같은 결과는 화상병에 저항성을 지니고 있다는 기존 연구 결과와 상반되기에 추가실험을 통한 확인이 필요하다고 생각된다.
Summary of disease symptom development in wild Rosaceae plants in Korea after inoculation of Erwinia amylovora
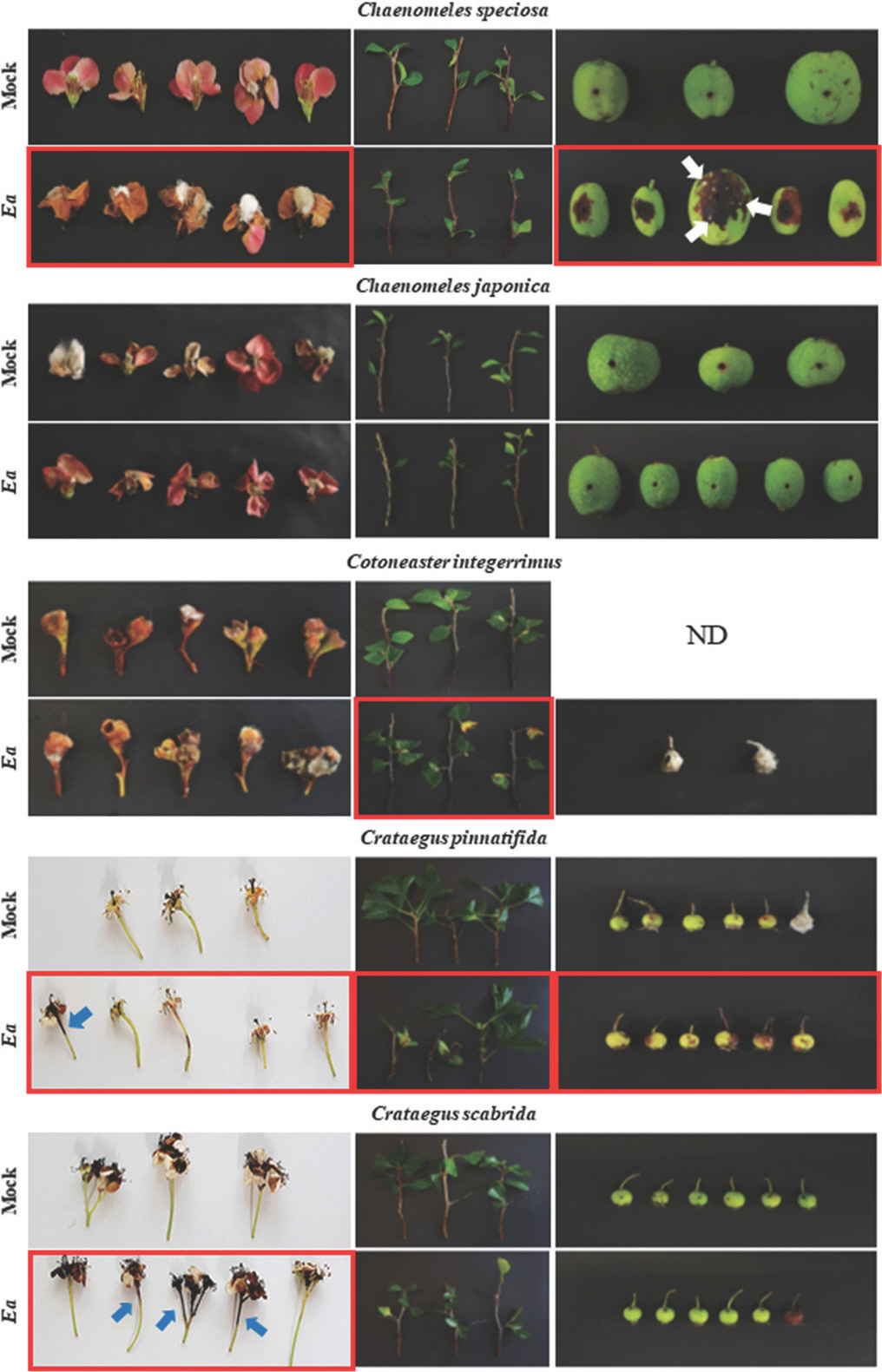
Screening of the fire blight susceptibility in the genera Chaenomeles, Cotoneaster, and Crataegus. All plants samples were inoculated with 108 cfu/ml of Erwinia amylovora (Ea) TS3128. The white and blue arrows indicate the bacterial ooze on the Chaenomeles speciosa surface and discoloration on the pedicel of Crataegus pinnatifida and Crataegus scabrida by Ea infection, respectively. The samples showing suspicious disease symptoms were remarked by the red boxes. The photos were taken 8 to 11 days after inoculation. ND, not determined.

Summary of the PCR results to detect Erwinia amylovora in the inoculated parts of wild Rosaceae plants in Korea
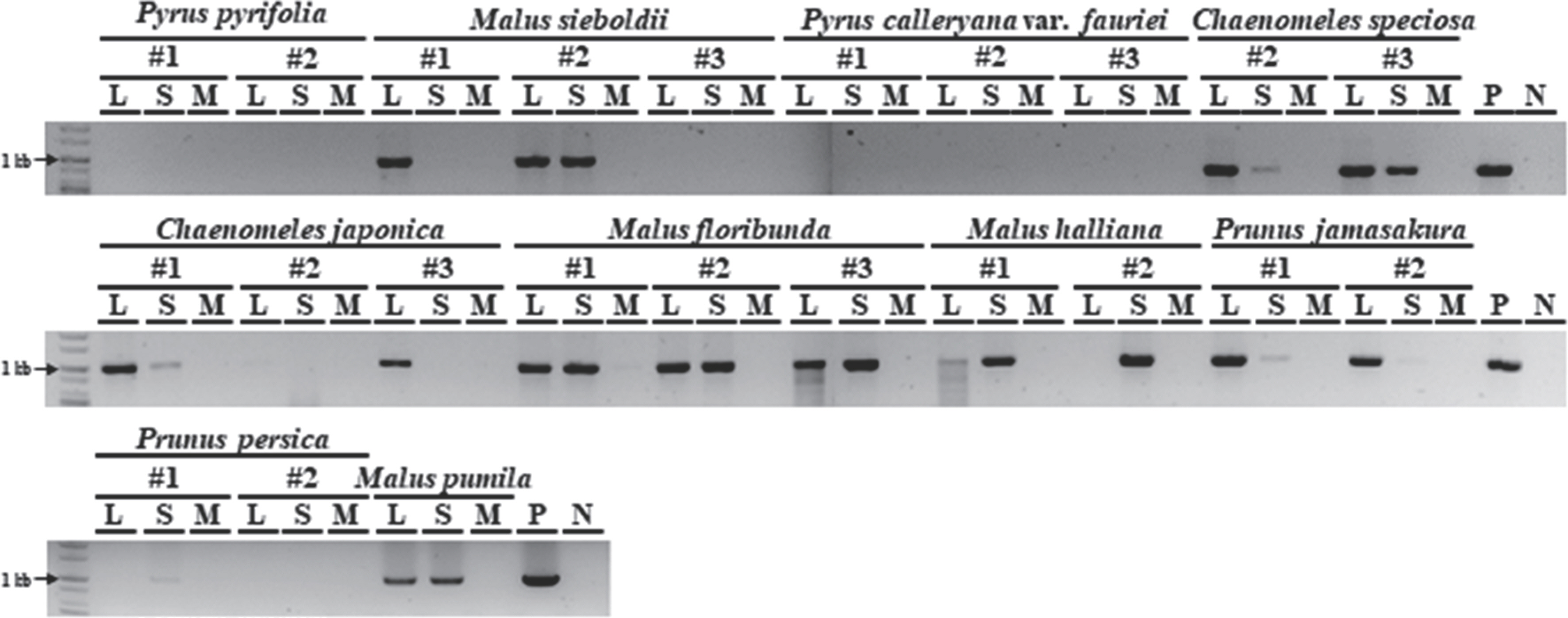
Detection of Erwinia amylovora in both inoculated and non-inoculated parts of the wild Rosaceae plants by conventional polymerase chain reaction (PCR). E. amylovora TS3128 was detected from inside of several inoculated samples. The bands between 900 bp to 1.1 kb corresponded the PCR product of E. amylovora pEA29 by a specific primer set. M, the mock with 10 mM MgCl2; L, leaf samples; S, stem samples; P, E. amylovora TS3128 as a positive control; N, sterilized distilled water as a negative control.
특유의 향과 영양소를 함유한 풀명자나무(C. japonica)는 북유럽지역에서 과수로 재배하고 있으며, 가공 중에 쉽게 산화되지 않아 착즙 제품으로 소비되고 있다(Rumpunen, 2002). 세르비아의 화상병이 발병한 과수원 인근에 위치한 풀명자나무에서 E. amylovora가 검출된 바 있으며(Balaž 등, 2013; Balaž와 Smiljanić, 2004), 이는 꿀벌 등의 화분매개충에 의한 감염으로 생각된다(Kaufmane와 Rumpunen, 2002). 풀명자나무는 E. amylovora를 인공 접종 시 꽃에서 강한 마름 병징이 나타내고, 가지에서는 중간 정도의 마름 병징을 보인다는 연구 결과와 함께(Zeller, 1979), 화상병에 대해 중간 정도 저항성을 지닌다는 결과 또한 보고되어 있다(Van Der Zwet와 Beer, 1999). 본 실험에서는 E. amylovora를 접종한 풀명자나무의 모든 조직에서 병징으로 의심되는 어떠한 증상도 관찰되지 않았다(Table 2, Fig. 3). 그러나, PCR 검사 결과 모든 조직에서 E. amylovora가 검출되었다(Table 3, Fig. 4). 이는 국내에 자생하는 풀명자나무가 무증상 상태로 E. amylovora를 지니고 있을 가능성을 시사한다. 최근 국내에서는 명자나무와 풀명자나무와 같은 명자나무속의 모과나무에서 화상병 발생이 보고된 사례가 있으며(Myung 등, 2016b), 이로 미루어 보아 국내에서 자생하고 있는 명자나무속 식물의 화상병 감수성에 대한 연구를 지속할 필요가 있다.
개야광나무속(Cotoneaster) 식물은 아시아, 유럽, 북아프리카 등의 일부 온대지역에서 자생하는 식물이며, 몇몇 지역에서는 화상병에 대한 감수성으로 인해 관목으로 이용이 제한되어 있다(Slabaugh와 Shaw, 2008). 이 중 개야광나무(C. integerrimus)는 화상병에 대해 중도 저항성을 가진다고 보고되어 있다(Cabrefiga Olamendi, 2004). 접종 10일 후 개야광나무의 가지와 잎을 확인한 결과, 10mM MgCl2와 E. amylovora를 접종한 대조군과 실험군 모두에서 갈색으로 변색된 모습이 관찰되었다(Table 2, Fig. 3). 하지만 실험군은 변색이 접종 부위에 국한되지 않고 잎 전체와 잎자루에서도 확인되었으며, 이는 실험군에서 보인 변색이 E. amylovara에 의한 병징임을 시사한다. 다른 접종 부위인 꽃과 과실에서는 화상병 유사 증상을 확인할 수 없었다. 그러나, PCR을 이용한 검출 결과 모든 식물 부위에서 E. amylovora가 검출되었다(Table 3, Fig. 4).
산사나무속(Crataegus속) 식물은 사과 및 배와 함께 대표적인 E. amylovora의 기주식물로 알려져 있다. 화상병이 발생한 사과 및 배 과수원 근처에 위치한 산사나무는 꽃을 통해 침입한 E. amylovora에 의해 병이 나타난다고 알려져 있다(Phillips 와 Burdekin, 1992). 산사나무속 중 현재까지 9종이 화상병에 대해 높은 감수성을 지닌다고 보고되었으며(Van der Zwet 등, 2012). 산사나무에 E. amylovora를 접종하였을 때 모든 부위에서 병징이 확인되었다(Table 2, Fig. 3). E. amylovora가 접종된 꽃은 접종 부위로부터 꽃자루를 따라 검게 변색된 모습을 확인할 수 있었으며, 접종 2일차에 균액 누출이 확인되었다. 그리고 잎과 가지에 접종하였을 때는 잎의 주맥을 따라 암갈색으로 변색되었고, 그 주위로 황색으로 변색이 진전되는 현상을 확인하였다. 또한, 과실에 접종했을 경우 접종 2일차에 균액 누출을 관찰할 수 있었으며, 시간이 지날수록 접종 부위를 중심으로 변색이 진행되었다. 병징이 발생한 부위에 대한 PCR 결과는 가지를 제외한 꽃, 잎, 그리고 과실에서 E. amylovora 가 존재함을 보여주었다(Table 3). 이는 잎을 통해 감염된 E. amylovora가 가지까지 이동하지 않았음을 의미한다. 따라서, 기존에 보고된 결과와 본 실험 결과를 종합해 보았을 때, 국내에 자생하는 C. pinnatifida는 화상병에 대한 높은 감수성을 지니고 있음을 확인하였다.
산사나무속의 미국산사는 꽃에서 꽃잎과 꽃자루를 따라 변색이 진행되는 현상을 확인할 수 있었다(Table 2, Fig. 3). 그러나, 산사나무와는 달리 잎, 가지, 그리고 과실에서는 어떠한 변색 또는 병징을 확인할 수 없었다. 그러나, PCR 결과는 병징 관찰 결과와 정반대로 나타났다. E. amylovora는 무증상을 보인 잎, 가지, 그리고 과실에서는 검출되었으나, 병징을 보였던 꽃에서는 확인되지 않았다(Table 3). 현재까지 국내외 모두 미국산사의 화상병 관련 연구는 미비한 실정이다. 하지만 화상병에 대한 높은 감수성을 지닌 산사나무속 식물인 미국산사 역시 E. amylovora의 기주식물로 분류될 가능성은 높다고 생각되며, 이를 위한 후속 연구가 필요하다.
사과나무속(Malus 속) 야생 장미과 식물 검정 결과
국내에서 자생하는 사과나무속의 야광나무(M. baccata)의 잎과 가지에 E. amylovora를 접종하였을 때, 접종 부위를 기점으로 하여 잎자루까지 암갈색으로 변색이 진행되었다(Table 2, Fig. 5). 꽃과 과실의 경우 대조군과 실험군 사이에서 유의미한 외견 상의 변화는 확인할 수 없었다. 하지만 PCR 검사를 통해 병징 유무와 관계없이 모든 부위에서 E. amylovora가 검출되었다(Table 3). 기존 연구에 따르면 야광나무 품종인 M. baccata var. gracilis와 M. baccata var. mandshurica는 화상병에 저항성을 가지고 있는 것으로 보고되었다(Lambe, 1980). 또한 화상병 병징 중 줄기 마름 증상에 대해 재배하고 있는 사과나무(M. domestica) 대비 중도 저항성 이상의 저항성을 나타냄이 보고되었으며, 또한 화상병에 대해 전반적으로 높은 저항성을 지니고 있음이 확인되었다(Dougherty 등, 2021; Khan 과 Chao, 2017). 또한, 야광나무는 유전체 분석을 통해 화상병 저항성 quantitative trait loci를 보유하고 있음이 보고되었다(Dougherty 등, 2021). 따라서, 접종 실험을 통해 화상병 유사 병징이 관찰되지 않은 결과에 대해 추론해 볼 수 있다. 이에 더해, 병징의 유무와 관계없이 내부에서 균이 검출된 것을 통해 야광나무에서 E. amylovora가 일정 기간동안 머무를 수 있다는 가능성을 제시하였다.
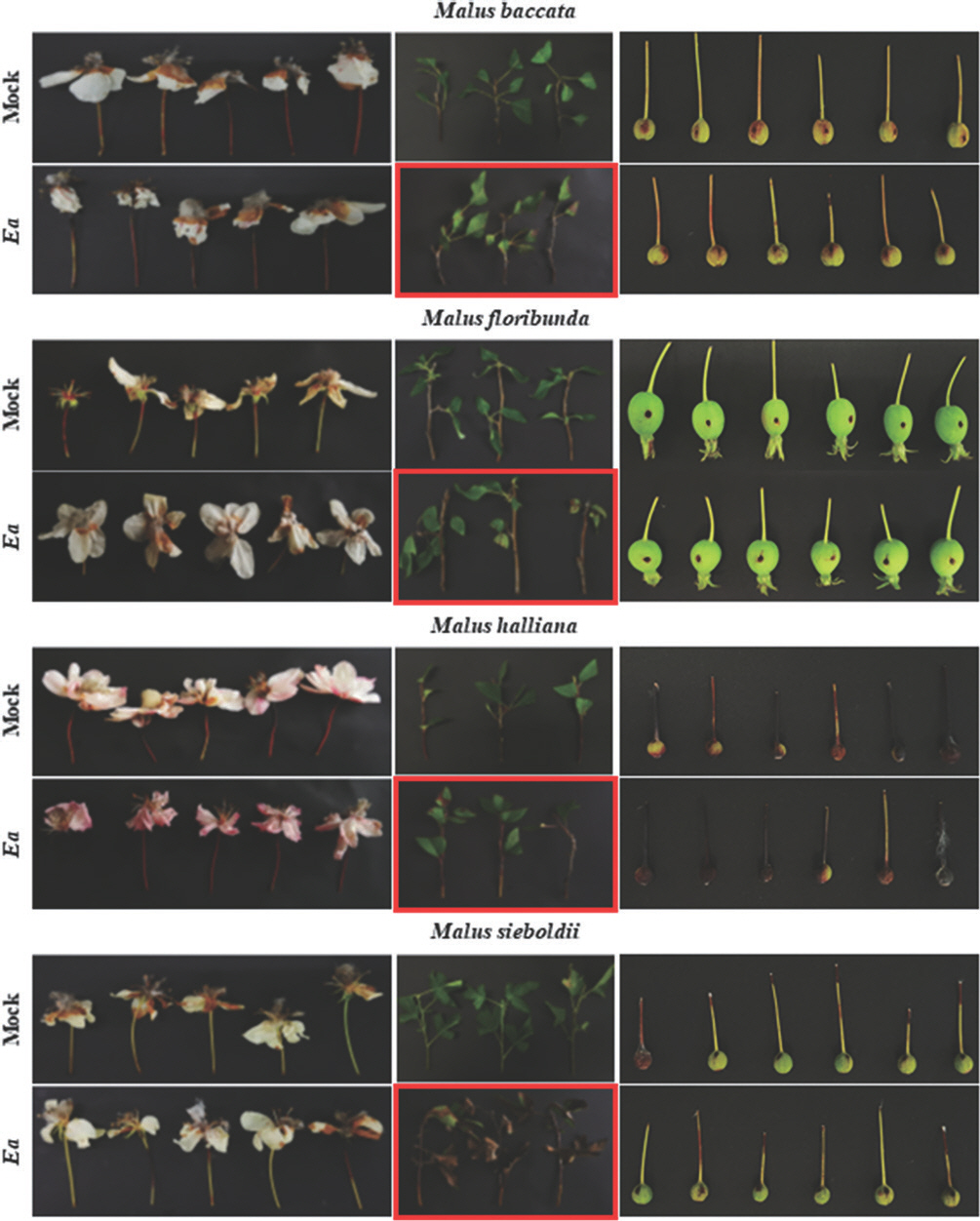
Screening of the fire blight susceptibility in the genus Malus. All plant samples were inoculated with 108 cfu/ml of Erwinia amylovora (Ea) TS3128. Leaves and twigs displayed clear disease symptoms than other plant parts. The samples showing suspicious disease symptoms were remarked by the red boxes. The samples were photographed 10 to 11 days after inoculation.
꽃사과나무(M. floribunda), 서부해당화(M. halliana), 아그배나무(M. sieboldii) 또한 야광나무와 마찬가지로 잎에 접종 시 변색된 부위가 주맥을 따라 잎자루까지 진행되는 모습을 보였으나, 꽃과 과실에서는 병징으로 의심되는 현상은 나타나지 않았다(Table 2, Fig. 5). 꽃사과나무는 잎과 가지와 함께 병징이 나타나지 않았던 꽃에서도 E. amylovora가 검출되었으나, 과실에서는 확인할 수 없었다(Table 3, Fig. 4). 꽃사과나무에서 화상병은 산발적으로 발생한다고 알려져 있다(Bastas 와 Ozturk, 2013). 그러나, 기존 연구에서 꽃사과나무는 화상병에 대한 저항성을 지니고 있음을 확인하였으며, 이를 기반으로 M. floribunda 821이 보유한 저항성 유전자를 이용하여 개량한 품종들은 저항성이 향상될 수 있음을 밝혔다(Peil 등, 2021). 또한, 야광나무와 꽃사과나무를 교배하여 얻은 M. × robusta 5 (Mr5)는 화상병 저항성 유전자 FB_MR5을 보유하고 있으며, 관련 연구에 이용되고 있다(Broggini 등, 2014). 서부해당화와 아그배나무는 병징을 보였던 잎과 가지와 더불어 무증상이었던 꽃과 과실 모두에서 E. amylovora가 검출되었다(Table 3, Fig. 4). 하지만, 기존 연구에 따르면 서부해당화는 화상병에 대한 저항성을 지니고 있으며, 특히 줄기 마름 증상에 대해 높은 저항성을 지닌다고 알려져 있다(Dougherty 등, 2021; Khan과 Chao, 2017; Kostick 등, 2021). 아그배나무 또한 화상병에 대해 높은 저항성을 보이며(Olien, 1987), 이러한 특징으로 인해 대목으로 사용된다고 알려져 있다(Schmidt, 1988). 하지만, 꽃사과나무, 서부해당화, 아그배나무 모두 화상병 저항성을 지녔음에도 병징과 균이 확인되었으므로, 해당 식물로부터의 화상병 전파 가능성은 배제할 수 없다. 본 실험을 통해 국내 자생 사과나무속 식물의 경우 꽃과 과실보다 잎과 가지에서 화상병 유사 병징이 주로 발생함을 확인하였다.
배나무속(Pyrus속) 야생 장미과 식물 검정 결과
배나무속의 야생 장미과 식물 중 과실이 작아 관상용으로도 쓰이는 콩배나무(P. calleryana var. fauriei)는 배나무의 수형을 향상시킬 수 있는 다른 대목이 존재함에도 불구하고, 화상병에 대한 높은 저항성을 지녀 미국에서 대목으로 많이 이용되고 있다(Bell 과 Itai, 2011; Culley와 Hardiman, 2007; Waterworth와 Clayton, 1982). 실험에 이용한 콩배나무가 화상병에 대한 감수성을 보이는지 확인하기 위해 접종을 실시한 결과, 꽃은 E. amylovora 를 접종하였을 때 암술머리부터 꽃자루까지 검게 변색되었다(Table 2, Fig. 6). 꽃잎은 접종 부위를 중심으로 하여 변색되는 부위가 퍼지는 형상을 보였다. 잎과 가지에서도 E. amylovora에 의한 병징을 확인하였다. 잎은 접종부위로부터 주맥을 따라 시작된 변색부위가 점차 커지고 잎자루까지 이어지는 모습을 보이고 있으며, 가지는 대조군이 녹색을 보이는 것과 대비되는 짙은 암갈색으로 변색되었다. 과실은 다른 접종 부위와는 달리 뚜렷하게 구분되는 병징이 발생하지 않았다. PCR 검사를 통해 E. amylovora를 접종하여 병징을 보였던 잎, 가지, 그리고 꽃에서 E. amylovora가 검출되었다(Table 3, Fig. 4). 하지만, 병징을 나타내지 않은 과실 내부에서는 E. amylovora를 확인할 수 없었다. 따라서, 콩배나무는 과실을 제외한 부위에서 E. amylovora 감염이 이루어질 수 있다고 추정된다.
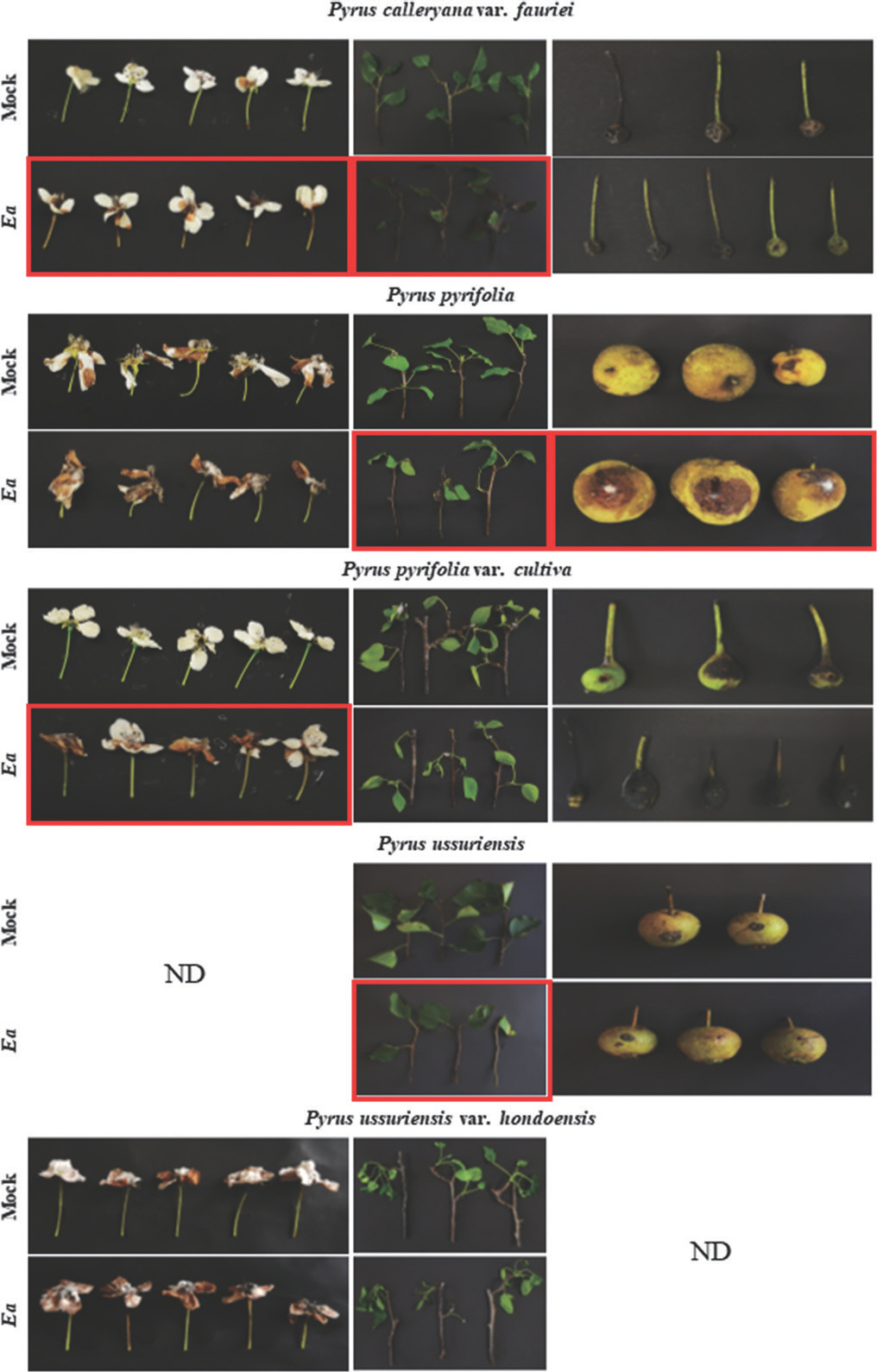
Screening of the fire blight susceptibility in the genus Pyrus. All plant samples were inoculated with 108 cfu/ml of Erwinia amylovora (Ea) TS3128. Flowers of Pyrus ussuriensis and fruits of Pyrus ussuriensis var. hondoensis were not tested. The samples showing suspicious disease symptoms were remarked by the red boxes. The photos were taken 10 to 11 days after inoculation. ND, not determined.
돌배나무(P. pyrifolia)는 E. amylovora 접종 시 잎과 가지, 그리고 과실에서 병징이 확인되었다. 잎은 주맥을 따라 검은색으로 타들어 가는 형상을 보였으며, 과실은 접종부위 주변으로 갈색의 병반과 함께 과실 전반에 걸쳐 변색이 두드러지게 나타났다(Table 2, Fig. 6). 돌배나무 꽃은 10 mM MgCl2와 E. amylovora를 접종한 샘플 모두에서 차이를 보이지 않았다. 돌배나무 접종 시 병징을 보였던 잎, 가지, 과실과 무증상이었던 꽃을 이용하여 PCR 검사를 실시하였을 때, 과실에서는 E. amylovora가 검출되었으나 잎과 가지에서는 병원균이 검출되지 않았다(Table 3, Fig. 4). 이와 달리, 돌배나무 꽃은 병징을 보이지 않았으나 PCR 검사 결과 내부에서 병원균이 확인되었다. 돌배나무의 화상병에 대한 감수성은 종내에서도 큰 차이를 보인다고 알려져 있으며(Van der Zwet 등, 1974), 본 실험에 이용한 돌배나무의 경우 화상병에 대한 감수성이 높다고 사료된다.
E. amylovora의 주된 기주식물로 알려진 배나무(P. pyrifolia var. cultiva)는 2015년 국내에서 처음으로 화상병 발병이 확인되었다(Park 등, 2016). 본 실험에서는 배나무 꽃에 접종했을 경우에만 병징이 나타났다(Table 2, Fig. 6). 암술머리와 꽃잎이 각각 검은색과 갈색으로 변색되었으며, 꽃자루 또한 황색으로 변하는 모습을 보였다. 잎과 가지의 경우는 대조군과 큰 차이를 나타내지 않았으며, 과실은 실험군에서 검게 변색되었지만 대조군도 동일한 결과를 나타내어 병징으로 판별하기 어려웠다. 반면, PCR 검사 결과는 이와 무관하게 가지와 과실에서만 E. amylovora가 검출되었으며, 병징이 나타났던 꽃은 내부에서 균이 검출되지 않았다(Table 3).
산돌배나무(P. ussuriensis)는 중국 북부에서 주로 재배되며, 이를 기반으로 한 재배종은 150여 종이 넘는 것으로 알려져 있다(Katayama 등, 2016). 대표적인 변종으로 P. ussuriensis var. ussuriensis와 P. ussuriensis var. aromatica가 존재한다. 관상목적 또는 대목으로도 활용되고 있는 산돌배나무는 E. amylovora를 인위적으로 접종하였을 시 높은 화상병 저항성을 보이며(Bell과 Itai, 2011), 그 중에서도 높은 화상병 저항성을 보인 P. ussuriensis 18, P. ussuriensis var. ovoidea 8과 같은 산돌배나무 변종을 유전자원으로 하여 화상병 감수성이 높은 재배종과 교배하였을 때, 화상병 저항성을 후대로 전달할 수 있음이 보고되었다(Bokszczanin 등, 2012). 본 실험에 이용된 산돌배나무는 개화기가 지난 시기에 채집되어 꽃에 대한 감수성 검정은 진행하지 않았다. 꽃을 제외한 잎과 가지, 과실을 이용하여 감수성 검정을 실시한 결과 잎에서 주맥을 따라 발생한 병징이 관찰되었으나, 과실에서는 어떠한 병징도 확인할 수 없었다(Table 2, Fig. 6). 하지만, 잎에서 병징이 나타났음에도 불구하고 PCR 결과상으로는 E. amylovora가 검출되지 않았다(Table 3). 반면, 무증상을 보인 과실에서는 E. amylovora가 검출되었다. 산돌배나무 변종(P. ussuriensis var. hondoensis)에 E. amylovora를 인공 접종하였을 때, 어떠한 부위에서도 화상병 유사 증상이 나타나지 않았다(Table 2, Fig. 6). 또한 PCR 검사를 통하여 모든 식물 부위에서 E. amylovora가 검출되지 않음을 확인하였다(Table 3). 따라서, 병징 관찰과 PCR 분석 결과가 일치하였다. 기존 산돌배나무와는 달리 결실기가 아닌 개화기에 채집하여 과실에 대한 감수성 검정은 진행하지 못하였다. 기존 연구는 산돌배나무와 산돌배나무 변종 모두에서 화상병에 대한 저항성이 높다고 알려져 있으며, 본 실험 결과도 기존에 보고된 결과와 일치하는 모습을 보였다.
벚나무속(Prunus속) 야생 장미과 식물 검정 결과
총 4종의 Prunus속 야생 장미과 식물에 대한 화상병 감수성 검정을 실시하였다. 이들 4종의 식물은 개화기가 아닌 결실기에 채집하였기에, 꽃에 대한 감수성 검정은 수행되지 않았다. 우선 실험에 이용한 벚나무 종은 P. jamasakura로서 P. serrulata로 묶어 분류되기도 한다(Chang 등, 2007). 현재까지 P. jamasakura 에서는 화상병이 확인되지 않았으나 P. serrulata에서 화상병 발병사례가 보고된 바 있다(Horst, 2001). 본 실험에서는 벚나무의 잎과 가지에서 주맥을 따라 진행된 병징을 관찰할 수 있었다(Table 2, Fig. 7). 이 병징은 다른 야생 장미과 식물의 잎에서 나타난 병징보다 밝은 색으로 변색된 점에서 대비된다. 과실은 접종 후 대조군과 실험군 모두 부패와 오염이 심하여 육안상으로 차이를 확인할 수 없었다. 병징을 보였던 잎과 가지는 모두 내부에서 E. amylovora가 검출되었으며, 과실에서는 병원균이 발견되지 않았다(Table 3, Fig. 4). 이러한 결과는 P. jamasakura가 E. amylovora의 기주식물이 될 수 있으며 화상병이 발생할 수 있음을 보여준다.

Screening of the fire blight susceptibility in the genus Prunus. All twigs and fruits were inoculated with 108 cfu/ml of Erwinia amylovora (Ea) TS3128. The samples, showing suspicious disease symptoms, were remarked by the red boxes. The photos were taken 10 to 11 days after inoculation.
복사나무(P. persica)도 벚나무와 마찬가지로 잎과 가지에 접종하였을 때 다른 장미과 식물보다 밝은 색의 변색이 주맥을 따라 나타나는 병징을 보였다(Table 2, Fig. 7). 특히, 과실에서 접종부위를 중심으로 갈색의 병반이 발생하였으며, 균액 누출로 보이는 현상이 관찰되었다. 일반적으로 균액 누출이 액체상태인 반면, 복사나무 과실에서 확인된 균액 누출은 결정 형태였으며, 적은 충격에도 쉽게 과실 표면에서 탈락하였다. 이는 시간이 경과함에 따라 건조한 환경에 노출되어 발생한 결과라고 추정된다. 변색 등의 뚜렷한 병징을 보였던 잎은 그 표현형과 달리 내부에서 E. amylovora가 검출되지 않았다(Table 3, Fig. 4). 하지만 잎이 아닌 가지에서 E. amylovora가 검출되었으며, 이는 잎을 통한 전이가 이루어졌기 때문이라고 추정된다. 과실의 경우 누출된 균액과 본체 모두에서 E. amylovora가 확인되었다. 복사나무는 E. amylovora의 비기주식물로 알려져 왔으나 인위적인 접종을 통해 병징이 나타날 수 있음이 확인되었으며(Palacio-Bielsa 등, 2012), 특히 복사나무의 암술머리에서 E. amylovora가 빠른 속도로 증식할 수 있음이 밝혀졌다(Weißhaupt 등, 2016). 이는 일반적으로 알려진 사과와 배에서 E. amylovora가 보이는 특징과 일치한다(Malnoy 등, 2012). 또한, 복사나무는 사과나무와의 전사체 비교분석을 통한 E. amylovora와 기주식물 사이의 상호작용에 대한 연구에 활용되고 있다(Kamber 등, 2016). 따라서 복사나무 또한 E. amylovora의 기주식물 및 중간매개자 역할을 할 수 있기 때문에 화상병이 발생한 사과 및 배 과수원 근처의 복사나무에 대한 역학 조사가 필요하다고 생각된다.
개살구나무(P. mandshurica)는 품종개량에 사용할 냉해 저항성(frost resistance)관련 유전자원으로 활용되고 있다(Hormaza 등, 2007). 현재까지 개살구나무에서 화상병이 발생했다는 보고가 없었으며, 관련 연구가 이루어지지 않고 있다. 접종 실험 결과, 잎과 가지에서 대조군과 실험군 사이의 유의미한 차이는 확인되지 않았으며, 과실 또한 마찬가지로 뚜렷한 병징이 확인되지 않았다(Table 2, Fig. 7). 비록, E. amylovora를 접종한 과실이 전반적으로 암갈색으로 변색이 이루어졌으나, 대조군도 동일한 결과를 보이는 과실이 있었기에 병징이라고 결론지을 수 없었다. 개살구나무는 병징 관찰 결과와 동일하게 모든 부위에서 E. amylovora가 검출되지 않았다(Table 3). 따라서, 개살구나무는 E. amylovora의 기주식물이 아니라고 판단하였다. 그러나, 2020년에 국내에서 처음으로 살구나무에서 화상병이 발생하였기에(Lee 등, 2021), 개살구나무에 대한 추가적인 조사가 진행되어야 할 것으로 생각된다.
귀룽나무(P. padus) 또한 개살구나무와 마찬가지로 모든 접종 부위에서 화상병 의심증상이 발현되지 않았다(Table 2, Fig. 7). 더욱이 과실의 경우, 조직이 무르고 수분이 많아 접종 후 보관기간 동안 부패와 오염이 상당히 진행되어 육안상으로 식별이 불가능하였다. 마찬가지로, E. amylovora를 접종한 귀룽나무의 모든 부위에서 PCR을 통한 E. amylovora는 확인되지 않았다(Table 3). 귀룽나무는 일부 세균, 곰팡이 및 바이러스에 의한 식물병이 발생한다고 알려져 있으나, 아직까지 E. amylovora 감염에 의한 화상병은 보고되지 않았다(Leather, 1996). 본 연구를 통해, 귀룽나무에 E. amylovora 접종 시 어떠한 병징도 나타나지 않으며, 내부에 균이 존재할 수 없다는 사실을 처음으로 확인하였다.
피라칸다속(Pyracantha), 장미속(Rosa) 및 산딸기속(Rubus) 야생 장미과 식물 검정 결과
피라칸다속의 피라칸다(P. angustifolia), 장미속의 찔레나무(R. multiflora), 산딸기속의 산딸기(R. crataegifolius)에 대한 화상병 감수성 검정을 실시하였다. 찔레나무와 산딸기는 개화기를 지나 표본을 채집하였기에 꽃에 대한 감수성 검정은 진행하지 않았다. 우선, 피라칸다속 식물은 화상병에 매우 높은 감수성을 보인다고 알려져 있다(Van der Zwet 등, 2012). 이 중 피라칸다는 E. amylovora의 기주식물이 될 수 있으며, 꽃이 시들고 검게 변색되며 어린 가지가 말단부터 죽어가는 화상병의 전형적인 병징이 나타난다고 보고되었다(Chari 등, 2020). 본 연구에서 피라칸다는 접종을 통해 잎과 가지에서 병징을 확인하였다. 잎은 황색으로 변색이 진행되었으며, 변색된 부위는 접종 부위와 잎자루 부근부터 잎 중앙으로 진전되는 모습을 보였다(Table 2, Fig. 8). 꽃은 대조군과 비교 시 명확한 병징이 드러나지 않았으며, 과실에서 가지와 연결된 부위가 검게 변색된 모습을 확인하였으나, 극히 일부의 과실에서 나타난 증상이기 때문에 화상병 관련 증상이라고 판단할 수 없었다. 하지만 PCR 분석 결과, 병징 유무와 관계없이 E. amylovora를 접종한 모든 부위에서 균이 검출되었다(Table 3). 이와 같은 결과는 기존의 연구에서 얻은 결과와 부합하였다. 따라서 피라칸다는 E. amylovora의 기주식물이며 화상병이 발생할 수 있음이 다시 한번 확인되었다.
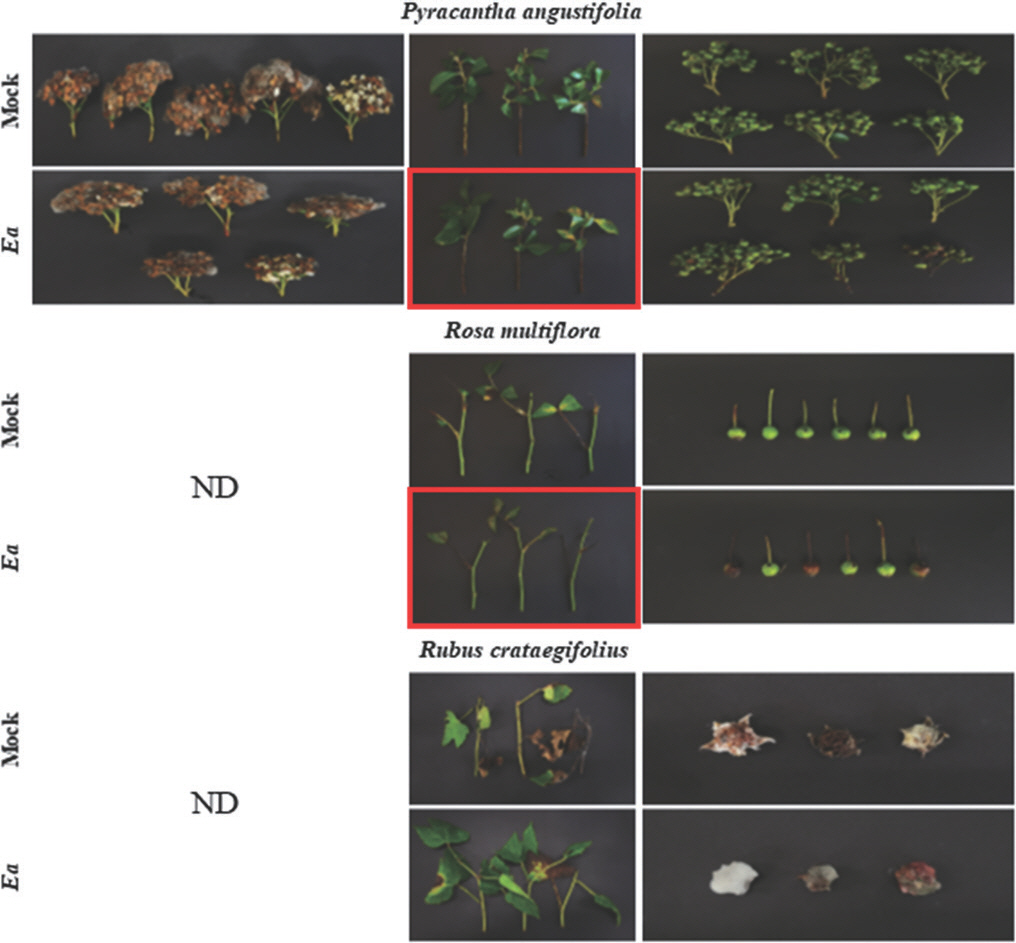
Screening of the fire blight susceptibility in the genera Pyracantha, Rosa, and Rubus. All plant samples were inoculated with 108 cfu/ml of Erwinia amylovora (Ea) TS3128. Flowers of the genera Rosa and Rubus were not examined in this experiment. The samples showing suspicious disease symptoms were remarked by the red boxes. The samples were photographed 10 to 11 days after inoculation. ND, not determined.
장미 재배 시 대목으로 이용되며, 화단의 울타리로 활용되는 찔레나무는(Culley와 Hardiman, 2007), E. amylovora를 인공 접종할 시 화상병이 약하게 발생하며(Hindal과 Wong, 1988), E. amylovora는 암술머리에서 화상병 감수성 사과 품종 이상으로 증식할 수 있음이 밝혀졌다(Weißhaupt 등, 2016). 이를 바탕으로 E. amylovora를 접종한 결과, 잎과 가지에서 화상병 유사 병징을 보였다. 잎의 주맥은 검게 변화하였으며, 가지와 연결된 잎자루까지 진전되었다(Table 2, Fig. 8). 찔레나무 과실은 접종 10일 경과 후 전체적으로 접종 부위를 중심으로 암갈색으로 변색이 진행되었다. 이와 달리 대조군은 어떠한 변색이나 병징이 나타나지 않았으나, 반복 실험을 통해 실험군과 유사한 현상이 나타남을 확인하였다. 따라서, 이러한 변색 증상이 E. amylovora 접종에 의해 발생되었는지는 추가적인 확인이 필요하다. 그러나, 뚜렷한 병징을 나타냈던 잎과 가지를 이용한 PCR 분석을 실시하였을 때 E. amylovora는 검출되지 않았으며, 병징으로 판단하기 어려운 표현형을 보인 과실에서 균이 검출되었다(Table 3).
산딸기는 E. amylovora를 접종한 잎과 가지에서 화상병 유사증상이 나타났으나, 대조군에서도 마찬가지의 증상이 나타나 추가적인 실험이 필요하다(Table 2, Fig. 8). 산딸기 과실은 경도가 낮고 매우 무른 상태였기에, 접종 후 대조군과 실험군 모두에서 부패와 오염이 심하게 진행되어 병징 확인이 불가하였다. 산딸기는 병징 유사 증상을 보인 잎과 가지, 그리고 구분이 어려웠던 과실 모두에서 E. amylovora는 검출되지 않았다(Table 3). 산딸기속 식물 중 raspberry와 blackberry에서 일반적이지는 않으나 화상병이 발생한다고 보고된 바 있으며, 화상병 발병 시 사과와 배에서 볼 수 있는 전형적인 병징이 나타난다고 알려져 있다(Dolan 등, 2018). 산딸기는 Phytophthora rubi에 의해 발생하는 뿌리 썩음병, Botrytis cinerea에 의한 과실 썩음병, Sphaerulina rubi에 의한 raspberry leaf spot 등에 저항성을 지닌 유전자원으로 활용되고 있으나, 화상병에 대한 저항성은 보고된 바 없다(Finn과 Clark, 2012). 본 연구는 산딸기에서 화상병이 발생하지 않으며, E. amylovora가 내부에서 증식할 수 없음을 확인하였다. 하지만 Rubus속에서 화상병이 발병된 사례가 있기 때문에 추가적인 연구가 필요하다고 생각된다.
마가목속(Sorbus) 야생 장미과 식물 검정 결과
마가목속의 팥배나무(S. alnifolia)와 마가목(S. commixta), 우산마가목(S. ullengensis)에 대한 화상병 감수성 검정을 실시하였다. 마가목과 우산마가목 꽃에 대한 감수성 검정은 개화기를 지나 표본을 채집하였기에 수행하지 않았다. 우선, 팥배나무는 E. amylovora를 접종한 일부 꽃의 암술머리, 꽃잎, 그리고 꽃자루에서 변색을 확인하였으나, 이러한 증상은 대조군에서도 마찬가지로 발견되었기에 병징이라고 판단하지 않았다. 잎과 가지에서도 대조군과 실험군 모두 접종을 위한 절단면을 따라 검게 변색된 점을 제외하면 어떠한 병징도 나타나지 않았다(Table 2, Fig. 9). 과실 또한 마찬가지로 E. amylovora를 접종한 일부 과실에서 약간의 황변이 발생하였으나, 두 개체군 모두에서 대비되는 증상을 발견할 수 없었다. 그럼에도 불구하고, PCR 검사를 통해 접종한 모든 부위 내부에 E. amylovora 가 존재함을 확인하였다(Table 3). 팥배나무는 E. amylovora 의 기주식물이며, 화상병에 대해 중간 정도의 저항성을 지녔다고 보고되어 있으며, 다른 기주식물로 E. amylovora를 전파할 수 있는 위험성을 지닌다는 연구결과가 있다(Koller, 1978; Van der Zwet, 1995; Van Der Zwet과 Beer, 1999). 따라서, E. amylovora에 감염되었지만 무증상을 나타내는 팥배나무는 화상병 확산에 있어 여전히 위험성을 지닌다고 생각되며, 이를 고려한 방역 작업이 필요할 것으로 보인다.

Screening of the fire blight susceptibility in the genera Sorbus. All plant samples were inoculated with 108 cfu/ml of Erwinia amylovora (Ea) TS3128. Flowers of the genera S. commixta and S. ulleungensis were not examined in this experiment. The samples showing suspicious disease symptoms were remarked by the red boxes. The samples were photographed 7 to 11 days after inoculation (dai). ND, not determined.
팥배나무를 포함한 마가목속의 몇몇 종은 화상병에 감수성으로 알려져 있으나 현재까지 마가목과 우산마가목의 과수 화상병에 대한 감수성과 그 병징에 대한 연구는 미흡한 실정이다(Van Der Zwet과 Beer, 1999). 마가목에 E. amylovora 를 인공 접종 한 결과 잎과 가지에서 대조군과 대비되는 증상을 보였다. 특히, 잎은 E. amylovora를 접종한 개체에서 주맥을 따라 잎 전반에 걸쳐 검게 변색되는 모습을 보여주었으며, 벚나무속 식물의 잎에서 나타난 병징과 같이 연한 황색으로 변색되는 현상도 나타났다(Table 2, Fig. 9). 대조군에서도 검게 변색되는 현상이 발견되었지만 그 범위가 국한되어 있어, E. amylovora를 접종한 개체에서 나타난 증상을 병징으로 판단하였다. 과실의 경우 E. amylovora를 접종한 과실에서 화상병과 유사하게 과실 전반에 걸쳐 변색이 진행되었다. PCR 검사 결과 또한 병징 관찰 결과와 마찬가지로 E. amylovora를 접종한 모든 부위에서 균이 검출되어, 두 실험 결과가 일치하는 모습을 보여주었다(Table 3). 우산마가목은 비교적 최근에 울릉도에서 자생하고 있음이 확인된 마가목속 식물이다(Chang 과 Gil, 2014; Gil과 Kim, 2018). 마가목과 마찬가지로 잎에 E. amylovora 인공 접종 시 접종부위와 주맥을 따라 갈색으로 변색되었으며, 과실 역시 전체적으로 색이 변하였다(Table 2, Fig. 9). 변색이 발생한 조직을 이용한 PCR 검사를 실시한 결과, 해당 조직에서 E. amylovora가 검출되었다(Table 3). 따라서 본 실험 결과를 통해 마가목과 우산마가목은 E. amylovora의 기주식물로 정의할 수 있으며, 과수 화상병이 발생할 수 있음을 확인하였다.
이상의 결과들을 종합하면, E. amylovora 접종 실험을 통해 대조군으로 이용한 사과 ‛부사’를 제외하고, 적어도 한개 조직 이상 화상병 유사 병징을 보인 야생 장미과 식물은 18종이었으며, 모든 조직에서 병징을 보이지 않은 식물은 6종이었다. 본 실험을 통해 얻은 야생 장미과 식물들에 대한 화상병 감수성 검정 결과는 접종 조직별 병징 발현 여부를 표로 정리하였다(Table 2). 또한, E. amylovora 접종 부위에 대한 PCR 검사 결과를 통해 대부분의 야생 장미과 식물에서 병징 유무와 관계없이 E. amylovora가 검출됨을 확인하였다. E. amylovora를 접종한 조직 중 적어도 한가지 조직 이상 균이 검출된 야생 장미과 식물은 20종이었으며, 모든 조직에서 균이 검출되지 않은 식물은 4종이었다. PCR 검사를 실시하여 접종 부위별 E. amylovora 검출 여부는 Table 3에 정리하였다.
본 연구를 통해 병징 발현과 E. amylovora 검출 결과가 일치하는 야생 장미과 식물은 명자나무, 개야광나무, 산사나무, 야광나무, 꽃사과나무, 서부해당화, 아그배나무, 벚나무, 복사나무, 피라칸다, 콩배나무, 돌배나무, 마가목, 그리고 우산마가목 등 14종으로 확인되었다. 이와 같은 결과를 바탕으로 E. amylovora에 의한 국내 화상병의 토착화 및 전파를 방지하는 향후 정책 방향을 결정함에 있어 기여할 수 있을 것이라 생각된다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This research was supported by the National Institute of Biological Resources, Ministry of Environment of Republic of Korea (NIBR202112101, NIBR202213101) and Bio & Medical Technology Development Program of the National Research Foundation (NRF) (No. 2021M3A9I5021437).