장수풍뎅이 유충의 장내 미생물을 이용한 다양한 식물 균류병의 생물적 방제 및 생장촉진
Plant Growth Promotion and Biocontrol Potential of Various Phytopathogenic Fungi Using Gut Microbes of Allomyrina dichotoma Larva
Article information
Abstract
This research was executed to select beneficial antagonists from digestive organ of Allomyrina dichotoma larva that can be put on environment friendly control against phytopathogenic fungi. We screened 38 bacterial strains inhibiting mycelial growth against eight plant pathogens through dual culture assay. The 10 strains among 38 bacterial strains were selected as beneficial microbes showing antifungal activity against Botrytis cinerea, Plasmodiophora brassicae, Colletotrichum acutatum and Phytophthora capsici through under greenhouse pot trials. The 10 bacterial strains that shown strongest antifungal activity were classified into 3 genera and 10 species, and identified as the genus Bacillus (DM146, DM152, DH2, and DH16), Paenibacillus (DF30, DH14, and DM142) and Streptomyces (DF137, DM48, and DH92) by morphological characteristics and 16s rRNA gene sequence. The 10 bacterial strains had solubilizing activity of insoluble phosphates, production of IAA (indole-3-acetic acid), β-1,3-glucanase and protease. Among the 10 bacterial strains, DM152 strain was produced significant enhancement of all growth parameters of chili pepper and tomato seedlings under greenhouse condition. Thus, this study demonstrated that gut microbes of Allomyrina dichotoma larva will be useful as a potential biocontrol agent against plant pathogens and biofertilizer.
서 론
곤충은 유기물을 직접 분해하거나 흡수하는 소화기관이 발달되어 있지 않아 장내 미생물의 도움을 받으며, 이는 장내에서 빠른 진화와 함께 극한 서식 환경에서의 적응을 가능하게 한다. 이러한 곤충의 장내에는 다양한 미생물이 서식하고 있으며, 곤충과 장내 미생물 사이에 유익한 상호작용을 통해 공생관계를 유지하는 것으로 알려져 있다(Rajagopal, 2009). 이렇듯 곤충 장내에 존재하는 공생자에 대한 잠재적인 역할에 관한 연구가 활발히 이루어지고 있다(Genta 등, 2006). 최근 연구에서 Shao 등(2017)은 담배거세미나방의 공생자인 장내구균은 외부로부터 유입되는 유해균을 억제하는 항균물질을 분비한다고 보고하였다. 곤충 장내 미생물이 ligninase, cellulase, lipase, chitinase 등의 고효율의 효소를 생성한다는 많은 보고가 있으며, 이는 산업적 활용 가능성을 나타내었다(Kato 등, 1998; Park 등, 2007; Watanabe 등, 1998). 이처럼 장내 미생물은 고효율의 효소를 생산하고 대사과정에 관여할 뿐만 아니라 면역체계에도 관여하며, 생장과 발육에 필수적인 아미노산이나 비타민 등을 합성하는 것으로 밝혀졌다(Moon 등, 2011).
곤충병원세균 Bacillus thuringiensis, Photorhabdus spp., Xenorhabdus spp.는 나비 목, 파리 목, 딱정벌레 목, 선충 등에 사용되는 생물농약으로 우수한 살충활성으로 농업환경에 이용되고 있다(Lacey와 Georgis, 2012; Sanahuja 등, 2011). 최근 연구에서 Ruffner 등(2013)과 Kupferschmied 등(2013)은 Pseudomonas spp.의 우수한 살충활성을 보고하였다. Pseudomonas spp.는 식물 근권에 정착하여 다양한 식물 병원균을 억제하며 작물의 생육을 촉진시켜서 생물학적 방제의 우수성에 관한 많은 보고가 있다(De Weger 등, 1986; Kumar 등, 2005).
상업적으로 이용되고 있는 식물병 관리용 미생물 제제는 주로 Bacillus spp., Paenibacillus spp., Trichoderma spp., Pseudomonas spp., Streptomyces spp. 등이 있으며, 유용 미생물의 탐색은 엽권, 근권, 토양으로부터 분리되어 이용되고 있다(Andrews, 1992; Son 등, 2014; Xu 등, 2016). 이러한 미생물은 식물의 뿌리나 잎에 정착하여 식물병원균을 억제할 뿐만 아니라 작물의 생육도 촉진시키며 기능성 물질들을 생성한다고 알려져 있다(Andrews, 1992; Xu 등 2016). 하지만 미생물의 활성이 일정하지 못하다는 단점에도 불구하고, 생물학적 방제는 농업 생태계에 토양 병해를 감소할 수 있는 대안으로 여겨진다(Whipps와 McQuilken, 2009). 따라서 최근 특정한 지역이나 극한 서식 환경에서 생물활성이 우수한 유용 미생물의 탐색이 이루어지고 있다(Dharni 등, 2012; Kavamura 등, 2013).
장수풍뎅이(Allomyrina dichotoma L.)는 딱정벌레목(Coleoptera) 풍뎅이과(Scarabaeidae)에 속하는 곤충으로 한국, 일본, 중국, 인도 등에서 분포하는 것으로 알려졌다. 장수풍뎅이 유충은 무기질, 섬유질, 미생물 등이 포함된 부엽토 및 부식토를 먹고 자라며, 작물을 가해하지 않아 비교적 토양과 친화적이다. 또한, 장수풍뎅이 유충은 민간약제로서 건강보조용 약제로 널리 이용되고 있으며, 간 질환, 성인병 치료 및 예방에 대한 효과가 보고되었다(Choi 등, 2006; Chung 등, 2013).
이러한 관점에서 고효율의 효소를 생산하는 곤충 장내미생물은 식물 균류의 외막을 가수분해할 수 있는 cellulase, protease, chitinase와 같은 효소 활성이 뛰어날 것으로 생각되며, 또한 곤충의 소화기관내에 존재하는 필수적인 아미노산이나 비타민 등을 합성하는 공생자인 장내 미생물이 식물의 생육이나 생장에도 밀접한 관계를 가지고 있을 가능성이 높다고 생각된다.
따라서 본 연구는 장수풍뎅이 유충의 소화기관으로부터 분리된 장내 미생물을 이용하여 다양한 식물 균류병에 대한 항균활성과 방제효과를 검정하였고, 식물의 생육과 병 방제에 직•간접적으로 관여하는 작용메커니즘과 식물생장촉진활성을 평가하였다.
재료 및 방법
장수풍뎅이 유충 채집 및 장내 미생물 분리
식물병원균에 대한 항균활성을 가지는 장내 미생물의 탐색에 이용된 장수풍뎅이 유충은 강원도 강릉시 인근 임산 부산물에서 채집한 3령 유충을 이용하였다. 장수풍뎅이 3령 유충을 멸균된 70% 에탄올로 1‒2분 동안 침지하여 총체 표면의 오염원을 제거한 후, 멸균수로 2회 세척하였다. 해부세트를 이용하여 장수풍뎅이 3령 유충의 몸통 부분에서 배를 절개하여 체표 부분을 제외한 장을 취하여 전장(foregut), 중장(midgut), 후장(hindgut)으로 연결된 소화기관을 무균적으로 분리하였다. 각각 분리된 소화기관의 시료를 1 g을 채취하여 멸균수 9 ml에 넣고 충분히 균질화한 후, 단계적으로 희석하여 potato dextrose agar (PDA), tryptic soy agar, starch casein agar 배지에 각각 도말하여 25°C에서 3-10일간 배양하면서 평판배지에 형성된 colony를 순수 분리하였다.
항균활성 검정
순수 분리된 장내 미생물들을 대상으로 식물병원균에 대한 항균활성을 검정하고자 8종의 식물병원균 토마토 잿빛곰팡이병(Botrytis cinerea), 토마토 시들음병(Fusarium. oxysporum f. sp. radicis-lycopersici), 벼 도열병(Magnaporthe grisea), 벼 잎집무늬마름병(Rhizoctonia solani AG-1(1A)), 고추 탄저병(Colletotrichum acutatum), 고추 역병(Phytophthora capsici), 마늘 흑색썩음균핵병(Sclerotium cepivorum), 배추 밑둥썩음병(R. solani)과 PDA 배지 상에서 대치배양(dual culture)하 여 25°C에서 10일간 배양한 후 병원균의 균사체의 생장억제 정도 (inhibition zone)를 조사하여 형성된 clear zone (mm)의 길이로 항균활성을 조사하였다. 사용된 식물병원균은 강릉원주대학교 식물병리실험실에서 분리 동정하여 사용하거나, 농업유전자원 센터에서 분양 받아 사용하였다.
길항 미생물의 생물활성 검정
대치배양을 통해 선발된 38종의 장내 미생물의 생물활성은 온실에서 토마토 잿빛곰팡이병, 배추 뿌리혹병(Plasmodiophora brassicae), 고추 탄저병, 고추 역병을 대상으로 수행하였다. 식물 재료 준비는 토마토(Superdotaerang, Koregon, Anseong, Korea), 고추(Supermanita, Nongwoobio, Suwon, Korea), 배추(Chunkwang, Sakata Korea, Seoul, Korea)의 각각의 종자를 원예용상토(Chologi, Nongwoobio)로 채워진 162 plug trays에 파종하여 3주 동안 육묘하여 사용하였고, 3주된 육묘를 포트(10 cm diameter)에 이식하여 활착시킨 육묘를 사용하였다. 길항세균 현탁액 준비를 위해 일반 세균은 tryptic soy broth에 180 rpm으로 28°C, 24시간 동안 배양하여 1.0×108‒109 cfu/ml 조정하여 사용하였고, 방선균은 starch casein broth 배지에 180 rpm으로 25°C, 7일 동안 배양한 배양액을 사용하였다. 토마토 잿빛곰팡이병 검정을 위해 B. cinerea 균주를 명조건에서 3주간 배양하여 0.5% glucose, 0.25% K2HPO4 현탁액으로 수확하여 포자 농도를 1.0×106 spore/ml로 조정하였다. 길항균 현탁액을 토마토 잎에 충분히 적시도록 분무처리하였고, 24시간 후에 포자 현탁액을 분무 접종한 후 고습도 습실상(95% relative humidity [RH], 20°C)에서 5일간 배양한 후 병 발생을 조사하였다. 발병도는 5단계(0, 발병하지 않음; 1, 0.1‒5% 정도의 병 발생; 2, 5.1‒20% 정도의 병 발생; 3, 20.1‒40% 정도의 병 발생; 4, 40.1‒100% 정도의 병 발생)로 조사하였다. 배추 뿌리혹병 검정을 위해 성숙한 뿌리혹을 채집하여 blender로 마쇄하여 현탁액을 만든 후 원예용상토(Chologi, Nongwoobio)와 섞어서 오염토를 만들었다(5 l/20 kg). 배추 뿌리혹병 오염토를 포트(10 cm diameter)에 넣고, 길항균 현탁액이 처리된 배추 유묘를 이식 후 40일간 육묘한 후 병 발생을 조사하였다. 발병도는 5단계(0, 뿌리혹 없음; 1, 1‒9% 정도의 병 발생; 2, 10‒30% 정도의 병 발생; 3, 31‒60% 정도의 병 발생; 4, 60‒100% 정도의 병 발생)로 조사하였다. 고추 역병 검정을 위해 P. capsici 균주를 oatmeal agar에 접종하여 25°C, 명조건에서 10일간 배양하였다. 배지 표면에 생성된 역병균을 4°C 차가운 멸균수를 이용하여 유주자낭을 회수하여 농도를 1.0×103 zoosporangia/ml 조정 후 유주자가 방출되도록 유도하였다. 각각의 포트에 길항균 현탁액 20 ml씩 관주처리 24시간 후에 유주포자 현탁액을 10 ml씩 관주처리하여 고습도 습실상(95% RH, 25°C)에서 24시간 동안 습실 처리하고 10일 동안 발병 시킨 후 발병도를 조사하였다. 발병도는 6단계(0, 발병하지 않음; 1, 지제부가 무르고 갈변하기 시작; 2, 30‒50% 정도의 병 발생; 3, 50‒70% 정도의 병 발생; 4, 70‒90% 정도의 병 발생; 5, 고사)로 조사하였다. 고추 탄저병 검정을 위해 C. acutatum 균주를 PDA 배지에 접종하여 25°C, 14일 동안 명조건에서 배양하여 포자 형성을 유도하였다. 배지 표면에 형성된 탄저병균을 멸균수로 회수하여 1.0×105 spore/ml이 되도록 조정하여 사용하였다. 정식 후 10주된 고추(Supermanita, Nongwoobio)에서 수확한 빨간 과실을 1% sodium hypochlorite solution (NaOCl)에 표면 살균한 후 멸균수에 2회 세척하였다. 오염원이 제거된 고추 과실을 건조 후 멸균된 바늘을 이용하여 인위적으로 상처를 낸 후 길항세균 현탁액을 20 μl씩 pipetting하였다. 길항균 현탁액 처리 24시간 후에 탄저병균 포자 현탁액 10 μl씩 pipetting한 후 고습도 습실상(95% RH, 20°C)에서 5일간 배양한 후 병반 부위를 diameter (mm) 길이를 조사하였다. 방제가 (%)는 아래 공식에 따라 산출하였다. 방제가(%)=([무처리구의 병반 diameter (mm)‒처리구의 병반 diameter (mm)]/무처리구 의 병반 diameter (mm))×100.
선발 균주의 동정
생물활성 검정을 통해 최종 선발된 10종의 장내 미생물을 동정하기 위해 주사전자현미경을 통해 형태학적 특징을 검정하였고, 16S rRNA gene 염기서열을 분석하였다. 선발된 균주의 total genomic DNA의 추출은 Nishiguchi 등(2002)의 방법을 이용하였다. 추출된 genomic DNA는 universal primer 27F (5′-AGAGTTTGATCMTGGCTCAG-3′)와 1492R (5′-TACGGYTACCTTGTTACGACTT-3′) 프라이머를 이용하여 PCR 증폭하였다. 증폭된 PCR 산물을 정제하여, Solgent Co. Ltd. (Seoul, Korea)에 의뢰하여 16S rRNA gene 염기서열을 결정하였고, 결정된 염기서열은 SeqMan (DNASTAR, Madison, WI, USA)을 이용하여 정리하였다. 16S rRNA gene 염기서열은 NCBI (National Center for Biotechnology Information) BlastN database를 통하여 상동성을 비교하였다. MEGA 6의 Cluster W를 이용하여 염기서열을 정렬하여 neighbor-joining 방법에 따라 계통도를 작성하였고, bootstrapping은 1,000회 반복하였다.
선발 균주의 IAA, 인산 가용화, siderophore 생성 활성, 가수분해 효소 검정
IAA (indole-3-acetic acid) 생성활성은 IAA의 전구물질인 L-tryptophan 0.1% 첨가한 King’s B broth 배지에 배양된 배양액과 Salkowsky reagent (35% perchloric acid 50 ml, 0.5 M ferric chloride 1 ml)를 1:2 (v/v)로 혼합하여 반응시켜 확인 후 530 nm의 파장에서 흡광도를 측정하였다. 인산 가용화(phosphate solubilizing) 활성은 Pikovskaya’s agar [glucose 10.0 g, (NH4)2SO4 0.5 g, KCl 0.2 g, MgSO4 0.1 g, MnSO4 0.002 g, FeSO4 0.002 g, yeast extract 0.5 g, Ca3(PO4)2 5 g, agar 15 g, distilled water 1 l] 배지(Zaidi 등, 2006)에서 검정하였으며, 투명환(clear zone)을 형성하는 것이 활성이 있는 것으로 간주하였다. Siderophore 생성활성은 Chrome azourol S (CAS) agar 배지(Schwyn와 Neilands, 1997)를 이용하여 검정하였다. CAS 평판배지에 5 mm의 cork borrer를 이용하여 배지 중앙에 disc를 제거한 후, 선발된 균주 배양액을 20 μl를 pipetting하여 접종하였다. 접종 후 28°C에서 14일 동안 배양하면서 orange halo zone의 형성 유무로 siderophore의 활성을 조사하였다. 식물병원균의 세포벽을 분해하는 효소 활성은 β-1,3-glucanase 활성과 protease 활성 통해 검정하였다. β-1,3-glucanase 활성은 1% carboxymethyl-cellulose를 함유한 casein-yeast extract agar (casein 5 g, yeast extract 2.5 g, glucose 1 g, agar 18 g, distilled water 1 l)배지에서 배양하여 Congo red 용액(1 mg/ml)을 이용하여 15분 동안 염색 후 1.0 M NaCl로 3번 세척하여 투명환 형성을 diameter (mm)로 활성 능력을 조사하였다. Protease 활성은 protease 활성 배지(skim milk [Sigma Aldrich Co., St. Louis, MO, USA] 10 g, nutrient broth [Becton, Dickinson and Company, Sparks, MD, USA] 2 g, agar 15 g, distilled water 1 l) 배지에 배양하여 투명환 형성을 diameter (mm)로 활성 능력을 조사하였다.
식물생장촉진활성 검정
3주 동안 키운 토마토, 고추 유묘를 포트(15×15 cm diameter)에 이식 후 길항균 현탁액을 100 ml씩 7일 간격으로 3회 관주 처리하였다. 마지막 처리 7일 후, 줄기 직경, 길이, 생체 중량, 건조 중량과 뿌리 길이, 생체 중량, 건조 중량 그리고 엽록소 함량을 측정하였다.
통계분석
항균활성과 효소활성 검정은 3반복 3회 수행하였으며, 생물활성과 생장촉진활성 검정은 처리구당 5포트씩 3반복 완전임의배치법으로 수행하였다. 실험으로 얻어진 결과는 SAS system (SAS Institute Inc., Cary, NC, USA)을 이용하여 통계분석을 하였으며, Duncan의 다중검정(Duncan’s multiple range test)를 이용하여 P≤0.05 수준에서 각 처리 간의 유의성을 검증하였다.
결과 및 고찰
장내세균 분리 및 항균활성 검정
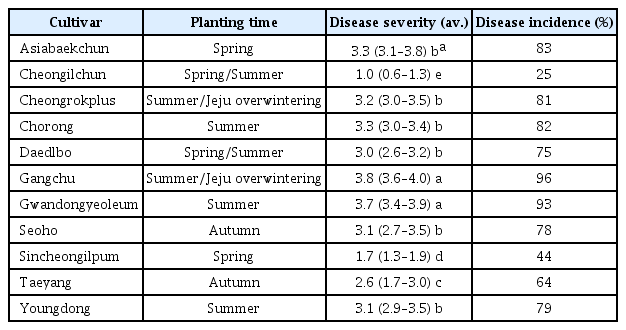
장수풍뎅이 유충의 소화기관 전장, 중장, 후장에서 총 265종의 장내 미생물을 분리하였고, 분리한 미생물을 8종의 식물병원균 토마토 잿빛곰팡이병, 토마토 시들음병, 벼 도열병, 벼 잎집무늬마름병(R. solani AG-1(1A)), 고추 탄저병, 고추 역병, 마늘 흑색썩음균핵병, 배추 밑둥썩음병에 대하여 대치배양 결과, 총 148종의 길항균을 스크리닝하였다. 전장에서 33종으로 가장 낮은 길항균의 분리비를 보였고, 중장에서 52종, 후장에서 63종으로 가장 많은 길항균의 분리비를 나타냈다. 이러한 길항균의 분리비는 곤충의 섭식구조와 소화기관에 따른 특징으로 보여진다. 또한, 8종의 식물병원균 중 F. oxysporum f. sp. radicis-lycopersici와 R. solani에 대한 활성을 지닌 길항균의 분리비는 낮게 나타났고, S. cepivorum와 M. grisea에 활성을 가진 길항균의 분리비는 높게 나타났다. 대치배양을 통해 선발된 38종의 길항균은 대부분의 식물 병원균에 대한 항균활성을 보여, 스펙트럼이 넓은 것을 확인하였다(Table 1).
길항 미생물의 생물활성 검정
대치배양을 통해 선발된 길항균을 대상으로 토마토 잿빛곰팡이병에 대한 생물활성을 검정한 결과, DF30, DF137, DM48, DH2, DH16 균주는 80.4% 이상의 높은 방제가를 보였으며, 미생물제품 EXTN-1 (B. vallismortis EXTN-1)과 화학농약 fludioxonil은 각각 35.1%, 95.8%의 방제효과를 보였다. 배추 뿌리혹병에 대한 길항균의 생물활성을 검정한 결과, DF30, DM142, DM146, DM152, DH2 균주는 83.0% 이상의 높은 방제가를 보였으며, 미생물제품 EXTN-1과 화학농약 cyazopamid는 각각 73.5%, 99.3%의 방제효과를 보였다. 고추 탄저병에 대한 길항균의 생물활성을 검정한 결과, DF30, DM142, DM146, DM152 균주는 82.3% 이상의 높은 방제가를 보였으며, 미생물제품 EXTN-1과 화학농약 propineb는 각각 86.6%, 47.2%의 방제효과를 보였다. 고추 역병에 대한 길항균의 생물활성을 검정한 결과, DM152, DH16의 균주는 83.0% 이상의 방제가를 보였으며, 미생물제품 EXTN-1과 화학농약 dimetomorph은 각각 65.5%, 98.9%의 방제효과를 보였다. 따라서, B. cinerea, P. brassicae, C. acutatum, P. capsici에 대하여 생물활성이 우수한 10종의 길항균을 선발하였고, 생물적 방제제로 활용 가능성을 확인하였다(Table 2).

Effect of antagonistic microorganisms on suppression of gray mold caused by Botrytis cinereal, clubroot caused by Plasmodiophora brassicae, anthracnose caused by Colletotrichum acutatum and phytophthora blight caused by Phytophthora capsici under greenhouse pot trials
이 밖의, Bacillus속, Paenibacillus속, Streptomyces속 균주는 다양한 기주와 식물병원균에 대하여 생물적 방제 효과가 보고되고 있다. Xu와 Kim (2014)은 토양에서 분리한 P. polymyxa SC09-21은 토마토 근부썩음병에 대하여 살균제 metconazole과 비교하여 81.7%의 우수한 방제효과를 나타냈고, Chen 등 (2000)은 선충을 억제하는 토양에서 분리된 S. costaricanus 균주는 길항적 작용의 특성을 가지고 있어 선충에 대한 생물적 방제제로 검증하였다. 또한, S. misionensis의 두 균주 BH4-1, BH4-3은 in vitro와 in vivo에서 피스타치오 줄기마름병, 궤양 병에 대하여 살균제 Cupravit (Bayer CropScience, Granada, Mexico)과 비교하여 비등한 방제효과를 보여 생물적 방제력을 검증하였다(Torabi 등, 2019). 특히, Bacillus속 균은 생물적 방제에 중요한 역활을 하는 iturin, surfactin, bacillomycin, fengycin 등의 lipopeptide계를 포함한 항생물질을 분비한다고 알려져 있다(Ntushelo 등, 2019; Zeriouh 등, 2011). 본 연구에서도 선발된 4종의 Bacillus속 균은 iturin A와 surfactin과 같은 항생물질을 생산할 것으로 추정된다.
길항미생물의 동정
선발된 10종의 길항균은 주사전자현미경을 통한 형태학적 분석과 16s rRNA 염기서열 분석을 통하여 동정한 결과, 4종의 Bacillus spp., 3종의 Paenibacillus spp., 3종의 Streptomyces spp.으로 분류되었다. DM146 균주는 B. subtilis, DM152 균주는 B. velezensis, DH16 균주는 B. subtilis subsp. subtilis와 99.93% 상동성을 보였고, DH2 균주는 B. atrophaeus와 100% 상동성을 보였다. 또한, DF30, DH14 균주는 P. polymyxa와 99.86% 상동성이 일치하였고, DM142 균주는 P. jamilae와 100% 상동성이 일치하였다. 또한, DF137 균주는 S. misionensis와 99.85% 상동성을 보였고, DM48 균주는 S. costaricanus와 99.93% 상동성이 일치하였다. DH92 균주는 genomic DNA를 획득하는데 실패하여 16S rRNA gene 염기서열을 분석하지 못하였지만, 형태적 특성에 따라 Streptomyces sp.로 동정하였다(Figs. 1, 2).

Spore morphological characteristics by scanning electron microscopy and colony shape on potato dextrose agar medium: DF30 (A), DF137 (B), DM48 (C), DM142 (D), DM146 (E), DM152 (F), DH2 (G), DH14 (H), DH16 (I), and DH92 (J).
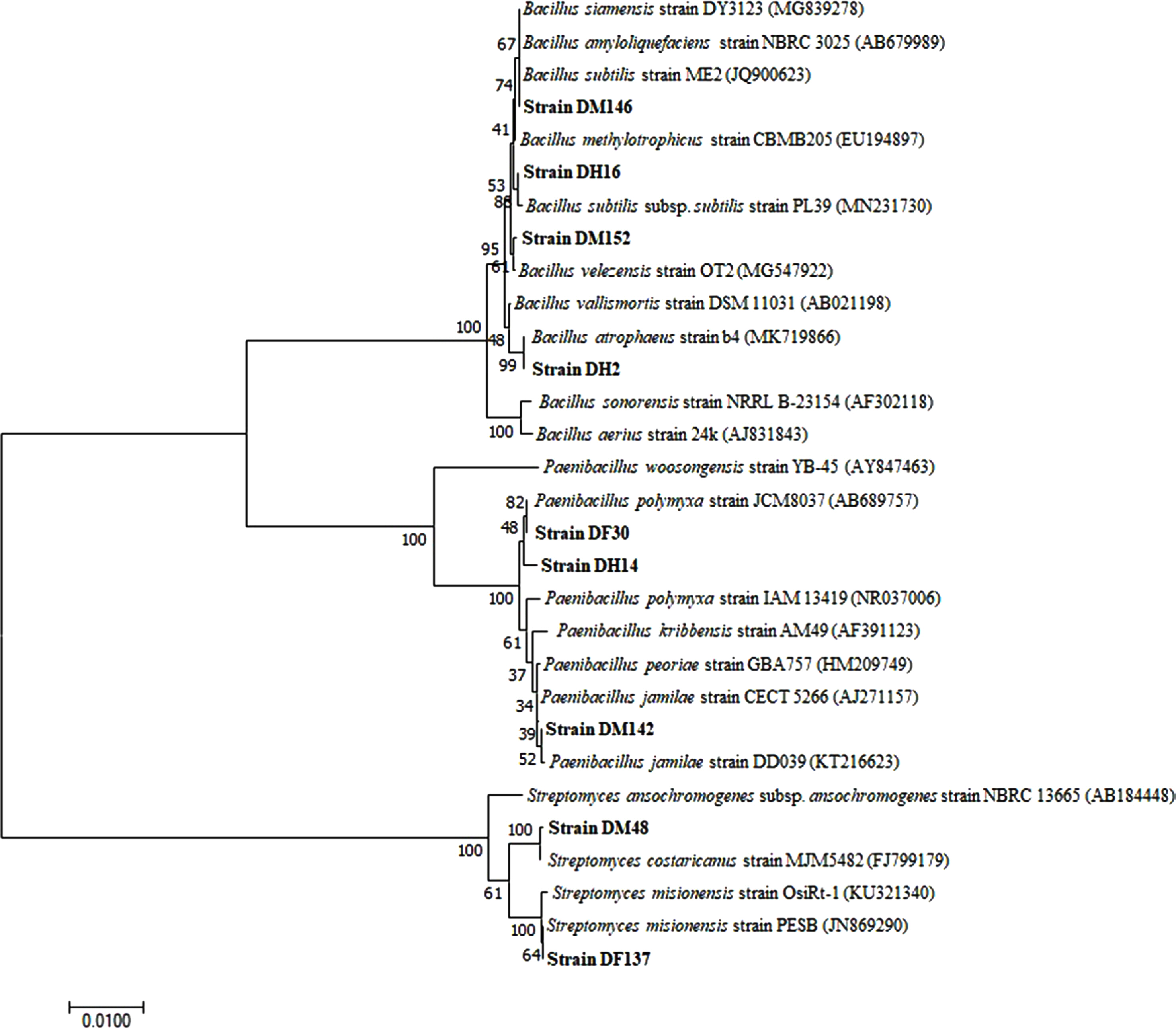
Phylogenetic relationship between antagonistic strains and representative species based on 16S rRNA gene sequences developed with the Clustal W program in MEGA 6.06 and constructed using the neighbor-joining method with 1,000 bootstrap replicates. The values indicate the percentage of clustering matches. The scale bar indicates the number of differences in base composition among sequences.
Bacillus속, Paenibacillus속, Streptomyces속 균주는 다양한 식물 균류병에 대하여 포자 발아와 균사 생장을 억제하여 강한 항균활성을 가지고 있어 생물적 방제능이 우수한 것으로 알려져 있다(Huo 등, 2010; Lee 등, 2006; Li 등, 2012). 또한, 본 연구에서 분리된 장내미생물은 Bacillus속, Paenibacillus속 균주가 제일 많은 분리비를 보였다(data not shown). 이러한 Bacillus속, Paenibacillus속 균주들은 endospore를 형성하기 때문에 고온, 방사선, 건조 등 불리한 환경에서 생장을 가능하게 한다(McSpadden Gardener, 2004; Nicholson 등, 2000). 이와 마찬가지로 곤충은 섭식 환경에 따라 정착하고 있는 장내 미생물 군의 양상이 다르며, 이러한 공생자는 공진화를 통하여 영양소가 불리한 극한 환경에서도 서식 가능하게 한다. 따라서, 곤충의 장내 미생물 중 endospore를 형성하는 균주들은 식물 병원균을 억제하거나 작물의 생육을 직•간접적으로 촉진시키는 등 유용한 효과를 농업 환경에 기여할 수 있다고 생각된다. 또한, Han 등(2015)은 같은 Bacillus속일지라도 strain에 따라 각각 분비하는 항생물질이 다르고 항균활성의 효과가 다를 수 있다고 보고하였다. 이와 같이 장수풍뎅이 유충의 각각의 소화기관 전장, 중장, 후장에서 strain이 같더라도 장내 특성에 따라 정착 미 생물의 기능성이 다를 것으로 추정된다.
IAA 생성능
유용 미생물에 의한 식물 호르몬의 생산은 식물생장촉진 활성의 가장 중요한 요소 중 하나이다. 지금까지 IAA, cytokinins, gibberellins 같은 식물호르몬을 생산하는 유용 미생물의 효과에 대한 많은 보고가 있다(Kavamura 등, 2013; Son 등, 2014). 선발된 10종의 균주에 대한 IAA 생성 활성 조사를 위해 흡광도를 측정한 결과, 1.2‒26.9 μg/ml의 우수한 IAA 생성능을 보였다. 후장에서 분리한 DH92 균주가 26.9 μg/ml로 가장 높은 생성능을 보였고, 중장에서 분리한 DM48 균주가 1.2 μg/ml로 가장 낮은 생성능을 보였다(Fig. 3A). IAA 생성은 세포 혹은 식물의 생장과정을 제어하기 때문에 중요한 특징이다(Lambrecht 등, 2000). 이러한 결과는 다양한 기능성을 보유한 장내 유용 미생물이 식물과 미생물의 상호작용을 통하여 식물의 생장을 촉진한다고 생각된다.
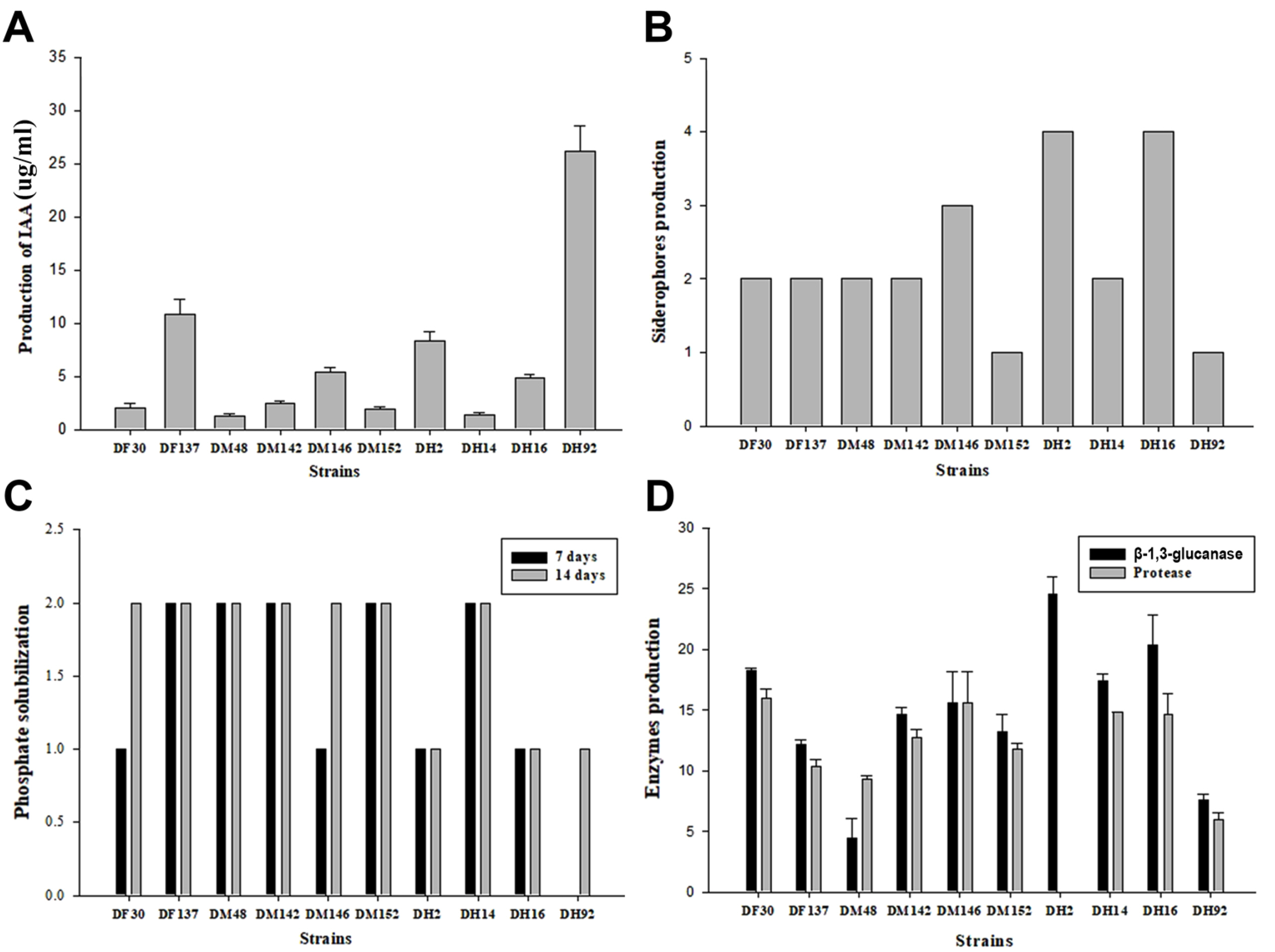
Evaluation of functional substance by selected bacterial strains. (A) Indole-3-acetic acid (IAA) production. (B) Siderophore production as: 0, no halo zone; 1, halo zone of 0.1-5 mm; 2, halo zone of 5.1-10.0 mm; 3, halo zone of 10.1-15.0 mm; 4, halo zone of 15.1 mm and above. (C) Phosphate solubilization as: 0, no halo zone; 1, slight halo zone; 2, clear halo zone. (D) Production of β-1,3-glucanase and protease.
인산 가용화 활성 검정
인산은 에너지 대사에 관여함으로써 식물의 생장과 발달에 가장 필수적인 요소 중 하나이다. 이러한 인산은 토양에 무기 인산염 형태로 존재하지만 불용화되어 식물이 직접적으로 흡수를 할 수 없다. 따라서 유용 미생물의 적용은 난용성 인산염을 분해하여 식물이 흡수할 수 있게 도움을 줄 수 있으며, 화학비료의 사용을 줄이고 토양 불균형을 막을 수 있다(Hameeda 등, 2008; Rajan 등, 1996). 본 연구에서 선발된 10종의 장내 미생물 모두 불용성 인산이 포함된 Pikovskaya’s agar 배지에서 투명환을 형성하였다. DF137, DM48, DM152, DH14 균주는 7일, 14일 후 모두 높은 활성을 보였으며, DH2, DH92 균주는 14일 후에도 낮은 활성을 보였다(Fig. 3B).
Siderophore 활성 검정
철은 필수적인 영양소이지만 토양에서 상대적으로 쉽게 용해되지 않는다(Vessey, 2003). 이는 유용 미생물에 의해 제한된 철(Fe3+) 성분 결합물질인 siderophore를 생산하여 다양한 식물병원균의 생육을 저해하거나 직간접적으로 작물의 생장을 촉진할 수 있다. 본 연구에서 선발된 10종의 장내 미생물 모두 CAS agar 배지에서 오렌지 색깔로 변색되어 halo zone을 형성하였다. DM146, DH2, DH16 균주가 CAS agar 배지에서 15.1 mm 이상의 halo zone을 형성하여 siderophore 생성능이 우수한 것으로 평가되었다. DM152, DH92 균주는 0.1‒5 mm의 halo zone을 형성하여 낮을 활성을 보였다(Fig. 3C). 이는 유용 장내 미생물에 의한 siderophore의 생산은 식물에 철을 공급할 수 있는 중요한 역할을 할 수 있다고 생각된다.
가수분해효소(β-1,3-glucanase, protease) 활성 검정
생물적 방제능과 식물생장촉진능을 가지는 유용 미생물의 특징 중 하나는 식물병원균으로부터 식물을 보호할 수 있는 β -1,3-glucanase, protease 같은 진균 외막 가수분해 효소의 활성이다. 본 연구에서 선발된 10종의 유용 장내 미생물은 다양한 수준의 β-1,3-glucanase, protease 활성 효과를 보였다. DF30, DF137, DM142, DM146, DM152, DH14, DH16 균주는 10.0 mm 이상의 투명환을 형성하여 높은 활성을 나타냈다. DH2 균주는 β-1,3-glucanase 효소 활성은 우수하였지만, protease 활성은 나타내지 않았다(Fig. 3D). β-1,3-glucanase, protease 활성 효과를 가진 유용 미생물은 식물생장 촉진과 유기물 분해에 있어 중요한 역할을 할 뿐만 아니라 식물병원균의 생장을 억제하는 데 도움을 줄 수 있다(Minaxi 등, 2012).
식물생장촉진 활성 검정
선발된 10종의 균주를 토마토와 고추 유묘를 대상으로 식물생장촉진 활성을 검정하였다. 토마토 유묘에 처리한 길항균 중 DF30, DM152, DH16 균주가 토마토 식물체의 모든 기관에서 생장촉진활성이 가장 우수하게 나타냈다. 줄기 기관의 길이와 직경은 DF30 균주 처리구가 54.32 cm, 7.30 mm로 가장 높았으며, 생체 중량과 건조 중량에서는 DM152 균주 처리구가 56.56 g, 3.22 g으로 가장 높았다. 뿌리 기관의 경우 길이는 DF137 균주 처리구가 가장 높았으며, 생체 중량과 건조 중량에서는 DM152 균주 처리구가 8.84 g, 0.55 g으로 가장 좋은 활성을 보였다. 엽록소 함량에서는 DM142 균주 처리구가 37.63 spad units로 가장 좋은 활성을 보였다(Table 3). 고추 유묘의 경우, 처리구 중에서 DM142, DM152가 처리된 고추의 모든 기관에서 생장촉진활성이 가장 우수하게 나타냈다. 줄기의 길이와 중량에서는 DM142 균주가 32.78 cm, 6.90 mm로 가장 높았으며, 생체 중량과 건조 중량에서는 DM152 균주가 22.96 g, 2.91 g, DM142 균주가 21.62 g, 3.37 g으로 가장 높았다. 뿌리 기관의 경우 길이는 DM152 균주가 19.2 cm로 가장 높았으며, 생체 중량과 건조 중량에서는 DM142 균주가 13.62 g, 1.47 g으로 가장 높았다. 엽록소 함량에서는 유의차이는 없었지만 DM152 균주가 56.22 spad units로 가장 좋은 활성을 보였다(Table 4). 선발된 10종의 장내 미생물 중에서, DM152 균주는 인산 가용화 활성은 우수하지만 IAA, siderophore 생성 활성이 다른 균주와 비교하여 저조함에도 불구하고 고추와 토마토 식물체 모두에서 가장 강력한 식물 생장 촉진 활성을 보였다. 이는 다양한 메커니즘이 상호작용하거나 하나의 독립된 메커니즘이 식물 생장 촉진하는 효과에 관여했을 것으로 추정된다. 이는 Son 등(2014)이 보고한 고추 식물체에 처리한 Kluyvera cryocrescens KUDC1771 균주와 일치한다. 이는 식물 생장 촉진에 관여하는 메커니즘을 규명하기 위해 나아가 다양한 연구가 필요하다.
곤충은 장내에 존재하는 미생물과 상호작용을 하면서 유익한 공생관계를 유지하며, 장내에 존재하는 공생자는 곤충에 잠재적인 역할로 생육에 필수적인 영향을 미치며 극한 환경에도 적응할 수 있도록 도와준다. 최근 이러한 이유로 장내 미생물을 유용한 소재로 인식하고 있으며, 생물학적 방제제에 대한 검증이 많은 논문에서 보고되었다. Lee 등(2013)은 장수풍뎅이 유충의 분변에서 다양한 방선균이 분리되었고, 그 중 Streptomyces spp.는 식물병원균 C. gloeosporioides, F. oxysporum에 대하여 균사생장 억제를 보여 강한 항균활성을 보였으며, 또한 카제인, 셀 룰로오스, 키틴의 분해능에 대한 강한 활성을 보여 유용한 생물 소재의 활용 가능성을 보였다. 또한, Nam 등(2016)은 장수풍뎅이 3령 유충의 분변에서 분리한 B. amyloliquefaciens KB3는 lipo-cyclopeptide계의 항생물질인 iturin A와 surfactin를 생성하며, 다양한 식물 균류병에 균사생장억제를 보여 넓은 스펙트럼을 보였으며, 토마토 잿빛곰팡이병에 대하여 미생물제품 Bacillus subtilis QST-713과 비교하여 우수한 방제효과를 나타내어 생물적 방제제로 활용 가능성을 제시하였다. 또한, Swain과 Ray (2008, 2009)는 소 분변에서 분리한 B. subtilis 균주가 다양한 식물병원균에 항균활성과 우수한 인산가용화 활성 및 효소활성을 보이며 작물의 생장을 촉진한다고 보고하였다. 이와 같이 곤충 장내 미생물의 우수성에 대해 다양한 사례에 의해 검증되었다. 따라서 본 연구는 생물적 방제제의 새로운 탐색의 가능성을 제시하였고, 화학농약과 비료를 대신할 수 있는 생물비료의 가능성을 나타내었다
요 약
곤충은 장내에 서식하고 있는 미생물과 상호작용을 통해 공생하는 것으로 알려져 있으며, 이러한 공생자는 공진화를 통하여 극한 환경에서도 서식을 가능하게 한다. 이러한 관점에서 토양 속에서 부엽토와 식물 잔재를 먹고 사는 장수풍뎅이 유충의 장내에 존재하는 공생자는 식물병원균을 방제하는 데 유용한 미생물이 존재할 것으로 생각된다. 따라서, 식물병원균에 대해 활성을 갖는 유용 미생물 10종을 장수풍뎅이 유충의 소화기관 전장, 중장, 후장으로부터 분리하였다. 분리된 10종의 유용 미생물은 유묘 검정을 통하여 토마토 잿빛곰팡이병, 배추 뿌리혹병, 고추 탄저병, 고추 역병에 대하여 강력한 항균 활성을 확인하였다. 10종의 항균활성 미생물은 형태적 특성과 16s rRNA gene 분석으로 Bacillus속 4종, Paenibacillus속 3종 및 Streptomyces속 3종으로 동정되었다. 유용 미생물은 인산 가용화, indole-3-acetic acid, siderophore 생성 활성이 우수하며 진균 외막가수분해 효소인 β-1,3-glucanase, pretease 활성을 보였다. 10종의 유용 미생물 중, DM152 균주는 토마토와 고추 식물체의 모든 기관에서 생장을 촉진시켰다. 따라서, 장수풍뎅이 유충의 소화기관으로부터 분리된 10종의 장내 미생물은 생물학적 방제제 및 생물비료의 활용 가능성을 나타내었다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.