자단향으로부터 밀 붉은곰팡이병균 Fusarium graminearum에 대한 항진균활성 물질의 분리 및 특성 규명
Isolation and Characterization of Antifungal Metabolites from Pterocarpus santalinus against Fusarium graminearum Causing Fusarium Head Blight on Wheat
Article information
Abstract
Fusarium head bight (FHB) is a devastating disease on major cereal crops worldwide which causes primarily by Fusarium graminearum. Synthetic fungicides are generally used in conventional agriculture to control FHB. Their prolonged usage has led to environmental issues and human health problems. This has prompted interest in developing environmentally friendly biofungicides, including botanical fungicides. In this study, a total 100 plant extracts were tested for antifungal activity against F. graminearum. The crude extract of Pterocarpus santalinus heartwood showed the strongest antifungal activity and contained two antifungal metabolites which were identified as α-cedrol and widdrol by GC-MS analysis. α-Cedrol and widdrol isolated from P. santalinus heartwood extract had 31.25 mg/l and 125 mg/l of minimal inhibitory concentration against the spore germination of F. graminearum, and also showed broad spectrum antifungal activities against various plant pathogens. In addition, the wettable powder type formulation of heartwood extract of P. santalinus decreased FHB incidence in dose-dependent manner and suppressed the development of FHB with control values of 87.2% at 250-fold dilution, similar to that of chemical fungicide (92.6% at 2,000-fold dilution). This study suggests that the heartwood extract of P. santalinus could be used as an effective biofungicide for the control of FHB.
서론
Fusarium graminearum은 전세계적으로 밀, 보리, 벼 등에 붉은곰팡이병을, 옥수수에는 이삭썩음병을 일으키는 원인균으로 곡류의 품질저하와 수확량 감소 등의 경제적 손실을 입힌다고 알려져 있다(Desjardins, 2006; Goswami 등, 2004; McMullen 등, 1997). 우리나라에서도 1963년 남부지방의 맥류 붉은곰팡이병 대발생으로 인해 평균 40-60%, 심한 지역은 80-100%의 맥류수확량이 감소하여 큰 사회적 문제로 대두된 이후(Chung, 1975), 약 10년을 주기로 반복적인 피해를 입은 것으로 보고되었다. 특히 ‘74년, ‘90년에는 지역적인 발생이 심각하였고, ‘98년에도 경남, 전남, 전북, 충남지역에 대발생하여 69- 84%의 높은 이병수율을 보여 맥류수확량에 심각한 피해를 입혔다(Ryu 등, 2011). 그러나 연작과 기상이상으로 인한 출수기의 고온 다습해진 기후로 2002년, ‘07년, ‘10년과 ‘11년 붉은곰팡이병이 연이어 남부지방의 맥류 재배지역에 크게 발생하여 병발생주기가 단축되고 있는 양상을 띠기에 그 피해는 추후 더욱 심각해질 것으로 예상된다(Park 등, 2012; Shim 등, 2009).
붉은곰팡이병은 생산량 감소를 초래할 뿐만 아니라 곡류의 감염된 부위에 인축에 유해한 trichothecenes와 zearalenone 등의 곰팡이독소를 오염시킴으로써 농산품의 품질을 저하시키며, 특히 trichothecene의 일종인 deoxynivalenol은 면역력 저하, 소화관 장애를 유발하는 등 심각한 중독증을 야기한다 (Peraica와 Domijan, 2001). 붉은곰팡이 방제 및 독소 오염 예방을 위하여 metconazole, propiconazole, prothioconazole, tebuconazole 등의 demethylation inhibitor (DMI) 계열 합성 살균제가 일반적으로 사용되어 왔다. 화학적 방제의 경우 처리 시기가 매우 중요하며, 밀은 이삭으로부터 꽃밥이 처음으로 나오는 개화기에(Bradley 등, 2009; 2010), 보리의 경우는 이삭이 나오는 출수기에 살포해야 한다고(Bondalapati와 Stein, 2010) 알려져 있지만 밀의 경우 개화기뿐만 아니라 개화 후에도 지속된 강우는 붉은곰팡이병 발생과 독소 오염 수준에 큰 영향을 준다고 보고되었다(Ibáñez-Vea 등, 2011). 또한 벼의 경우 9월 이후부터 붉은곰팡이병 발생이 증가하여 수확기까지 진행되며 저장 중에도 감염곡물의 품질 저하, 수량 감소를 지속적으로 일으킬 수 있다고 보고되었다(Son 등, 2011). DMI 계통의 합성농약은 농약잔류문제로 수확전 30일 이전까지만 사용이 제한되어 있으며 국소적 침투이행능으로 인해 실제 포장에서 방제가는 50% 이하로 약효가 우수하지 못하다는 단점이 있다 (McMullen 등, 2012). 더욱이 아직까지 붉은곰팡이에 대한 DMI 합성농약의 저항성이 문제시 되지 않았지만 보리 흰가루병균 (Erysiphe graminis), 핵과류의 잿빛무늬병원균(Monilinia fructicola), 밀 얼룩무늬병원균(Mycosphaerella graminicola) 등과 같은 몇몇 중요한 식물병원성 곰팡이에 대한 DMI 저항성이 대두되어 심각한 문제를 유발하고 있기에(Delye 등, 1998; Leroux 등, 2007; Luo와 Schnabel, 2008; Yin 등, 2009) 환경과 인간에 안정적이며 사용기간에 제한없이 수확기에도 처리할 수 있는 안전한 친환경 생물농약에 대한 개발이 시급한 실정이다.
정유, terpenoids, alkaloids, flavonones, polyketides 등을 포함한 식물유래 기능성물질을 이용한 천연물농약은 병원균 특이적일 수 있으며, 인간에 독성이 거의 없고, 합성농약성분과 작용기작이 달라 저항성병원균 출현을 저해하고, 쉽게 분해되기에 차세대 식물병방제제 개발을 위한 좋은 자원으로 여겨지고 있다(Copping과 Duke, 2007; Copping과 Menn, 2000; Le Dang 등, 2012).
자단향(영문 한약재명: Santali Lignum Rubrum)은 한약재로서 콩과에 해당하는 자단(Pterocarpus santalinus)이라는 식물의 심재 부분이며, 탈취와 지혈, 해열 등에 효과적인 것으로 알려져 있다. 또한, 자단향 에탄올 추출물이 혈당을 저하시키는 효과가 있으며, 자단향에서 분리한 benzofurans 등의 물질은 항염증 효과와 세포 독성 기능을 가진다고 보고되어 있다 (Nagaraju 등, 1991; Wu 등, 2011). 자단향은 한약재로서의 생리적 기능뿐만 아니라 Candida albicans, Aspergillus niger, Rhizopus속, Fusarium속 등의 곰팡이 균사 생육을 억제한다는 항균활성이 보고되어있으나, F. graminearum에 대한 항진균활성과 밀 붉은곰팡이병에 대한 방제효과에 대해서는 지금까지 보고된 바가 없다(Jyothi Chaitanya 등, 2014; Vandita 등, 2013).
본 연구에서는 확보한 한약재 추출물 100종을 대상으로 밀 붉은곰팡이병의 원인균인 F. graminearum의 항진균 활성을 평가하여 자단 심재부(자단향) 추출물의 효과적인 항균활성을 확인하였다. 또한 원재료의 대량확보가 용이하며, 부가적으로 다양한 식물병원균에 대한 항진균 활성을 확인하여 실제적 이용가능성이 높은 것으로 판단된 자단향으로부터 항진균활성 물질을 분리하여 항진균활성을 조사하고, 분리한 항진균물질의 구조를 동정하였다. 더욱이 조추출물로 제제를 제조한 후 밀 붉은곰팡이병에 대한 방제활성을 조사하여 생물농약 후보물로서 자단향의 가능성을 타진하였다. 이러한 연구는 기능성 천연물추출물의 생물농약개발을 통하여 화학농약을 보완하거나 대치하여 농작물의 친환경 재배 및 재배환경의 안전성을 향상시키는데 자단향 추출물의 항진균성분이 유용함을 제시하고 있다.
재료 및 방법
식물 시료
붉은곰팡이병 방제에 유용한 식물유래 천연물 농약 후보물질을 개발하기 위하여 한국식물추출물은행(한국 생명공학연구원, 오창, 한국)으로부터 분양받은 한약재 100종의 ethanol (EtOH) 조추출물을 F. graminearum에 대한 항균 활성 시험에 사용하였다. 또한 선발한 자단향으로부터 활성물질을 분리하기 위하여 광주 한약재도매시장에서 자단 줄기의 심재 부분을 건조한 자단향(전북 임실)을 구입하여 사용하였다.
사용 균주
붉은곰팡이병을 일으키는 원인균 F. graminearum에 대한 식물추출물과 자단향 추출물의 항균활성을 확인하기 위하여 F. graminearum 야생종 Z-3639 (Bowden와 Leslie, 1999)를 병원균으로 이용하였으며, 시험 균주의 생장배지로 potato dextrose agar (PDA; Becton, Dickinson and Company, MD, USA)를 사용하였다. 병원성 검정시험에 사용할 포자는 carboxymethylcellulose 배지(CMC, carboxymethylcellulose 15 g, NH4NO3 1 g, KH2PO4 1 g, MgSO4 · 7H2O 0.5 g, yeast extract 1 g, 증류수 1 l)를 사용하여 생성하였다(Cappellini와 Peterson 1965; Leslie와 Summerell, 2008). F. graminearum 은 장기보관을 위해 균사체를 20% glycerol 용액에 현탁하여 -70°C에 보관하였다.
항진균활성 물질 분리 및 구조 동정
마쇄한 자단향(200 g) 을 methanol (MeOH, 3 l)에 하루 동안 실온에서 침지시켜 추출하였다. 추출액은 여과지에 걸러 MeOH 추출액을 확보하였으며, residue에 다시 3 l의 MeOH을 가하여 한번 더 추출하였다. 추출액을 수합하여 rotary evaporator (OSB-2100, EYELA, Japan)로 45°C 이하의 수욕상에서 감압 농축하였다. 확보한 MeOH 추출물(305 g)을 70% MeOH로 다시 녹인 후 동량의 n-hexane을 가하여 2회 분획하였다. 70% MeOH 층은 rotary evaporator로 농축하여 MeOH을 완전히 제거한 후 남아있는 물층에 증류수를 첨가한 뒤 동량의 ethyl acetate (EtOAc)로 2회 분획하였다. EtOAc 추출물은 anhydrous sodium sulfate 를 가하여 물을 제거한 후 감압 농축하였다. 또한 남아 있는 물층에 butanol (BuOH)을 2회 첨가하여 분획한 후 얻어진 BuOH 층과 물층을 각각 감압 농축하였다. 이와 같이 획득한 4개의 추출물에 대한 F. graminearum 포자 발아 저해활성을 조사한 결과, n-hexane층이 가장 효과가 우수한 것으로 나타나, 이 시료로부터 항진균활성 물질 분리를 실시하였다.
F. graminearum 포자발아 억제 활성이 가장 우수한 n-hexane 분획물(3 g)을 silica gel column (3.6 cm i.d.×60 cm, Kiesel gel 60, 70-230 mesh, 200 g; Merck, Darmstadt, Germany)에 가한 후 n-hexane:acetone (9:1, v/v)의 용출조건하에서 항균활성 물질은 용출하였다. 용출된 각 분획들은 silica gel 60 F254이 피복된 glass plate (Merck, Germany) 상에서 n-hexane:acetone (9:1, v/v) 전개용매조건으로 thin-layer chromatography (TLC) 분석을 진행하여 같은 TLC 패턴을 보이는 분획끼리 수합하여 총 5개의 분획(F1-F5)를 획득하였다. 각 분획의 F. graminearum 포자 발아 억제활성을 검정한 결과, 항균활성을 보인 F4와 F5를 수합한 후 상기 silica gel column chromatography와 동일한 조건으로 시료(2.75 g)를 통과시켜 4개의 분획으로 세분하였으며(F41-F44), 이 중 포자발아 억제 활성이 가장 우수한 F41 (909.7 mg) 시료의 항균활성물질을 분리하기 위하여 column chromatography를 재수행하였다. F41 시료를 silica gel column (2.8 cm i.d.×60 cm, Kiesel gel 60, 230-400 mesh, 50 g; Merck, Germany)에 가한 다음 EtOAc:n-hexane (1:7, v/v)의 조건하에서 용출하여 물질 1 (99 mg)을 순수분리하였다. 또한 활성을 보인 F3 (342 mg)으로부터 활성물질을 분리하기 위하여 분취형 TLC (Kiesel gel 60, 0.5 mm film 두께; Merck, Germany)를 수행하였다. 전개용매는 toluene:EtOAc:acetic acid (60:20:1, v/v/v)였으며, 최종적으로 물질 2 (13 mg)을 순수분리하였다.
분리한 물질의 화학구조를 동정하기 위하여 gas chromatography-mass spectrometry (GC-MS) 분석을 실시하였다. GC-MS (QP2010; Shimadzu, Kyoto, Japan) 기기에 DB-5 column (0.25 mm i.d.×60 m, 0.25 µm film, Agilent Technologies, Palo Alto, CA, USA)을 사용하였으며 시료 분석 시 ion source 온도 200°C, injector 온도 250°C에서 oven 온도를 100°C로 2분간 유지하다가 280°C까지 분당 10°C씩 증가시킨 후 최고온도 280°C 에서 3분간 유지하였다.
포자발아 저해활성
한국식물추출물은행으로부터 분양받은 100개의 EtOH 추출물, 자단향 조추출물로부터 획득한 4개의 용매 추출물(n-hexane층, EtOAc층, BuOH층, 물층) 및 자단향으로부터 분리한 2개의 항진균활성 물질의 F. graminearum 의 macroconidia에 대한 포자발아 억제 효과를 조사하였다. CMC 배지에 F. graminearum을 접종하고 4일간 25°C에서 200 rpm으로 진탕배양한 후 멸균한 4겹 거즈로 거른 여과액을 4°C에서 10,000 rpm에서 15분간 원심분리하였다. 원심분 리 후 상징액은 버리고, 침전물에 potato dextrose broth (PDB; Becton, Dickinson and Company)를 가하여 항균활성조사에 사용할 포자를 회수하였다. 포자는 hemocytometer (0.0025 mm2, Marienfeld Superior, Lauda-Königshofen, Germany) 로 계수하여 1×106 macroconidia/ml의 농도가 되도록 PDB로 희석시켰다. 48 well plate의 각 well에 포자 현탁액을 198 μl 씩 분주한 후, 시료 2 μl를 첨가하여, EtOH 추출물은 최종 농도가 2,000, 1,000, 500 mg/l, 4개의 자단향 용매 추출물은 최 종농도가 2,000, 1,000, 500, 250, 125, 62.5, 31.25, 15.625 mg/l, 그리고 분리한 두 물질은 최종농도가 250, 125, 62.5, 31.25, 15.63, 7.81, 3.91 mg/l가 되도록 처리하였다. EtOH 추출물은 EtOH로, n-hexane층과 EtOAc층은 acetone으로, BuOH 층은 MeOH, 물층은 10% EtOH, 그리고 분리한 두 물질은 dimethylsulfoxide(DMSO)로 용해하였다. 무처리구는 유기용매(acetone, MeOH, DMSO)를 최종농도 1%로 처리하였다. 처리당 3반복으로 실험을 수행하였으며, 25°C에서 진탕배양하여 무처리구의 포자가 모두 발아한 시간(6시간)에 모든 처리구의 포자발아 여부를 관찰하였다. 각 well의 배양액을 10 μl씩 취하여 포자발아 여부를 현미경(100배; Harris Swift M1000-D; Swift Optical Instruments, Schertz, TX, USA)으로 관찰하였다. 포자 발아는 발아관의 길이가 포자 단면의 너비 이상인 경우를 발아로 하였다. 한 처리구 당 3반복하여 실험하였으며 각 well 당 300개 이상의 포자를 관찰하였다.
균사 생육 억제활성
자단향 n-hexane 분획물에서 분리한 물질 1, 2의 다양한 식물병원성 진균에 대한 항진균활성을 조사하기 위하여 F. graminearum (Z-3639)와 더불어 벼 잎집무늬 마름병균인 Rhizoctonia solani (한국화학연구원, 대전, 한국), 벼 도열병균인 Magnaporthe oryzae (KACC46522, 국립농업과 학원 미생물은행), 토마토 시들음병균인 Fusarium oxysporum f.sp. lycopersici (KACC40043), 잔디 동전마름병균인 Scleotinia homoeocarpa (서울시립대), 고추 탄저병균인 Colletotrichum coccodes (한국화학연구원), 밤나무 줄기마름병균인 Cryphonectria parasitica (충북대학교) 등의 다양한 식물병원성 진균에 대하여 균사 생육 억제활성을 조사하였다. 자단향으로부터 분리한 두 물질은 DMSO로 용해시켜 사용하였다. 균사 생육 억제 활성조사에 사용할 균사체를 얻기 위하여 PDB에 식물병원 균이 배양된 agar plug를 접종하여 25°C에서 7일 동안 정치 배 양한 후 멸균한 4겹 거즈에 걸러 얻어진 균사체는 50 mg 생체 중/ml의 농도가 되도록 멸균수를 첨가하여 균질화하였다. 균질화된 균사액을 96 well plate의 각 well에 99 μl씩 분지한 후 시료 1 μl를 첨가하여 최종 농도가 500, 250, 125, 62.5, 31.25, 15.63 mg/l가 되도록 처리하고 25°C에서 정치 배양하였다. 배양 후 무처리구의 균사가 육안으로 확인될 정도로 자란 시간을 기점으로 모든 처리구를 관찰하였다. 무처리구의 경우 1% DMSO 를 처리하였으며, 3반복으로 실험을 2회 반복하여 수행하였다. 균사생육을 완전히 억제하는 최소저해농도(MIC: minimum inhibitory concentration)를 결정하였다.
밀 붉은곰팡이병에 대한 방제효과
자단향 추출물의 밀 붉은곰팡이병에 대한 효과 및 약해 유무를 조사하기 위하여 전남대학교 밀 포장에서 실험을 수행하였다. 시험에 사용한 시료는 자단향 추출물을 분말수화제로 제형화하여 처리하였다. 자단향 n-hexane 분획물(2 g)을 소량의 acetone으로 용해한 후 white carbon (1.5 g)에 혼합하여 acetone이 증발하도록 약 2시간 동안 후드에 방치하였다. 이후 sodium dodecyl sulfate (CR-SES, 0.5 g)와 sodium poly (naphthalene formaldehyde) sulfonate (CR-WP100, 0.5 g), Kaoline 5.5 g을 순차적으로 섞어 제형화하였다(Yoon 등, 2010). 포장시험에 사용한 밀 품종은은 파밀이었으며, 개화된 밀 이삭만을 선택하여 500배와 250배로 희석된 분말수화제로 약제가 이삭에서 흘러 내릴 때까지 분무 처리하였다. 약제 처리 24시간 후 F. graminearum 포자현탁액을 2×105 conidia/ml의 농도로 조절하여 시료를 전처리한 밀에 접종하였다. 접종 후 습윤한 상태와 온도를 유지시켜주기 위해 비닐 (20 cm i.d.×8 cm)로 이삭을 덮고 큰 비닐로 밀 전체를 한 번 더 포장하였다. 비닐은 2일 후에 제거하였고 접종 10일 뒤 이삭의 병발생여부를 관찰하였다. 처리 당 3반복으로 실험을 수행하였으며 모든 반복은 30개의 이삭을 사용하였다. 대조약제로는 difenoconazole과 propiconazole 성분이 각각 13% 함유된 알무리(Syngenta, 한국)를 사용하였으며, 시료처리와 동일한 방법으로 실험을 수행하였다(Kim 등, 2016). 밀 붉은곰팡이병에 대한 약제의 방제효과는 아래의 식에 대입하여 산출하였다.
(A: 무처리구의 FHB index, B: 처리구의 FHB index, FHB index = 발병률×발병도/100, 발병도(% Disease severity) = 100×(이삭의 발병면적/이삭의전체면적)).
결과 및 고찰
자단향 추출물의 F. graminearum 포자발아 억제활성
한국식물추출물은행에서 분양받은 100종 한약재 추출물의 F. graminearum 포자발아 억제활성을 분석한 결과 자단향 추출물이 강한 항진균활성을 보였다(data not shown). 자단의 항진균활성에 관한 연구는, 심재부가 아닌 자단의 잎 추출물이 Candida albicans와 Aspergillus niger, Lasiodiploidia, Rhizopus 속의 균사 생육을 억제한다는 보고가 있다(Vandita 등, 2013). 또한, 자단과 같은 속에 속하는 Pterocarpus indicus의 경우 심 재부의 MeOH 추출물이 Trycomyces palustris와 Coriolus versicolor에 대하여 항진균활성이 보이고, P. indicus로부터 분리한 두 개의 flvaonoids 물질이 F. oxysporum, Cochliobolus miyabeanus, Trichoderma harzinum 등의 식물병원균에도 항진균활성을 나타낸다고 보고된 바 있다(Kusuma 등, 2005; Pilotti 등, 1995). 한편, 자단향은 예로부터 한약재로서 염증치료, 궤양, 암 등의 질병에 사용되어 왔으나(Kondeti 등, 2010; Kwon 등, 2006;Manjunatha, 2006) 식물병원균에 대한 항진균활성에 대해서는 지금까지 보고된 바 없다.
자단향의 MeOH 추출물로부터 분획과정을 통하여 획득한 n-hexane층, EtOAc층, BuOH층, 물층에 대하여 포자발아 억제 활성을 조사한 결과, n-hexane층과 EtOAc층에서 강한 억제 활성을 나타냈으며, 각각 250 mg/l와 500 mg/l에서 MIC값을 보였으며 Fig. 1에서와 같이 n-hexane층과 EtOAc층, BuOH층이 농도의존적으로 F. graminearum의 포자발아를 억제하였다. 하지만 BuOH층은 2000 mg/l의 농도에서도 100% 억제활성을 보이지 않았으며, 물층은 활성이 없는 것을 확인되었다.

Effects of n-hexane extract, ethyl acetate, butanol, and aqueous layers fractionated from Pterocarpus santalinus on the spore germination of Fusarium graminearum. Each value represents mean±standard deviation of two runs with three replicates. One hundred spores were observed using light microscopy for each treatment with three times. Different letters on bars indicate significant differences according to Duncan’s multiple range test at P=0.05.
항진균 활성 물질 구조동정
분획과정을 통하여 획득한 4개의 분획층 중 가장 강한 항균활성을 보인 자단향 n-hexane 분획 농축물에서 실리카 겔 컬럼 크로마토그래피와 분취형 TLC를 통하여 F. graminearum의 포자발아를 억제하는 두 개의 물질을 순수분리하였다. 분리한 두 개의 화합물은 GC-MS 분석 결과(Fig. 2A, 3A), 두 물질 모두 total ion chromatogram (TIC)에서 단일한 피크를 보임으로서 분리한 두 물질이 순수하다는 사실을 확인하였다. 또한 두 물질의 전자충돌 질량스펙트럼 (Electron impact-mass spectrum)을 library search를 한 결과 (Fig. 2B, 3B), 물질 1은 α-cedrol, 물질 2는 widdrol로 동정되었다. 두 물질 모두 분자량은 222이며, 분자식은 C15H26O로서 서로 이성질체 관계에 있다.
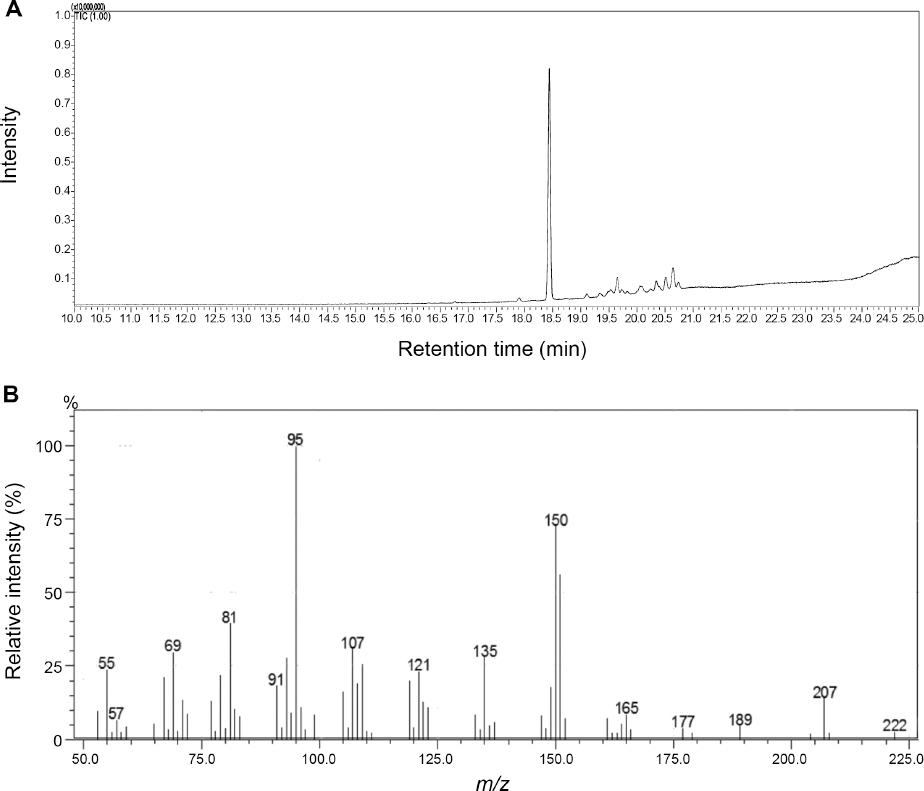
GC-MS total ion chromatogram (A) and electron-impact mass spectrum (B) of compound 1 isolated from the heartwood of Pterocarpus santalinus.
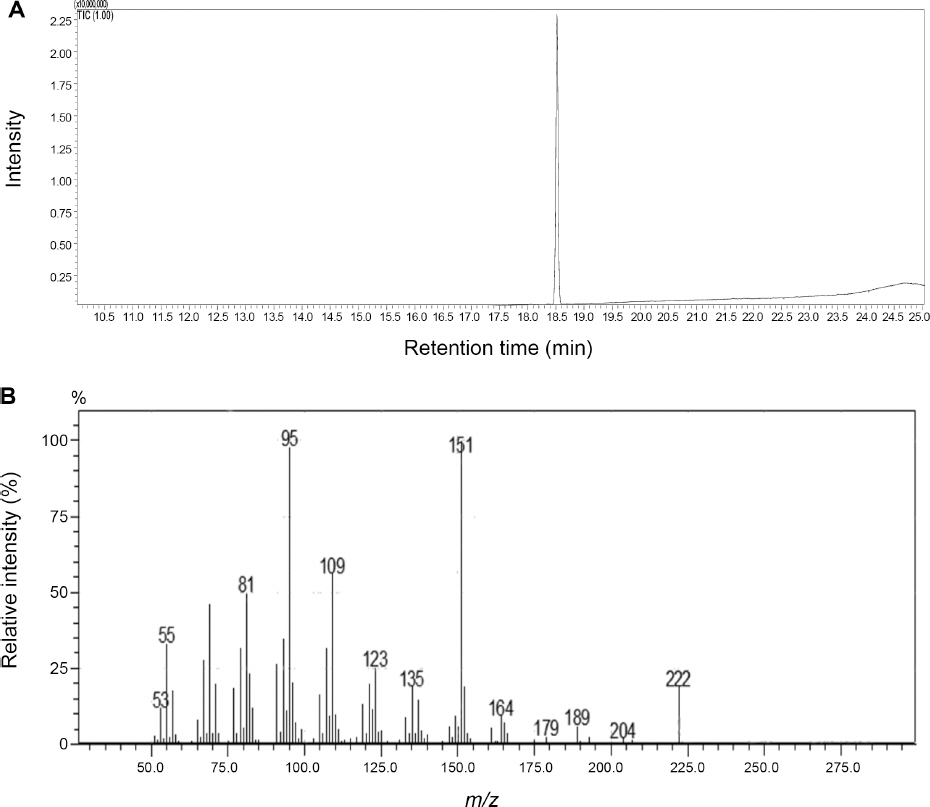
GC-MS total ion chromatogram (A) and electron-impact mass spectrum (B) of compound 2 isolated from the heartwood of Pterocarpus santalinus.
한편, bioautography assay를 실시하여 EtOAc층에서의 활성물질을 분리한 결과, n-hexane 분획물에서 분리한 항균활성 물질과 동일한 α-cedrol과 widdrol이라는 사실을 발견하였다(data not shown). 결과적으로 F. graminearum의 포자발아를 억제하는 자단향 추출물의 항균활성 물질은 α-cedrol과 widdrol으로 동정되었으며 두 물질은 n-hexane층과 EtOAc층에 분산되어 존재하였다.
α-Cedrol은 cedrol, (+)-cedrol 및 8-β-H-cedran-8-ol과 동일 하고, 침엽수, 특히 Cupressus속과 Juniperus속의 식물 정유(cedar oil)의 주요 성분으로 sesquiterpene alchol 물질이다(El-Sawi 등, 2007; Ismail 등, 2013). Widdrol은 Juniperus chinensis에 함유된 것으로 보고되며(Jin 등, 2015), 이 역시 식물 정유 성분 중의 하나이다. 자단으로부터 분리된 성분으로는 isoflavonoid, terpenoid, lignin 등이 있으며(Arunakumara 등, 2011), 본 연구에서 분리한 α-cedrol과 widdrol은 다른 식물에서 분리되어 구조가 알려져 있는 천연물이지만 Pterocarpus속 식물체 추출물로부터 α-cedrol과 widdrol이 지금까지 보고된 바 없다.
F. graminearum 포자발아 억제활성
자단향으로부터 분리한 α-cedrol과 widdrol의 F. graminearum 포자발아에 대한 저해활성을 조사한 결과, 두 물질 모두 농도의존적으로 포자발아를 효과적으로 억제하였으며, α-cedrol의 MIC가 31.25 mg/l, widdrol은 62.5 mg/l로 α-cedrol이 더 강한 활성을 보였다(Fig. 4). Fig. 5A는 무처리구의 배양 6시간 후 포자발아 모습이며, Fig. 5B와 5C는 각각 α-cedrol과 widdrol을 62.5 mg/l 수준으로 처리했을 때 동일시간에 포자발아가 억제된 모습이다. 무처리구의 포자는 모두 발아한 반면, 두 물질을 처리한 포자는 전혀 발아가 되지 않았다.
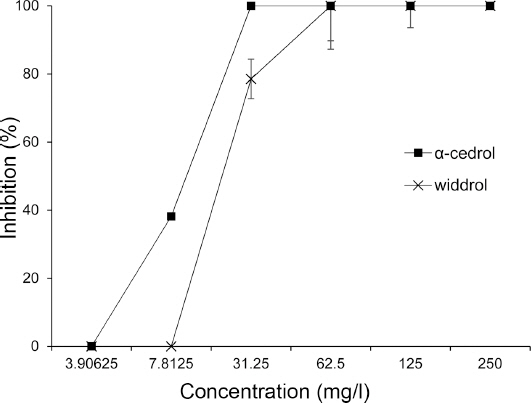
Effects of a-cedrol and widdrol isolated from Pterocarpus santalinus on the spore germination of Fusarium graminearum. Each value represents mean±standard deviation of two runs with three replicates. One hundred spores were observed using light microscopy for each treatment with three times.

Influence of a-cedrol and widdrol isolated from Pterocarpus santalinus on germination of Fusarium graminearum spores. Microscopic observation was performed 6 h after chemical treatment to the spores of F. graminearum. (A) control, (B) a-cedrol (62.5 mg/l), (C) widdrol (62.5 mg/l).
지금까지 α-cedrol과 widdrol은 Pterocarpus속에서 보고되지 않았으며 Juniperus속 유래 식물천연물로 알려져 있었다. Tumen 등(2012)은 목재분해 곰팡이에 대하여 항균활성을 보이는 Juniperus속 식물 심재부 추출물에서 α-cedrol, thujopsene 및 widdrol을 검출하였으나, 이들 각각 물질의 항균활성 여부는 확인하지 않았다. 한편, Nuñez 등(2006)은 Juniperus속에서 분리한 widdrol이 B. cinerea에 대하여 항진균활성을 보이며, Guleria 등(2008)은 Thuja orientalis에서 분리한 α-cedrol이 Alternaria alternata에 대하여 항진균성을 보인다고 보고하였다. 하지만 밀 붉은곰팡이병의 원인균인 F. graminearum에 대한 α-cedrol과 widdrol의 항진균활성 보고는 지금까지 없었기에 본 보고에서 Pterocarpus속 식물체 추출물로부터 분리한 acedrol과 widdrol의 붉은곰팡이에 대한 항진균활성을 처음으 로 보고하는 바이다.
Kim 등(2016)은 대계근으로부터 F. graminearum 포자발아를 억제하는 두 개의 항균물질 ciryneol C과 1-heptadecene-11,13-diyne-8,9,10-triol을 보고하였다. 이 두 물질의 경우 F. graminearum의 포자발아에 대한 MIC는 각각 125와 62.5 mg/l이었다. 이 두 물질과 비교할 때 자단향 유래 두 물질(α-cedrol의 MIC, 31.25 mg/l; widdrol의 MIC, 62.5 mg/l)은 대계근 유래 polyacetylene계 물질보다 활성이 우수한 것으로 나타났다.
균사생육 억제 효과
α-cedrol과 widdrol의 항균활성 스펙트럼을 조사하고자, F. graminearum을 포함한 다양한 식물 병원균의 균사생육 억제 활성을 측정하였다. 균사생육 최소억제농도를 측정한 결과, 두 물질은 시험에 사용한 7가지 식물병 원균 모두의 균사 생육을 저해하였다(Table 1). 전체적으로 α-cedrol이 widdrol보다 높은 항진균활성을 보였지만, M. oryzae에 대해서는 α-cedrol보다 widdrol이 더 높은 활성을 보였다. 특히, α-Cedrol의 경우 B. cinerea에 대하여 7.81 mg/l의 MIC를 보임으로서 가장 강한 항진균활성을 보였으며 S. homoeocarpa 와 C. coccodes, E. parasitica에 대하여 31.25 mg/l의 MIC를 보였다. Widdrol의 경우 M. oryzae와 B. cinerea에 31.25 mg/l로 가장 큰 활성을 보였다. F. graminearum의 균사는 α-cedrol과 widdrol에 대하여 각각 250 mg/l와 500 mg/l의 MIC를 보여 억제활성이 비교적 낮게 나타냈다. 따라서 두 물질은 F. graminearum의 균사 생육보다 포자발아에 대한 활성이 더 효과적이라는 결과를 보여주고 있다.
자단향 추출물의 밀 붉은곰팡이병 방제 효과
자단향 조추출물을 이용한 생물농약 개발 가능성을 타진하기 위하여 항진균활성이 가장 강한 n-hexane 분획층을 분말수화제(PS-WP20)로 제조한 후 밀 붉은곰팡이병에 대한 방제 효과를 포장에서 조사하였다. PS-WP20을 500배와 250배로 희석하여 포장에서 재배한 밀에 처리한 결과, 각각 47.0%와 87.2%의 방제효과를 보였으며, 대조약제로 사용한 알무리 4000배와 2000배에서는 84.2%와 92.6%의 방제효과를 보였다(Table 2). 자단향 분말수 화제의 경우 본 실험에서는 대조약제 상용농도와 통계적으로 동일한 방제효과를 보여 생물농약으로서의 가능성을 확인하였다.
자단의 산지는 인도남부, 중국의 해남도, 대만 및 스리랑카 등 이며, 주로 심재부는 한약재로 사용되고 있다. 또한 자단의 심재와 나무껍질 추출물은 당뇨치료 효과, 항미생물 효과, 항염증 효과, 간보호기능 등이 있는 것으로 보고되어 있다(Kondeti 등, 2010; Kwon 등, 2006; Manjunatha, 2006). 이러한 활성과 관련하여 이 식물체로부터 flavonoids, terpenoids, phenolic compounds, alkaloids, saponins, tannins 및 glycosides 등의 화합물들이 보고되어 있으나(Kondeti 등, 2010; Narayan 등, 2005), 본 논문에서 규명한 α-cedrol과 widdrol는 보고된 바가 없다. α-Cedrol의 경우 독성이 있고, 또한 발암물질일 가능성이 있다고 보고되었기 때문에(Sabine, 1975) 이 물질을 이용한 생물농약 개발에는 정밀한 독성시험이 진행되어야 할 것으로 판단된다. 한편, widdrol의 경우에는 독성에 대한 보고는 아직 전무한 실정이다.
본 실험을 통하여 자단향으로부터 F. graminearum의 포자 발아억제활성이 우수한 두 개의 sesquitepene계 화합물, 즉 acedrol과 widdrol을 분리, 동정하였다. 또한 두 화합물을 주요 성분으로 포함하고 있는 n-hexane 분획층으로 제조한 분말수 화제는 포장에서 밀 붉은곰팡이병에 대하여 높은 방제효과를 보인다는 사실을 발견하였다. 두 화합물 중에 α-cedrol이 더 항진균활성이 우수하였는데, 만약 자단향으로부터 원료수급이 용이하지 않을 경우 α-cedrol이 15.8% 내지 19.0% 정도를 포함하고 있는 cedar oil을 이용할 수도 있을 것으로 판단된다. 또한 본 연구에서 분리한 두 물질은 F. graminearum 외에도 다양한 식물병원성 진균에 우수한 활성을 보였으므로, 이들 식물병에도 적용이 가능한지에 대한 연구가 필요하다고 판단된다. 두 물질을 포함한 자단향 추출물을 생물농약으로 개발하기 위해서 추후에 최적원제 선발, 최적제제 개발, 다양한 식물병에 대한 약효·약해시험 및 독성시험을 수행할 예정이다.
요약
붉은곰팡이병은 주로 Fusarium graminearum에 의해 발생하며 전세계적으로 주요 곡물에 치명적인 피해를 주는 식물병이다. 관행농가에서는 일반적으로 붉은곰팡이병 방제에 합성 살균제를 사용하고 있지만 장기적인 합성살균제의 사용으로 인하여 환경 오염 문제와 인간의 건강을 위협하는 문제가 야기되었다. 때문에 천연물살균제를 포함한 친환경 생물농약 개발에 대한 관심이 고조되고 있는 실정이다. 본 연구에서는 100종의 식물추출물을 이용하여 F. graminearum에 항진균활성을 갖는 식물 추출물을 탐색하였다. 그 결과 자단 심재부인 자단향의 조추출물이 가장 강한 항진균활성을 보였으며, GC-MS 분석을 통하여 자단향으로부터 α-cedrol과 widdrol로 동정된 두 개의 항진균활성물질을 분리하였다. α-Cedrol과 widdrol의 F. graminearum 포자발아 억제활성 최소저해농도는 각각 31.25 mg/l과 62.5 mg/l였으며, 이 두 물질은 F. graminearum 이외에도 다양한 식물병원균의 균사 생육을 저해하였다. 더욱이 자단향 추출물을 분말 수화제로 제형화하여 처리한 결과, 밀 붉은 곰팡이병에 대한 방제효과는 유효성분 농도가 높을수록 효과적인 방제가를 보였으며, 250배 희석처리 시 2,000배의 상용농도로 희석한 합성살균제의 방제가(92.6%)와 통계적으로 유사한 87.2%의 병방제가를 보였다. 본 연구결과는 붉은곰팡이병 방제를 위한 효과적인 생물살균제로 자단향 추출물이 활용 가능하다는 것을 제시하고 있다.
Acknowledgement
This work was supported by the Cooperative Research Program for Agricultural Science and Technology Development (Project PJ01085601), Rural Development Administration, Republic of Korea.
References
Notes
Conflicts of Interest
The authors declare that they have no competing and commercial interests in this work.

