딸기 탄저병: 병원·생태학적 특징 및 방제
Anthracnose of Strawberry: Etiological and Ecological Characteristics, and Management
Article information
Abstract
Colletotrichum spp.에 의해 발생하는 딸기 탄저병은 전 세계적으로 문제가 되는 중요한 병해이다. 우리나라 딸기 탄저병은 1990년에 최초 보고된 이후 현재까지 재배되고 있는 대부분 딸기 품종에 발생하여 피해를 주고 있다. 현재 딸기 탄저병을 효과적으로 방제하기 위한 많은 노력과 연구들이 진행되고 있지만 지속적으로 발병되고 있어 탄저병 방제를 위한 종합적 검토가 필요한 실정이다. 본 리뷰에서는 현재까지 연구된 논문들을 기초로 탄저병에 관여하는 병원균, 잠재감염주 중요성과 진단기술, 탄저병 발생에 미치는 환경요인 및 방제 방법 등 다양한 딸기 탄저병 관리방법을 소개하였다. 본 리뷰를 통해 딸기 탄저병을 더 이해하고 최신 방제와 관련된 연구들을 살펴봄으로써 딸기 재배농가들과 연구자들이 종합한 탄저병 방제를 위해 종합적이고 효과적인 접근에 도움이 되길 기대한다.
Trans Abstract
Anthracnose caused by Colletotrichum spp. is a major disease of strawberry plants worldwide. The anthracnose of strawberries in Korea has occurred in most cultivated strawberry varieties since its first report in 1990. Although many studies and efforts have been made to control the disease, anthracnose continues to affect strawberry yields in Korea. In this review, we introduced various management methods to control anthracnose in strawberries, such as identifying pathogens and environmental factors involved in this disease, understanding the importance of latent infection, and developing diagnostic techniques and control methods. Through this review, we propose that researchers can elucidate a comprehensive and practical approach to control anthracnose by understanding this disease and developing strategies to prevent its spread, ultimately benefiting strawberry farmers.
서 론
딸기에 발생하는 탄저병은 전 세계적으로 딸기를 재배하고 있는 나라에서 가장 문제가 되고 있는 주요 병해이다. 딸기 탄저병은 주로 관부(crown)에 피해를 나타내는 관부탄저병(anthracnose crown rot, ACR)과 과실에 발생하는 과실탄저병(anthracnose fruit rot, AFR)으로 구분할 수 있다. 국내 딸기에 발생하는 탄저병은 대부분 ACR이며(Kim 등, 1992; Nam 등, 1998, 2022), AFR은 2008년 강원도 노지재배 포장에서 최초 보고된 이후 발생은 보고되지 않았다(Nam 등, 2008). ACR에 관여 하는 주요 병원균은 Colletotrichum gloeosporioides complex 이며, AFR은 C. acutatum complex이다(Mass, 1998). 딸기에 발생하는 ACR 피해는 국내에서 육묘기에 최대 30% 이상 발생되며(Kim과 Nam, 1999), AFR에 의한 피해도 미국 Florida 지역에서는 감수성품종에서 70% 이상 손실을 일으키는 중요한 병해이다(Mertely 등, 2012).
딸기에 발생하는 ACR 증상(Nam 등, 1998)은 육묘기에 감수성품종에서 자묘가 갑자기 시들며 고사하고(Fig. 1A, B) crown 을 세로로 잘라보면 바깥부분부터 안쪽으로 갈변되는 증상을 보인다(Fig. 1C). 또한 러너(runner)와 엽병은 작고 검은 반점을 형성하고 진전되면 수침상으로 움푹하게 되고 높은 습도에서 분홍색 포자덩어리를 형성하며(Fig. 1D, E), 잎에는 작은 원형의 검은 반점이 형성되고 마치 검은 먹물을 뿌린 듯한 증상을 보인 다(Fig. 2F). 반면 AFR에 의한 딸기 탄저병 증상(Nam 등, 2008; Smith, 2013)은 ACR의 러너와 엽병에서 보이는 증상과 유사하고 성숙된 과실에서는 수침 상으로 원형의 점이 형성되고 검게 되며 높은 습도조건에서는 그 위에 분홍색 포자덩어리를 형성하고(Fig. 1G), 꽃은 마르며 고사한다(Fig. 1H).

Anthracnose symptoms of strawberry plants. Anthracnose resistant (cv. Suhong) and susceptible (cv. Nyoho) cultivar of strawberry fields (A), wilted plant (B), crown (C), runner (D), petiole (E), and leaves (F) caused by Colletotrichum fructicola. Fruits (G) and flower (H) caused by C. acutatum. Photographs courtesy of Myeong Hyeon Nam.
딸기 탄저병 발생은 최근 2010년부터 2022년까지 13년간 충청남도농업기술원 딸기연구소에 탄저병 진단을 의뢰한 건수를 비교하였을 때 매년 증가추세에 있다(Fig. 2). 딸기 탄저병 진단 건수는 육묘기보다도 정식기에 높았으며, 정식기에는 9월부터 11월까지 높은 건수를 나타내었으며 10월이 가장 높았다(Fig. 3). 육묘기에는 딸기 탄저병이 4월부터 발생이 높아지기 시작하여 6월과 8월에 높은 진단 건수를 보였다. 일본의 탄저병 발생도 11월 초순이 가장 높고 10월과 8월에도 높은 발생률을 보여 국내와 비슷한 경향을 보이고 있다(Hirayama 등, 2016). 특히 일본에서 딸기 탄저병의 잠재감염률은 육묘 후기인 7월 초순이 가장 높게 나타났는데 이 시기가 장마철로 습도가 높게 형 성되기 때문이라 한다. 이처럼 육묘기에 탄저병에 감염된 딸기묘는 정식 후 30%의 수확 손실을 일으킨다(Rahman과 Louws, 2017). 또한 미국 Florida 지역에 발생하는 AFR에 의한 탄저병은 노지재배 수확 시기인 1월부터 3월에 가장 높은 발생률을 보이는 특징이 있다(Mertely 등, 2012).

Number of diagnosis per year requested to Strawberry Research Institute (SRI) for anthracnose of strawberry in Korea.
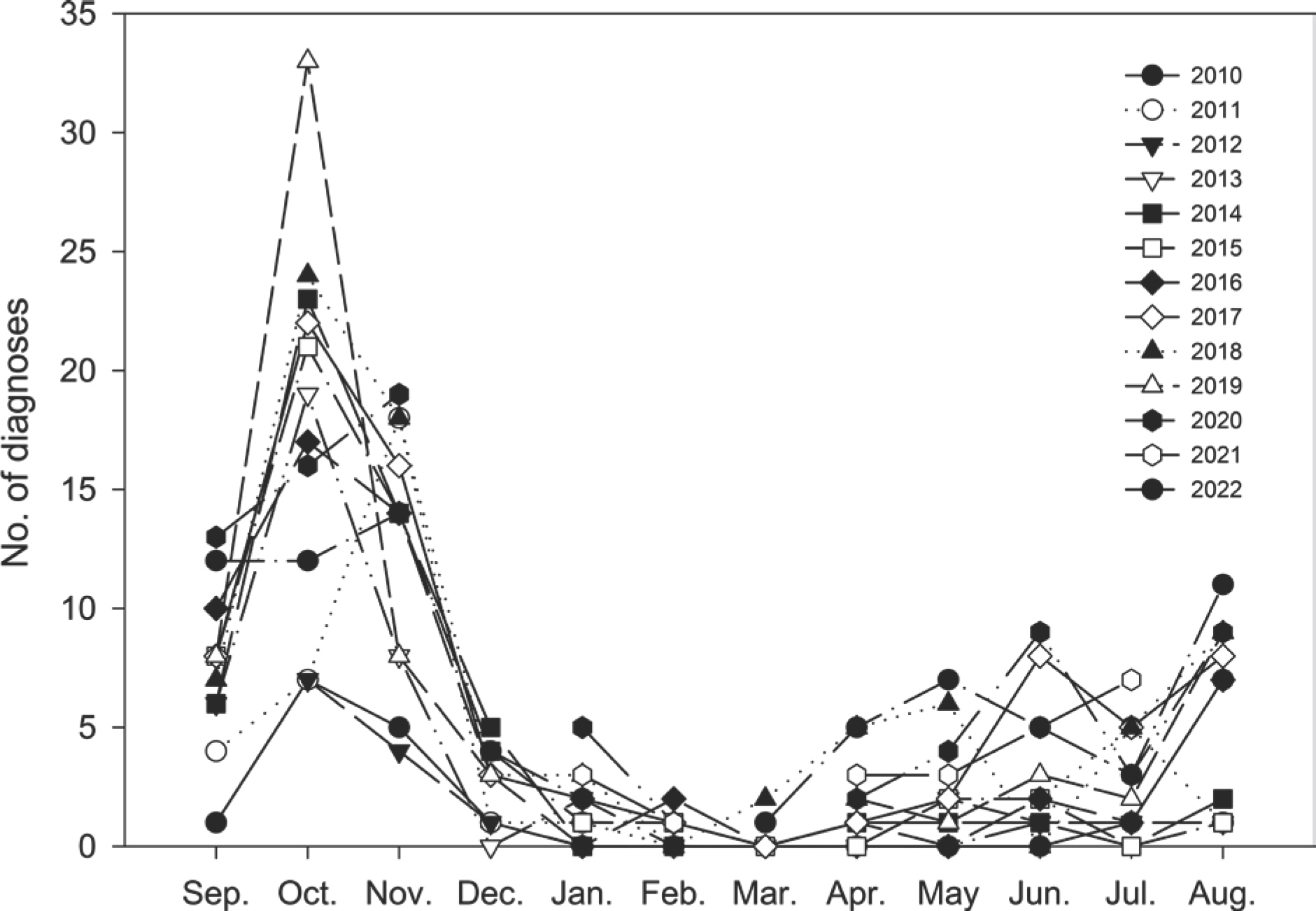
Number of diagnoses per monthly requested to Strawberry Research Institute (SRI) from 2010 to 2022 for anthracnose of strawberry in Korea.
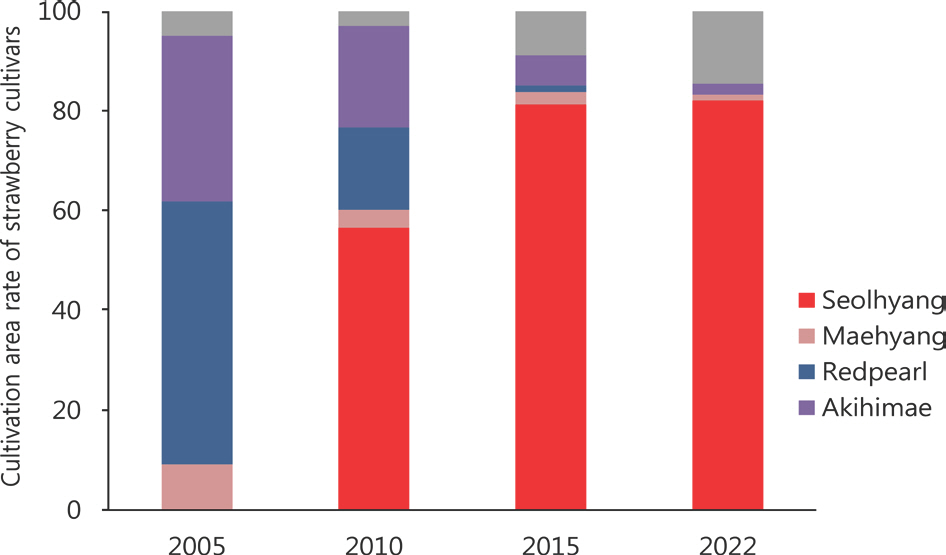
2022년 국내 딸기 재배품종은 설향 품종이 82.1%를 차지하여 2005년을 시작으로 급격히 재배면적이 증가하고 있으며 현재는 국내 대표적인 품종으로 자리매김하고 있다(Fig. 4). 그러나 설향 품종은 탄저병에 감수성으로 재배면적이 증가함에 따라 딸기연구소에 진단 의뢰 건수도 매년 증가하는 추세를 보이고 있어 단일 품종의 우점적 재배로 인한 병 발생 피해는 계속적으로 증가할 것으로 예측된다. 따라서 최근 딸기에 발생이 증가하고 있는 탄저병에 대한 효과적인 종합방제체계 구축을 위한 탄저병 원인, 병원학적 및 생태적 특징과 방제 방법 등에 대한 연구결과를 종합적으로 검토하고자 한다.
딸기 탄저병균 분류
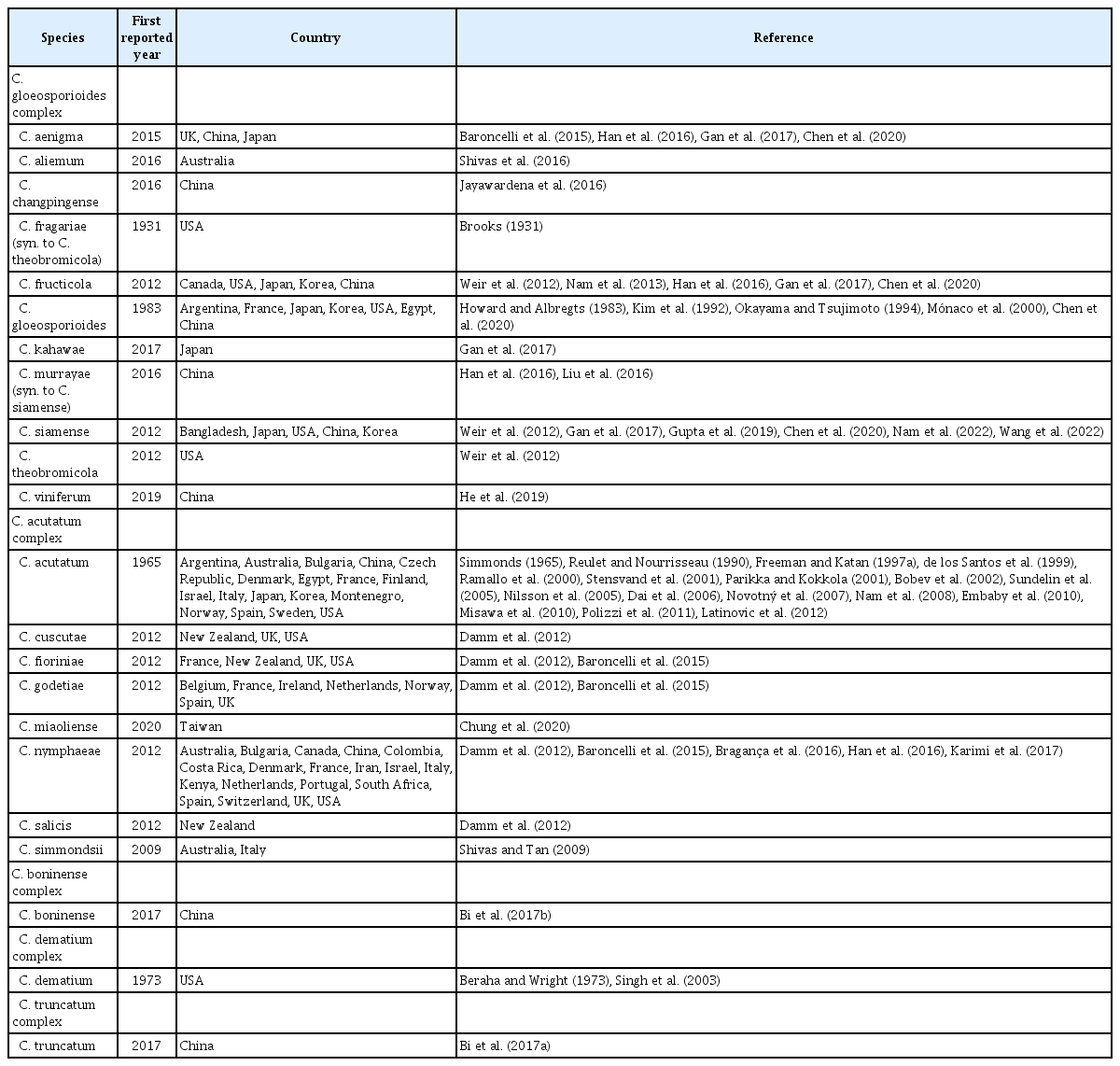
딸기에 발생하는 탄저병균은 1931년 미국에서 Brooks에 의해 C. fragariae로 세계 최초 보고되었으며 1983년 Howard와 Albregts가 C. gloeosporioides에 의한 탄저병균을 보고한 이후, 한국(Kim 등, 1992)과 일본(Okayama와 Tsujimoto, 1994) 등에서도 발견되었다. C. acutatum은 1965년 호주의 Simmonds에 의해 최초 보고되었으며, 프랑스(1990년), 미국(1992년), 이스라엘(1997년), 스페인(1999년), 아르헨티나(2000년), 노르웨이와 핀란드(2001년), 불가리아(2002년), 덴마크와 스웨덴(2005년), 중국(2006년), 체코(2007년), 한국(2008년), 이집트(2009년), 일본(2010년), 이탈리아(2011년), 몬테네그로(2012년) 등에서 발생이 보고되었다(Table 1). 그 외, 딸기 탄저병에 관여하는 병원균으로 C. dematium (Beraha와 Wright, 1973), C. boninense (Bi 등, 2017b), C. truncatum (Bi 등, 2017a) 등이 있다. 최근에는 Colletotrichum spp.균 분류에서 epitypification의 비교분석을 통해 정확한 동정이 가능하였다(Cannon 등, 2008). Type strains 의 염기서열분석은 Colletotrichum spp.균 동정과 계통학적분석에 있어서 가장 중요한 요소이다(Cai 등, 2009; Phoulivong 등, 2010). 비록 internal transcribed spacer (ITS) sequence는 C. gloeosporioides complex를 구별할 수 없지만 glyceraldehyde-3-phosphate dehydrogenase (GAPDH)와 glutamine synthetase와 같은 단일 유전자 또는 다중 유전자 조합의 DNA 염기서열 분석으로 탄저병균을 구별할 수 있다(Weir 등, 2012). 이런 DNA sequencing분석으로 딸기 탄저병에 관여하는 C. gloeosporioides complex는 기존의 C. fragariae (syn. to C. theobromicola)와 C. gloeosporioides 이외 C. aenigma, C. aliemum, C. changpingense, C. fructicola, C. murrayae (syn. to C. siamense), C. siamense, C. theobromicola, C. viniferum 등 8종이 새롭게 보고되었다(Table 1). 또한 C. acutatum complex는 C. acutatum외 C. cuscutae, C. fioriniae, C. godetiae, C. miaoliense, C. nymphaeae, C. salicis, C. simmondsii 등 7종이 보고되었다. 최근, 미국에서 딸기의 과실과 뿌리에 발생하는 탄저병균은 C. nymphaeae 와 C. fioriniae의 2종이며 C. nymphaeae가 우점종임을 보고하였다(Wang 등, 2019). 국내에서도 딸기에 관여하는 병원균은 분자생물학적 기법을 이용한 분류 방법을 통해 2013년에 C. gloeosporioides는 C. fructicola로 재분류되었으며(Nam 등, 2013), 2022년 C. siamense (Nam 등, 2022)가 추가로 보고되었다. 중국의 경우 딸기에 발생하는 주요 병원균은 C. fructicola와 C. siamense으로 그중 C. siamense가 45.9%를 차지하는 우점종이며(Ji 등, 2022) crown에 발생하는 C. siamense는 C. fructicola 보다 병원성이 강하다고 보고하였다(Zhang 등, 2022). 미국 Florida 지역에 발생하는 딸기 탄저병균도 C. siamense가 86%를 차지하며 C. theobromicola와 C. fructicola 순으로 드러났다(Oliveira 등, 2022). 또한 C. fructicola는 homothallic인 반면 C. siamense는 heterothallic으로 유전적 다양성이 높은 특징을 가지고 있다고 한다. 특히 C. siamense는 C. fructicola보다 고온성 병원균으로 기후변화로 온도가 상승하면 국내 탄저병균의 개체군(population) 변화에도 영향을 미칠 가능성이 높으며 그래서 지속적으로 탄저병균 발생 모니터링이 필요하다.
잠재감염주 중요성 및 진단기술
잠재감염
딸기 탄저병균 C. acutatum은 병징이 나타나지 않은 잠재감염상태의 딸기 잎에서 2차 분생포자와 부착기로 몇 주 혹은 몇 달간 잠재감염 상태로 남아 있을 수 있다(Leandro 등, 2001, 2003a, 2003b; Sreenivasaprasad와 Talhinhas 2005). 특히 잠재감염주의 하엽과 엽병, 엽병기부에서 감염 빈도가 높으며(Chikuo, 1994; Okayama 등, 2007), 육묘기에는 탄저병균이 잠재감염주로부터 4월부터 7월까지 노지재배나 두상관수 육묘장에서 빗물 등 물을 통하여 자묘로 전반된다(Inada 등, 2005). 딸기 과실에서 C. acutatum의 잠재감염시간은 25 ° C 에서는 2–3일, 5°C는 6–17일로 온도의 영향이 크다(King 등, 1997). 위와 같이 딸기 탄저병의 전염원으로 잠재감염주가 중요한 역할을 하며 탄저병징이 나타나기 전 잠재감염주를 진단하여 제거하는 방법이 중요한 방제수단이 되고 있다(Debode 등, 2015).
진단기술
딸기 탄저병을 진단하는 기술로 배양법, 분자생물학적 기법을 이용하는 방법 등이 개발되었다. 배양법에 의한 진단은 잠재감염 식물체를 제초제 paraquat나 냉동(Mertely와 Legard 2004; Nam 등, 2004a; PérezHernández 등, 2008), 에탄 올(Hirayama 등, 2016; Ishikawa 2003) 등의 방법으로 처리 한 후 병원균을 배양하여 진단하는 방법이다. 이런 방법은 진단하는 데 5–7일이 소요되며 잎에 형성된 분생포자퇴를 육안으로 보고 정확히 Colletotrichum spp.를 구분하기 어려운 측면이 있다. 따라서 이런 문제를 해결하고자 최근 식물병 진단의 정확성과 신속성 향상을 위해 분자생물학적 진단기술이 개발되고 있다(McCartney 등, 2003). 딸기에 발생하는 탄저병균 Colletotrichum spp.의 정확한 진단을 위한 분자생물학적 기술로 특이적 primer 들이 개발되었다(Table 2). C. gloeosporioides 진단을 위한 primer 는 1992년에 Mills 등에 의해 ITS 영역의 CgInt/ITS4 primer가 최초로 보고되었으며 그 후 βtublin 영역(Talhinhas 등, 2005; Yang 등, 2022)의 primer도 발표되었다. 최근에는 5.8S rRNA와 βtublin 영역을 이용한 loopmediated isothermal amplification (LAMP) (Katoh 등, 2016; Liu 등, 2021; Wu 등, 2019)와 polymerase chain reaction (PCR)amplified probes and microtube hybridization (MTH)를 이용한 진단 방법도 선보이고 있다(Furuta 등, 2017). 또한 C. gloeosporioides complex 내 C. fructicola와 C. fragariae를 구분할 수 있는 특이적 primer들도 연구되고 있다(Gan 등, 2017).
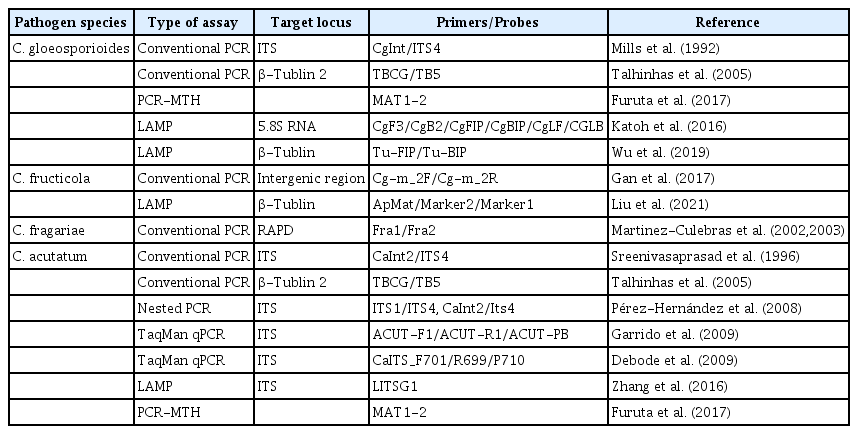
Primers for detecting Colletotrichum species isolated from strawberry plants using PCR-based diagnostics
반면 C. acutatum 특이적 primer는 1996년에 ITS 영역에서 Sreenivasaprasad 등(1996)이 최초 보고된 이후 이 primer 를 이용한 잠재감염주 진단에 이용되고 있다(Parikka와 Lemmetty, 2004). 이후 βtublin2을 이용한 conventional PCR (Talhinhas 등, 2005), TaqMan quantitative polymerase chain reaction (Debode 등, 2009; Garrido 등, 2009), LAMP (Zhang 등, 2016), PCR-MTH (Furuta 등, 2017) 등도 개발되어 탄저병 진단에 활용되고 있다.
최근 개발된 lateral flow devices로 2분 안에 딸기 조직에서 DNA를 분리하고 LAMP assay를 이용하여 딸기 탄저병을 1시간 이내 진단하는 기술도 보고되었다(Liu 등, 2021; Wu 등, 2019). 그 외, 영상이미지를 이용한 딸기 탄저병 진단은 stepwise dis-criminant analysis가 실내외 검정에서 우수하였고 k-Nearest Neighbor는 실외에서 잠재감염잎을 구분하는 데 효과적이라 하였다(Lu 등, 2017). 또한, gas chromatography-mass spec-trometry (GC-MS)와 chemometric를 이용한 탄저병균 감염 시 발생하는 대사물질(Dai 등, 2019)을 이용한 딸기 재배포장에서의 탄저병 검출 기술도 최근에 새롭게 연구되고 있는 분야이다.
딸기 탄저병의 전염원
식물병 방제에서 가장 효과적인 방제 방법 중 하나는 전염원을 제거하는 것으로 딸기 탄저병의 1차 전염원은 이병 잔재물과 잠재감염주(McInnes 등, 1992), 딸기 재배 포장 근처의 잡초, 다른 작물 등이 있다.
이병 잔재물
건전한 딸기묘는 토양에 C. fragariae에 감염된 딸기 식물체가 있으면 탄저병이 발생되지만 토양에서는 이 균이 생존하지 않는다고 하였다(Horn과 Carver, 1968). 또한 C. acutatum은 미국 Ohio주에서 감염된 토양과 딸기 과실에서 월동하지만(Eastburn과 Gubler, 1990; Wilson 등, 1992), C. gloeosporioides는 이병 식물체에서 월동할 수 있다. 분생포자는 토양에서 10일 이내 개체군의 40%까지 감소하며 생존율은 온도가 낮고 건조한 조건일수록 높았지만(Feil 등, 2003; Freeman 등, 2002; Nam 등, 2004b), 딸기의 crown 조직에서는 월하(oversummer)하지 못한다고 하였다(Ureña-Padilla 등, 2001). 따라서 딸기 탄저병의 전염원으로써 이병 잔재물은 중요한 역할을 할 것으로 보인다.
잡초.
딸기 재배포장 근처의 잡초도 딸기 탄저병의 전염원이 된다. 딸기 탄저병균 C. fructicola는 바랭이, 털별꽃아재비, 양미역취, 개망초, 방가지똥 등의 잡초에서 발견되었으며, C. acutatum은 딸기 재배 포장 근처 나비나물속과 망초속 잡초에서 colonizing가 보고되었다(Hirayama 등, 2018).
타기주
딸기 탄저병균 C. acutatum은 다른 작물인 토마토, 고추, 가지 잎과 같은 작물에서 3달동안 생존할 수 있으며(Freeman 등, 2001), 국내 딸기 탄저병균 C. gloeosporioides는 감, 대추, 사과, 고추에 병원성이 있으며(Kim 등, 2004), 일본에서는 누에콩, 완두콩, cyclamen의 잎과 사과, 아보카도의 과실에 병원성이 보고되었고, 미국에 발생하는 탄저병균은 딸기 재배 포장 근처 야생식물들에서도 발견되었다(MacKenzie 등, 2007; Xiao 등, 2004). 반면 C. fragariae는 딸기보다는 대추야자(silver date palm)와 cyclamen과 같은 식물에 발생하는 병원균이라 하였다(MacKenzie 등, 2008). 따라서 딸기 탄저병을 일으키는 병원균의 종(species)에 따라 딸기 외 다른 작물의 기주 범위가 달라 정확한 탄저병균 분류가 중요하다고 생각된다.
딸기 탄저병 발생에 미치는 요인
환경조건
딸기 탄저병 발달은 환경요인에 의해 상당한 영향을 받는다(Peres 등, 2005). C. acutatum에 의한 딸기 탄저병은 15–30 ° C에서 발달할 수 있고 최적 온도는 25 ° C이나, 탄저병 발달에 온도의 영향은 leaf wetness와의 상호작용에 의존한다(Wilson 등, 1990). 21–33 ° C에서 탄저병균의 포자 발아는 4시간 혹은 이상의 leaf wetness가 요구된다(Leandro 등, 2003a). 또 한 딸기 과실에 C. acutatum 감염의 최적 조건은 25–30 ° C에서 13시간의 leaf wetness가 유지될 때이다(Wilson 등, 1990). 미국의 Florida에서는 leaf wetness 시간을 24시간 계속 유지하는 것보다 중간에 건조시간을 6시간 혹은 그 이상 유지할 경우 탄저병 발생은 급감한다고 하였다(Forcelini 등, 2017). 습실 처리시간이나 습도 유지시간은 딸기 탄저병 발생과 밀접한 관련이 있는데 Delp와 Milhalland (1980)에 의하면 C. fragariae 경우 탄저병 발생에 미치는 습실 처리시간은 48시간 이상이며, 저항성 품종도 100% 포화습도를 72시간 이상 유지시켰을 때 감염한다고 하였다.
딸기 탄저병의 2차 전염은 비 오는 동안 빗물에 의해 발생한다(Inada와 Furuta, 2011; Mass, 1998; Ntahimpera 등, 1997, 1999). 빗물에 의한 탄저병 발생은 비의 세기와 지속시간이 관련된다(Madden과 Boudreau, 1997; Madden 등, 1996). 노지재배에서 많은 비는 과실로부터 병원균을 씻어내는 효과로 중간 정도의 비보다 탄저병 발생을 줄일 수 있지만, 빗물에 의한 탄저병 발생은 딸기묘의 재식거리가 넓을수록 감소하였다(Boudreau와 Madden, 1995). 반면, 노지재배에서는 볏짚을 피복한 포장이 미피복 포장보다 탄저병 발생은 감소하였다(Madden 등, 1993). Yang 등(1990a, 1990b, 1992)은 포자가 점액질로 둘러싸인 탄저병균은 전반거리가 멀지 않으며 C. acutatum 분생포자의 경우 전염원으로부터 30 cm까지 전반될 수 있다고 한다.
영양원
식물의 병은 식물이 필요로 하는 영양원에 따라 병 발생 정도의 차이가 나타난다(Marschner, 1995). 이 가운데 질소는 병 발생과 밀접한 관련이 있어 질소 형태에 따라 발병 정도가 다양하다는 점이 Huber와 Watson (1974)에 의해 밝혀졌다. 특히 딸기에 발생하는 탄저병은 영양원인 질소와 칼륨 농도가 증가할수록 증가하는 경향을 보였다(Nam 등, 2006; Smith, 2009).
기타
딸기 작업 시 필연적으로 발생하는 상처도 탄저병 발생과 직결되는데 딸기 육묘 과정 중 러너 절단 작업 후 상처가 난 러너를 통하여 crown 부위까지 침입하여 묘 고사를 일으키고(Kim 등, 2002b, 2002c), 과도한 하엽 제거, 정식 때 뿌리 다듬기 등에 의해 병 발생이 증가한다. 또한 제초제인 paraquat와 glyphosate는 탄저병균의 균사 생육, 포자 형성과 발아, 토양의 생존력을 촉진하며 무처리 재배포장보다 탄저병 발생이 증가한다(Kao 등, 2019). 따라서 딸기 재배 포장 근처의 잡초 방제를 위해 제초제를 처리할 경우 딸기 잔재물은 철저히 제거해야 할 것이다. 그 외, 딸기 탄저병균 C. gloeosporioides는 딸기 재배 토양에 존재하는 p-coumaruc acid와 ferulic acid의 높은 농도에서 딸기 탄저병 발생을 증가시킨다(Tian 등, 2015).
딸기 탄저병 방제
재배적 방법
딸기 탄저병 방제에서 잠재감염주 제거, 저항성 품종 이용, 비가림 재배, 조직배양묘 이용, 이병잔재물 제거 등 재배적 방법은 가장 중요하며 근본적인 방제법이다(Freeman, 2008; Poling, 2008; Smith, 2008). 국내 딸기 육묘는 1995년까지 거의 대부분 노지에서 육묘했으나 탄저병에 감수성 품종인 여봉(Nyoho) 품종이 일본에서 도입됨에 따라 막대한 탄저병 피해를 보게 되었다(Nam 등, 1998). 따라서 탄저병 확산을 막기 위해 비가림육묘 방법이 도입되기 시작하여 현재는 95%이상이 비가림하우스에서 육묘가 되고 있다. 국내 딸기 육묘는 비가림하우스에서 자묘는 연결포트를 이용한 점적관수로 재배하고 있어 탄저병 발생은 예전보다 많은 감소를 가져왔지만 완전 방제에는 한계가 있는 실정이다.
딸기 탄저병은 잠재감염주가 1차 전염원으로부터 발생되므로 잠재감염주를 심지 않는 것이 가장 중요한 방제 방법이다(Calleja 등, 2013; Debode 등, 2015; Rahman 등, 2015; Sjulin, 2008). 일본에서는 딸기묘를 –2 ° C에서 150일 이상 장기냉장 처리 시 잠재감염주 발생이 감소한다고도 한다(Okayama와 Hirayama, 2013). 이는 탄저병균이 in vitro상에서 –2 ° C, 56일간 처리 시 균사가 100% 생장할 수 없기 때문이라 하였다. 반면 독일, 영국, 네덜란드, 벨기에 등에서는 딸기묘를 –2 ° C에서 11월말부터 1–3개월 단기 저장하거나 12월 중순부터 3–9개월 장기 저장하여 보관한다(Lieten 등, 2005). 그러나 이런 방식으로 딸기묘를 장단기 저장할 경우 탄저병 발생을 경감시킬 수 있다는 결과는 아직 국내에는 없는 상황이다. 따라서 잠재감염주 방제를 위해 육묘용 모주를 –2 ° C에서 5개월간 저장할 경우 탄저병 방제 효과 여부에 대한 검토가 필요한 것으로 보인다.
국내 재배되고 있는 딸기 품종의 탄저병 저항성 정도는 육보(Redpearl) 품종을 제외하고 대부분의 품종이 탄저병에 감수성을 보였다(data not shown). 특히 최근 개발된 써니베리, 두리향, 하이베리 품종 등은 설향 품종보다 탄저병에 약한 특성을 보여 이들 품종은 재배현장에서 탄저병 방제에 철저를 기해야 할 것이다. 반면 딸기연구소에서 개발된 탄저병 저항성 품종인 NS9호(Kim 등, 2017)는 새로운 품종 개발 시 교배모본으로 좋은 자원이 될 것이다.
탄저병 발생을 감소할 수 있는 방법으로 육묘기에 자묘용상토로서의 왕겨는 마사나 혼합상토보다 탄저병 이병율을 낮출 수 있었다(Park 등, 2016). 그 외, 점적호스(Daugovish 등, 2012), 친수성 부직포를 이용한 관수방법(Yonemoto 등, 2008) 등도 탄저병 발생을 줄일 수 있다고 한다.
물리적 방법
딸기 탄저병에 잠재감염된 묘를 열처리로 방제하는 방법도 연구가 진행되고 있다. John 등(2006)은 딸기 탄저병균 C. acutatum에 감염된 자묘를 35 ° C, 7분 처리 후 50 ° C에서 3분 온탕처리시 탄저병 발생을 감소시킬 수 있다고 하였다. 또한 딸기 탄저병에 감염된 딸기묘를 49 ° C 물에 5분간 처리해도 75% 정도 높은 탄저병 방제효과가 보고되었지만 식물체 활력을 저하시킬 수 있어(Freeman 등, 1997b) 광범위하게 사용되지 않고 있다.
생물적 방법
길항미생물을 이용한 딸기 탄저병 방제방법은 중복기생균인 Trichoderma harzianum (Freeman 등, 2004), 유도저항성을 형성하는 비병원성 C. fragariae M23 (Chalfoun 등, 2011), 딸기 근관부에서 분리한 Talaromyces flavus SAY-Y-94-01 (Ishikawa, 2013), 딸기 잎에서 분리한 Bacillus velezensis NSB-1 (Nam 등, 2014a) 등이 개발되었다. 이 중 Bacillus velezensis NSB-1는 국내에서 새시대, 딸기탄탄으로, Talaromyces flavus SAY-Y-94-01는 일본에서 biotrust WP로 상용화되어 딸기 재배포장에서 사용되고 있다. 최근에는 미국 California 지역에 발생하는 quinoneoutside inhibitor (QoI)계 살균제에 저항성을 보이는 C. acutatum균에 대해 pimaricin으로 알려진 Streptomyces spp.에서 추출한 natamycin은 딸기묘 정식 전 약제에 침지시 방제효과가 보고되었다(Haack 등, 2018). Natamycin은 미국에서 버섯재배상에 발생하는 Verticillium fungicola var. fungicola에 의한 bubble병과 stone fruit과 citrus의 수확 후 관리를 위해 biopesticide로 등록된 약제이다.
Thyme과 cinnamon bark오일은 딸기 탄저병균에 대해 in vitro와 in vivo에서 효과적인 억제효과를 보유하여 방제제로의 가능성이 보고되었다(Duduk 등, 2015). 또한 꿀풀과 식물인 lemon balm과 oregano추출물에서 각각 rosmarinic acid와 luteolin 성분 및 apigenin과 protocatechuic acid 성분이 딸기 탄저병 억제효과가 있음이 보고되었다(Ahmad와 Matsubara, 2020).
그 외, 식물의 생장과 발달에 필수적인 brassinosteroid도 딸기 식물체의 면역 활성화에 영향을 미쳐 새로운 방제 전략으로 사용될 수 있다(Furio 등, 2019).
화학적 방법
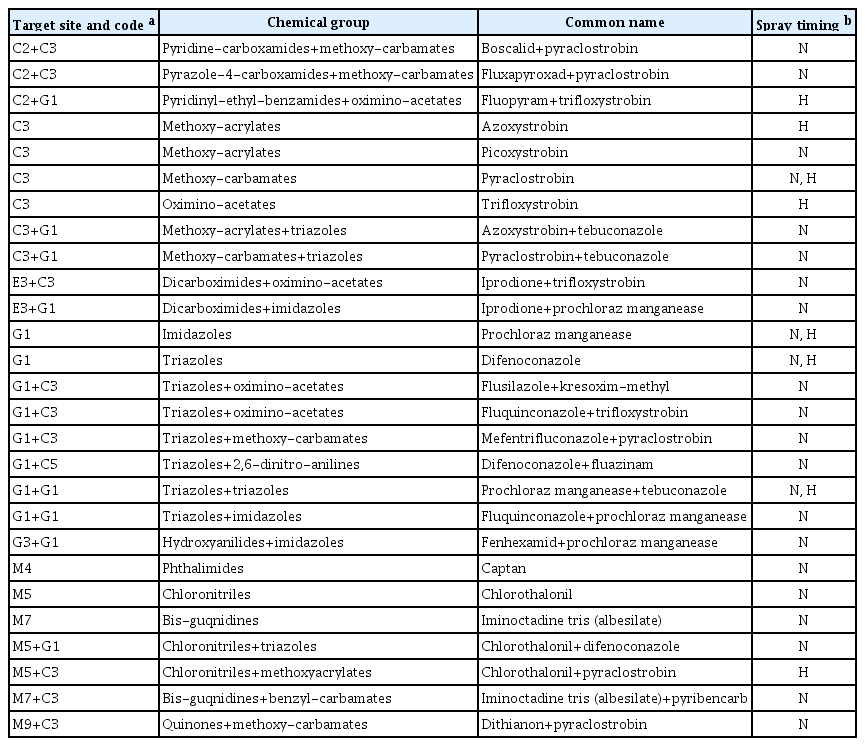
딸기 탄저병 방제를 위한 살균제는 chloroni-trile, imidazole, methoxyacrylates, triazole그룹에 속하는 약제들이 육묘기와 수확기로 구분하여 27여종이 국내에 등록되어 있다(Table 3). 딸기 탄저병 방제를 위해 주로 사용되고 있는 살균제는 azoxystrobin (Kim 등, 2002a; MacKenzie 등, 2009), pyraclotrobin (MacKenzie 등, 2009), iminoctadine (Nam 등, 2011), thiophanatemethyl (MacKenzie 등, 2009), metconazole (Nam 등, 2011), prochloraz (Freeman 등, 1997b; Nam 등, 2011), benzimidazolecarbamic acid (Akhter 등, 2009) 등이 보고되었다. 미국 Florida에서는 일반적으로 딸기 탄저병을 예방적으로 방제하기 위해 captan을 주로 살포하며, 일단 병원균이 감염되면 QoI 살균제를 다작용점 저해 살균제와 함께 처리하여 방제하고 있다(Mertely 등, 2012). 국내 딸기 탄저병 방제 용으로 등록된 chlorothalonil는 미국의 딸기 탄저병 방제에는 효과가 미미하다고 하였다(Daugovish 등, 2009; Haack 등, 2018). 최근에는 succinate-dehydrogenase-inhibitor 살균제인 fluopyram, isofetamid, penthiopyrad, fluxapyroxad, benzovindiflupyr의 딸기 탄저병균 C. gloeosporioides와 C. acutaum 에 대한 방제효과를 조사한 결과 benzovindiflupyr가 가장 효과적이었고(Ishii 등, 2022), fluazinam도 효과적이었다(Oliveira 등, 2020; Rebello 등, 2022).
딸기 탄저병 방제를 위해 엽면 살포 외 딸기묘를 정식 전 azoxystrobin (Daugovish 등, 2009; Kim 등, 2002a; Nam 등, 2014b), carbendazim, bitertanole, thiabendazole (Paredes와 Muñoz, 2002), prochloraz-Mn (Nam 등, 2014b) 침지 시 효과적으로 잠재감염주를 방제할 수 있다고 하였다. 특히, 미국 Cali-fornia에서는 정식 전 딸기묘를 azoxystrobin과 fludioxonilcyprodinil에 침지처리하는 방법이 광범위하게 사용되고 있다(Daugovish 등, 2009; Haack 등, 2018). Prochloraz 경우 침지 시간을 1시간 이상 처리할 경우 생육을 억제하는 경향이 있어 주의해야 한다. 또한 일본에서는 탄저병균 감염배양토에 diethofencarb∙ thiophanatemethyl을 관주처리 시 방제효과가 있었다(Okayama와 Hirayama, 2011).
딸기 탄저병 방제로 미국에서 광범위하게 사용되었던 benomyl과 captan에 대한 약제 저항성균 출현과 그로 인한 약효 저하 현상이 보고되었다(Freeman 등, 1997b; Inada 등, 2009; Kim 등, 2007; Nam 등, 2011; Okayama 등, 2007). 2013년 미국 Florida의 딸기에서 분리한 C. acutatum은 QoI계 살균제에 대해 저항성이 보고되었으며(Forcelini 등, 2016, 2018a, 2018b), cytb의 G143A와 F129L 변이가 높거나 중도저항성수준에 관여한다는 것이 밝혀졌다. 또한 2008년 일본의 딸기에 발생하는 C. gloeosporiodies균이 azoxystrobin에 저항성을 보인다고 하였다(Inada 등, 2008). 중국에 발생하는 딸기 탄저병균 C. siamense는 prochloraz에 더 감수성을 보이지만 C. fracticola는 defenoconazole과 tebuconazole에 더 감수성을 보인다고 하였다(Zhang 등, 2020). Carbendazim의 경우에도 중국에서는 C. fructicola와 C. siamense에 대해 저항성을 보여 사용을 자제해야 한다고 하였다(Zhong 등, 2021).
딸기 탄저병균에 대한 살균제 저항성 검정 방법으론 희석평판법(Inada 등, 2010), 선택 배지 이용(Okayama 등, 2007), microtiter assay를 이용한 방법(Smith 등, 2013), 딸기 잎을 살균제 처리 후 탄저병균 포자현탁액을 접종하여 병반 길이를 측정하는 생물검정법(Higuchi와 Omatsu, 2014)과 LAMP를 이용한 QoI저항성 탄저병균을 검출하는 기술(Wu 등, 2019) 등이 새롭게 개발되어 적용되고 있다.
딸기 육묘기 탄저병방제를 위한 방제력은 국내 등록된 살균제를 4월 초중순, 5월 상순, 6월 중하순, 7–8월 상중순 처리 시 효과적으로 방제할 수 있었다(Nam 등, 2011, 2015). 그러나 이런 방제력은 환경조건에 따라 기대하지 않는 시기에 발생할 수 있다. 그래서 살균제 처리 시기가 효과 면에서 상당히 중요한 부분을 차지하고 있다. 살균제의 작용 기작 계통에 따라 예방적, 치료적 방제효과에 차이가 있으며 pyraclostrobin은 다른 strobilurin계 살균제와 다르게 탄저병균 감염 전과 후 모두 탄저병 방제효과가 보고되었다(Turechek 등, 2006).
최근에는 leaf wetness와 온도를 이용한 탄저병 예측방제시스템도 개발되어 딸기재배 포장에서 사용되고 있다(Cordova 등, 2017; MacKenzie와 Peres, 2012; Peres 등, 2010; Zhang 등, 2019). 이 시스템은 온도와 leaf wetness조건으로 탄저병 발생 모델(Wilson 등, 1990)의 threshold를 설정하여 방제하는 Strawberry Advisory System (Pavan 등, 2011)을 개발하였으나 식물체, 품종 간 저항성 정도, 초기 감염원농도는 고려되지 않아 이에 대한 연구가 필요하다.
살균제외 미산성수는 탄저병 방제를 위해 두상 관수할 경우 효과적인데 염소 농도는 10 ppm으로 10일 간격처리하고 살균제와 혼용도 가능하다고 한다(Hirayama 등, 2016).
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.