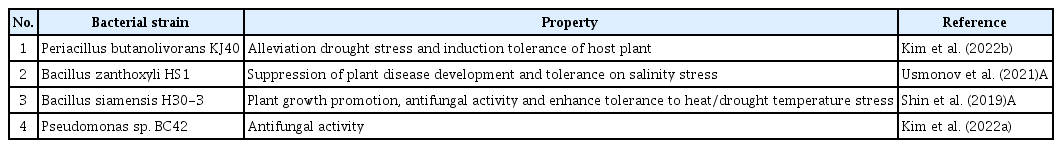
Peribacillus butanolivorans KJ40, Bacillus zanthoxyli HS1, B. siamensis H30-3와 Pseudomonas sp. BC42에 의한 오이 탄저병, 박과류 과실썩음병과 오이 덩굴쪼김병의 생물방제 효과검정
Biocontrol Activities of Peribacillus butanolivorans KJ40, Bacillus zanthoxyli HS1, B. siamensis H30-3 and Pseudomonas sp. BC42 on Anthracnose, Bacterial Fruit Blotch and Fusarium Wilt of Cucumber Plants
Article information
Abstract
식물병 또는 비생물적 스트레스를 감소시키는 것으로 보고된 세균 4종(HS1, H30-3, KJ40 와 BC42)이 Colletotrichum orbiculare 에 의한 오이 탄저병, Acidovorax citrulli에 의한 과실썩음병, Fusarium oxysporum에 의한 오이 덩굴쪼김병에 대한 병 억제 효과가 있는지 검정하였다. HS1, H30-3, KJ40 와 BC42를 토양에 관주처리 할 경우 유도저항성에 의해 오이 탄저병이 감소하였고, KJ40와 BC42는 A. citrulli의 발병을, BC42는 오이 덩굴쪼김병을 억제하였다. 따라서, KJ40은 건조피해 저감뿐만 아니라 유도저항성에 의한 오이 탄저병 억제 및 A. citrulli에 의한 병발생 감소효과를 가지며, BC42는 오이 탄저병, A. citrulli와 F. oxysporum에 병을 모두 억제하는 것으로 보아 넓은 범위의 적용 범위를 갖는 생물적 방제제 자원으로 활용할 수 있을 것이다.
Trans Abstract
Abiotic and biotic stresses have been a serious threat to crop growth and productivity in the agricultural system. In this study, four strains (HS1, H30-3, KJ40, and BC42), which have biological activities related to disease suppression or alleviation of salinity and drought stresses, were tested for broad-spectrum biocontrol activity against anthracnose caused by Colletotrichum orbiculare, a bacterial fruit blotch caused by Acidovorax citrulli, and Fusarium wilt caused by Fusarium oxysporum in cucumber plants. As a result of test, when the four strains were drenched into the soil, anthracnose in cucumber leaves significantly decrease; strain KJ40 suppressed disease incidence by A. citrulli; strain BC42 significantly reduced bacterial fruit blotch and Fusarium wilt compared to control. Therefore, strain KJ40 could be a biocontrol candidate for controlling anthracnose through induced systemic resistance and the disease caused by A. citrulli as well as alleviating drought stress; strain BC42 has broad-spectrum biocontrol activity against anthracnose, Fusarium wilt, and bacterial fruit blotch.
오이는 국내에서 생산되는 과채류 중 고소득 채소 중 하나로 주로 시설재배되며, 2022년에는 오이 재배면적은 4,121 ha 으로, 생산량은 283,933톤으로 보고되었다(Korean Statistical Information Service, 2022). 오이는 반촉성, 촉성 재배 등 시설하우스 내에서 연중 연속적으로 재배되고 있으며, 이에 따라 토양에 염류집적 및 병해충 발생이 증가하는 등 다양한 장해가 발생하게 되었다(Park 등, 1996). 연작에 따른 시설재배 박과류 재배 시 문제가 되는 주요 병해로는 오이 덩굴쪼김병, 오이 탄저병과 박과류 과실썩음병 등이 보고되었다(Park 등, 1996; Song 등, 2015).
오이 탄저병은 Colletotrichum orbiculare에 의해 지상부에 발생하는 병으로 부착기를 형성하여 기주내로 침입하는 것이 특징이다(Agrios, 2005; Kwak 등 2021; Lee 등 2016). Acidovorax citrulli는 박과류에 과실썩음병을 유발하는 세균성 병원균으로, 종자나 포장에 남아있던 식물체 잔재물에 잠복하다 다음 해 발생할 우려가 있다. 수박을 비롯한 박과 작물의 과실 생산에 피해를 주고 있으며, 국내 A. citrulli 집단은 종 특이적이며 KCC1과 KCC2 두 그룹으로 나뉘어져 있는 것으로 보고되었다(Latin과 Rane, 1990; Lessl 등, 2007; Song 등, 2015). 오이 덩굴쪼김병은 Fusarium oxysporum f. sp. cucumerinum에 의해 발병하며 시설재배 연작지에서 피해가 크며 생산량에 영향을 끼친다고 보고되었다(Lee 등, 2014; Park 등, 2019).
상기 언급한 병원균에 의한 생물적 요인 외에 고염, 건조, 저온과 같은 비생물적 스트레스는 작물의 재배 환경 및 발육상태에 영향을 끼치며, 작물의 생육 및 수확량에 큰 영향을 미친다(Mahajan과 Tuteja, 2005). 작물은 프롤린 축적, 호르몬을 통한 신호전달, 항산화효소 활성증가, 관련 유전자발현 등과 같은 체내의 생화학적 변화를 통해 여러 스트레스에 대한 내성을 발달시킨다(Gill과 Tuteja, 2010; Gomes 등, 2010). 스트레스에 대한 식물의 저항성을 증진 시키는 것은 생산성을 높이고 친환경적인 농업에 있어 중요한 요소 중 하나이며(Zhu, 2016), 이를 위해 식물생장촉진세균의 적용, 호르몬 처리 등 다양한 연구들이 진행되고 있다(Kim과 Song, 2016; Yoo 등, 2018). Nam 등(2006)은 저온 장해를 입기 전 오이 유묘에 abscisic acid를 토양에 처리함에 따라 저온장해가 경감되는 효과가 있다고 보고하였으며, Qi 등(2021)과 Kaloterakis 등(2021)은 Bacillus sp.를 오이 유묘단계에서 관주함에 따라 식물생장촉진효과와 염해 스트레스 완화 효과가 있다고 보고하였다.
이와 같이 오이의 재배기간 동안 다양한 병과 비생물적 스트레스에 의한 장해가 발생하며, 이를 지속가능하게 관리하기 위해 넓은 스펙트럼을 가지는 미생물을 활용하는 방안이 연구되고 있다(Ali 등 2020; Park 등, 2012; Yang 등, 2014). 따라서, 본 연구에서는 식물에 병억제 또는 비생물적 스트레스를 저감하는 기선발 미생물이 오이의 지상부에 발생하는 오이 탄저병, 토양병인 오이 덩굴쪼김병과 토양세균병인 박과류 과실썩음병에 대해 병 억제 효과가 있는지 탐색하고 생물적 방제제로서의 사용 가능성을 알아보고자 하였다.
본 연구에서는 작물의 비생물적 스트레스에 의한 장해를 경감시키는 기선발 미생물 Peribacillus butanolivorans KJ40 (Kim 등, 2022b), Bacillus zanthoxyli HS1 (Usmonov 등, 2021), B. siamensis H30-3 (Shin 등, 2019)과, 오이 탄저병원균을 직접적으로 억제하는 Pseudomonas sp. BC42 (Kim 등, 2022a) (Table 1)를 관주처리하여, C. orbiculare, A. citrulli, F. oxysporum f. sp. cucumerinum에 의한 병을 억제하는 효과를 검정하였다. 유묘검정을 위해 조은백다다기(Famhannong, Seoul, Korea) 종자를 원예용 상토(Baroker, Seoul Bio, Korea)에 파종하여 사용하였고 온실 조건(25±5° C)에서 재배하였다. 오이 유묘에서 오이 탄저병에 대한 Induced systemic resistance의 가능성을 확인하기 위하여, 기선발 미생물은 tryptic soy broth에서 28° C, 160 rpm에서 48시간 동안 배양되었고, 6,000 rpm, 20분 동안 원심분리하여 cell pellet을 수확하였다. 이 후 멸균한 10 mM MgSO4 용액으로 재희석하였고, cell pellet을 OD600=0.2 농도로 맞추어 세균현탁액을 준비하였다. 1엽이 전개되기 시작한 오이 유묘에 세균 현탁액 10 ml을 관주하였고, negative control로 동량의 10 mM MgSO4 용액, positive control로 1 mM 2,1,3-benzothiadiazole을 사용하였다. 관주 7일 후, C. orbiculare의 분생포자를 1.0×106 conidia/ml 농도로 맞추고 Tween 20 0.01%를 첨가하여 오이 1엽에 분무 접종하였다. 병원균 접종 후 dew chamber에서 상대습도 100%, 28° C 온도조건으로 24시간 동안 유지한 후 온실로 옮겨 7일 후 병반 수를 계산하였다. 그 결과, KJ40 균주를 관주하였을 때 오이 탄저병 병반의 발생 억제율은 50.9%, HS1 균주는 46.9%, H30-3는 30.6%, BC42 균주는 30.6%로 처리한 모든 균주에서 유도저항성에 의해 병반 수가 감소되었다(Fig. 1).
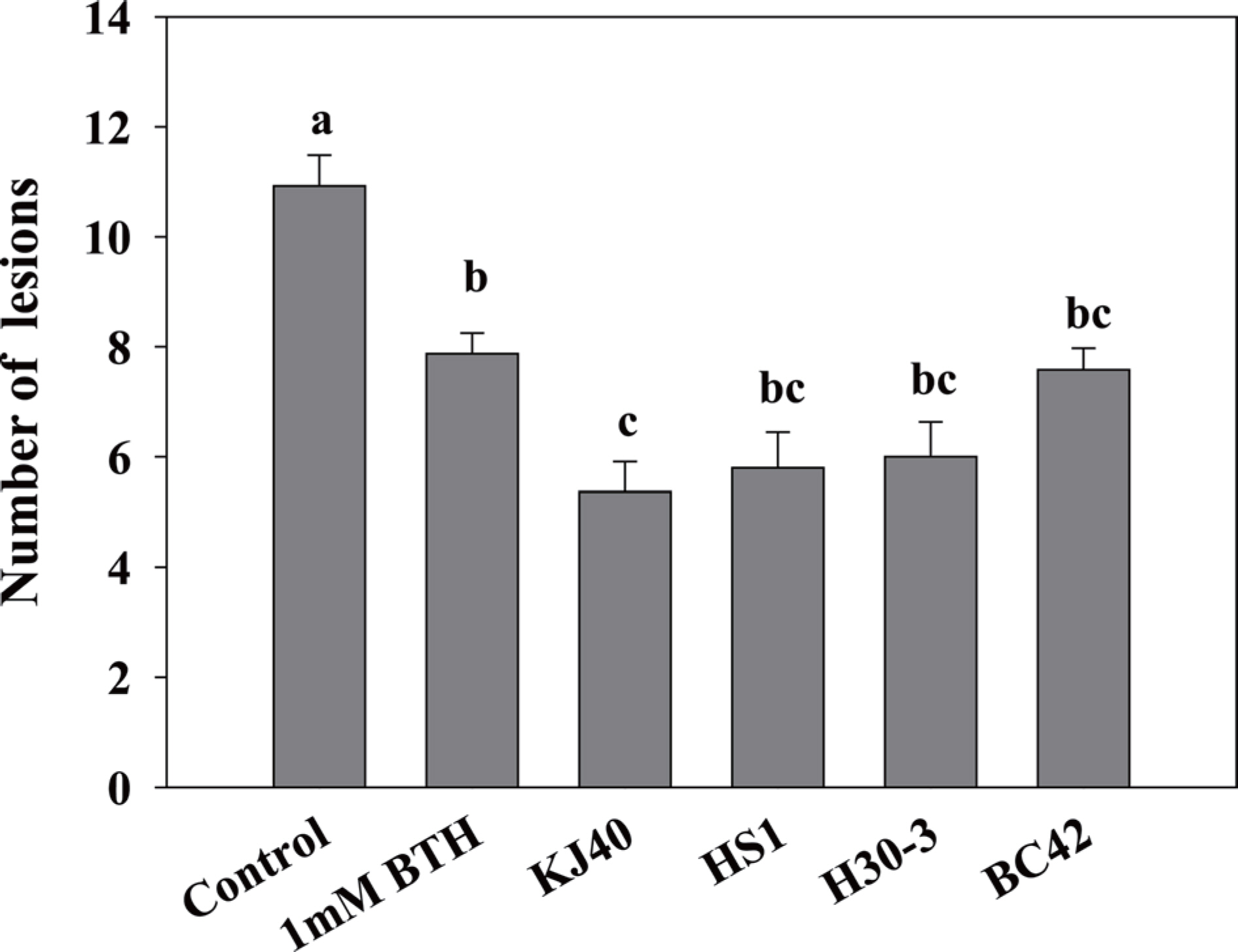
The number of lesions of anthracnose seven days after bacterial drench treatment. The error bar means standard error and the small letter on each bar indicates statistical difference by Tukey honestly significant difference at P<0.05.
병원균 A. citrulli (KACC no. 17001)는 국립농업과학원 농업유전자원센터에서 분양받았으며, 접종 방법은 Adhikari 등(2017)의 방법을 적용하였다. 병원균은 28° C에서 160 rpm으로 48시간 액체배양 후, 13,000 rpm으로 10분간 원심분리하여 cell pellet을 수확하였다. 수확한 cell은 10 mM MgSO4로 현탁액 농도를 OD600=0.5로 맞추어 사용하였다. 파종 7일 후 오이 유묘에서 1 cm 간격, 2 cm 깊이로 4곳에 구멍을 낸 후, 병원균 현탁액을 10 ml씩 접종하였다. 병원균 접종 5일 후, 시험할 기선발 균주를 OD600=0.2로 맞추어 10 ml씩 관주하였다. 대조구(negative control)로 10 mM MgSO4, 살세균제 대조구로 oxytetracy-cline calcium alkeyltrimethylammonium·validamycin A 수화제를 2,000배로 희석하여 사용하였다. 병 접종 14일 후 식물체에서 수침상 병반이 나타나는 것으로 발병도를 조사하였다. 그 결과, 대조구는 42.2%, 살세균제 대조구는 36.7%, KJ40 17.8%, HS1는 26.7%, H30-3은 38.9%, BC42는 22.2%가 병이 발생하였으며, KJ40과 BC42 균주의 경우 대조구 대비 각각 57.9%, 47.3%가 발병이 억제하였다(Fig. 2).
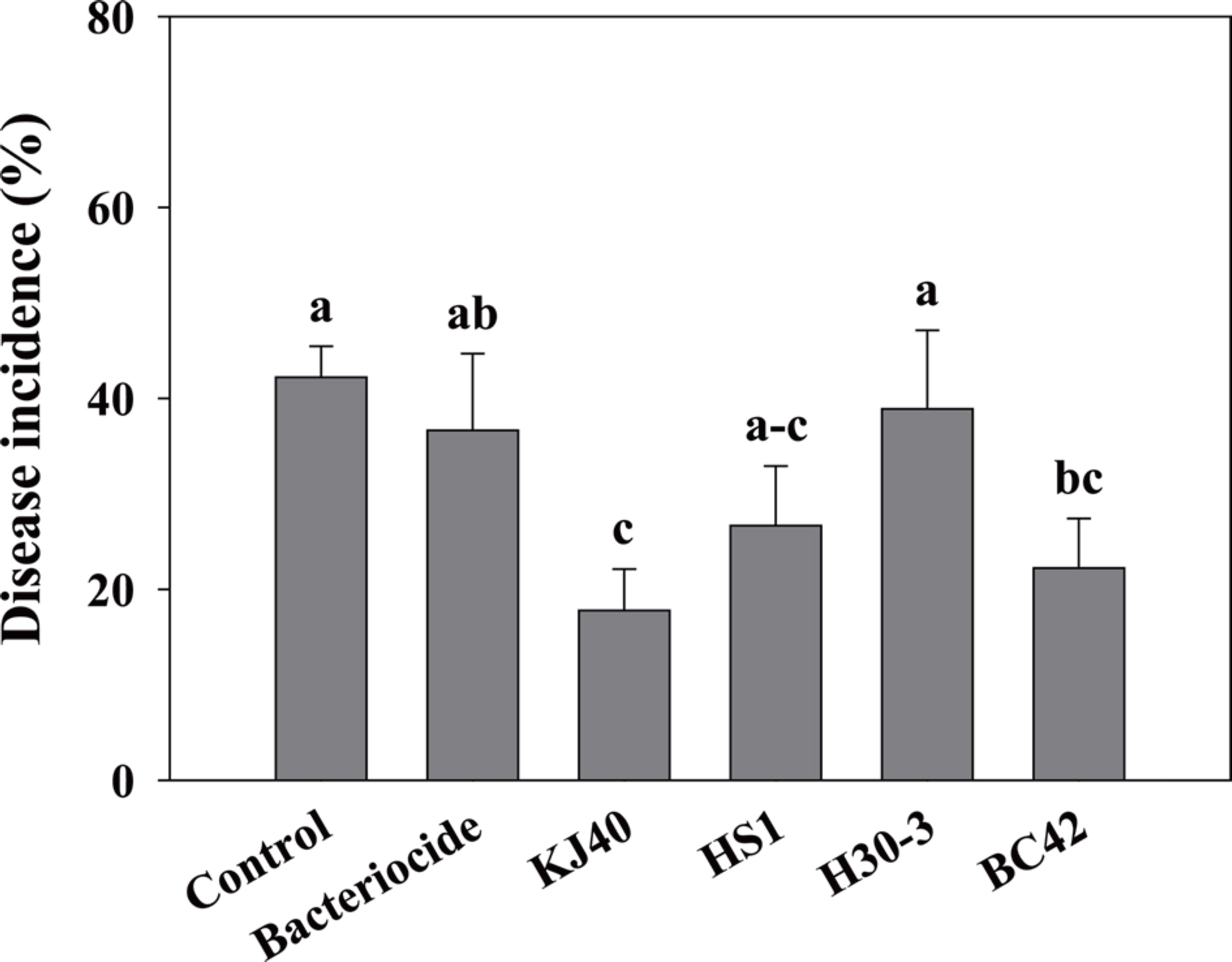
Disease incidence (%) caused by Acidovorax citrulli on cucumber seedling drenched with the bacterial suspension. The error bar means standard error and the small letter on each bar indicates statistical difference by least significant difference at P<0.05.
기선발균주의 오이 덩굴쪼김병을 억제 효과를 검정하기 위하여, 병원균 접종원은 Ndayihanzamaso 등(2022)의 방법에 따라 준비하였다. 병원균 접종원을 만들기 위해 250 g의 기장(Panicum miliaceum L.)을 121° C에서 20분간 하루 간격을 두고 두 번 고압 멸균하였다. 준비된 곡물배지에 potato dextrose agar (PDA)에서 5일 동안 배양한 병원균의 agar plug를 접종하여 28° C 배양기에서 14일간 배양하였다. 3주간 생육시킨 오이 유묘를 14 cm 플라스틱 포트에 병원균 접종원과 혼합(0.1 kg/50 l)한 토양에 이식한 후, OD600=0.2 농도의 세균현탁액을 30 ml씩 관주하였다. 대조구(negative control)로 10 mM MgSO4, F. oxysporum f. sp. chrysanthemi를 방제하기 위한 연구에서 사용한 etridiazole·thiophanate-methyl 성분의 수화제를 1,000배 희석하여 살균제 대조구로 사용하였다(Bowers와 Locke, 2000). 접종 2주 후 disease severity (0–4)를 평가하였다. 그 결과 BC42 균주를 처리할 경우 disease severity가 대조구 대비하여 유의하게 감소하였다(Fig. 3).
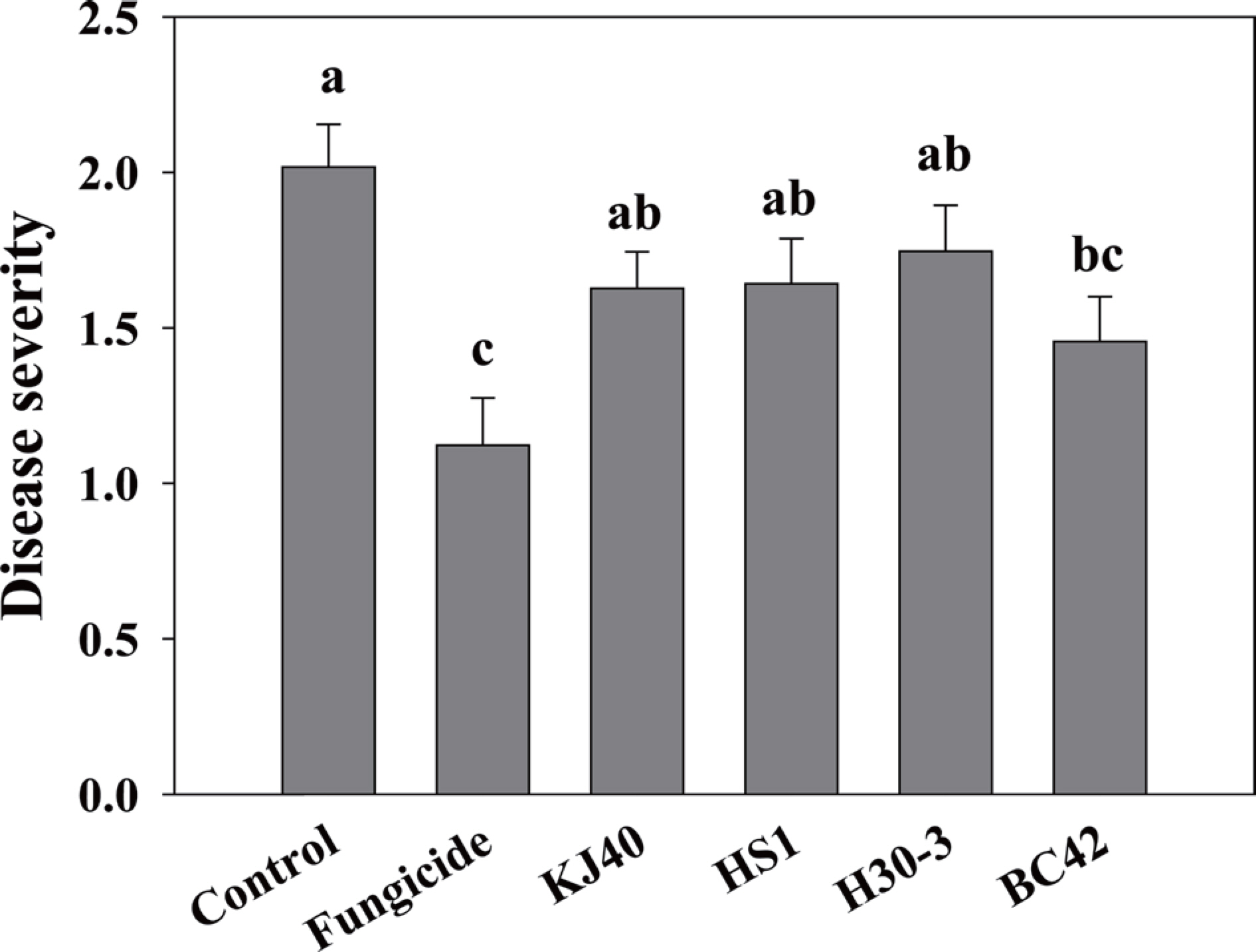
Disease severity by Fusarium wilt on cucumber seedling drenched with the bacterial suspension. The error bar means standard error and the small letter on each bar indicates statistical difference by least significant difference at P<0.05.
본 연구를 통해 KJ40, HS1, H30-3, BC42는 오이에 관주처리할 경우 모두 유도저항성에 의해 오이 탄저병을 감소시켰고, KJ40와 BC42는 A. citrulli에 의한 병 발생을 대조구 대비 억제하였다. 또한, BC42는 오이 덩굴쪼김병에 대한 disease severity를 낮추었다. KJ40은 식물이 건조 피해를 입을 경우 식물의 구성성분을 조정하며 산화적 스트레스로부터 식물을 보호하는 것으로 알려져 있는데(Kim 등, 2022b), 식물에 건조 피해를 줄이는 효과 외에 유도저항성을 통해 오이 탄저병 발생을 감소시켰으며, 토양세균병 중에 하나인 A. citrulli에 의한 피해를 감소시키는 효과도 있음을 확인하였다. BC42는 오이에 발생하는 오이 탄저병, 오이 덩굴쪼김병, 박과류 과실썩음병에 대해 억제 효과를 가지는 것으로 확인되었다. BC42는 항균활성을 가지는 균주로 BC42의 추출물을 PDA에 혼합하였을 때 균사생장은 65%, 포자형성은 85%, 부착기 형성률은 77%를 감소시키며, 식물체 잎에 살포했을 때 오이 탄저병을 감소시키는 것으로 보고되었는데(Kim 등, 2022a), BC42를 생균으로 토양에 관주할 경우에도 토양에 서식하는 병 중 하나인 F. oxysproum f. sp. cucumerinum 에 의한 오이 덩굴쪼김병도 효과적으로 억제하는 것을 알 수 있었다. 따라서, KJ40 또는 BC42에 의한 병 억제 효과는 항균활성에 의한 작용뿐만 아니라, 토양 내 정착, 병원균과의 양분 경쟁, 토양 미생물과의 상호작용 등 다양한 가능성에 의한 결과일 수 있으며, 이에 대한 연구는 추후 진행할 예정이다.
작물은 재배 기간 중에 식물병·비생물적 스트레스에 의한 피해를 모두 받기 때문에, 다양한 병을 감소시키는 효과가 있으며 식물생장촉진, 건조나 염류집적에 의한 스트레스 완화 등의 특성을 함께 가지는 미생물을 선발하여 적용하는 것이 화학농약의 사용을 저감시키고 지속가능한 농업에 기여할 수 있을 것이라 생각된다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This research was supported by a research grant (Project No. PJ01497802) from Rural Development Administration, Republic of Korea. This study was supported by 2020-2023 collaborative research program between university and Rural Development Administration, Republic of Korea.