채소 재배에서 사용하는 농용 항생제에 대한 주요 식물병원세균의 저항성 평가
Evaluation of Resistance of Phytopathogenic Bacteria to Agricultural Antibiotics
Article information
Abstract
본 연구에서는 시중에 판매되고 있는 3종의 농용 항생제를 대상으로 Pectobacterium carotovorum, Pseudomonas syringae pv. actinidiae, Clavibacter michiganensis subsp. michiganensis, C. michiganensis subsp. capsici 및 Xanthomonas arboricola pv. pruni를 포함하는 식물병원세균 91 균주에 대한 저항성을 평가하였으며 다양한 농도의 발리다마이신에이 단독성분에 의한 흡광도 측정을 통해 분광학적으로 균주 생장을 확인하였다. 주성분으로 옥시테트라사이클린과 스트렙토마이신이 합제된 농용 항생제의 경우 안전사용기준 농도의 100배에서도 모든 균주가 생장하지 않았다. 그러나 스트렙토마이신이 주성분인 농용 항생제의 경우 안전사용농도와 그 10배의 농도에서 91개 균주 중 각각 4%와 2%에서 생장하는 것으로 나타났다. 또한 발리다마이신에이의 경우에는 안전사용농도와 그 10배, 100배의 농도에서 각각 97%, 93%, 73%의 균주가 저항성을 가지는 것으로 확인되었으며 그 중에서도 특히 P. carotovorum이 발리다마이신에이에 가장 높은 저항성을 가지는 것으로 나타났다. 발리다마이신에이 단독성분을 통한 저항성을 확인한 결과, 농용 항생제 발리다마이신에이에 저항성을 가지는 균주와 가지지 않는 균주 간의 경향성은 보이지 않는 것으로 나타났다. 그러므로, 식물병원세균에서 항생제 저항성 발달을 이해하기 위한 추가적인 연구가 필요할 것으로 생각된다.
Trans Abstract
Agricultural antibiotics are widely used to inhibit the growth of phytopathogenic bacteria involved in plant diseases. However, continuous antibiotic overuse in crop production may lead to the development of antibiotic resistance in phytopathogenic bacteria. This study was conducted to evaluate the resistance to three different agricultural antibiotics (oxytetracycline+streptomycin, streptomycin, and validamycin A) in 91 strains of phytopathogenic bacteria including Pectobacterium carotovorum, Pseudomonas syringae pv. actinidiae, Clavibacter michiganensis subsp. michiganensis, C. michiganensis subsp. capsici, and Xanthomonas arboricola pv. pruni. Bacterial growth in the presence of various concentrations of validamycin A was also assessed spectrophotometrically by analyzing the optical density. All strains did not grow when the cells were exposed to oxytetracycline+streptomycin or 100× of streptomycin. However, among the 91 strains, 4% and 2% strains showed bacterial growth at the concentrations of 1× and 10× of streptomycin, respectively. Furthermore, 97%, 93%, and 73% strains were resistant to the 1×, 10×, and 100× of validamycin A, respectively, and especially, P. carotovorum contained the highest resistance to the validamycin A. Minimum bactericidal concentration values of validamycin A did not correlate with the patterns of agricultural antibiotic resistance. Further studies are needed to understand the incidence and development of antibiotic resistance in phytopathogenic bacteria.
서 론
항생제는 미생물의 성장을 억제하거나 죽이는 능력을 가진 물질로, 인간과 동물의 세균감염 치료에 널리 사용된다. 항생제의 세계 연간 생산량은 10–20억 톤으로 이러한 항생제 남용으로 인해 항생제 배출 및 환경으로의 방출 속도가 크게 증가하고 있어 항생제 저항성 균주의 증가율이 상당히 늘어난 것으로 나타났다(Serweciń ska, 2020). 따라서 항생제 저항성균의 증가가 세계적인 문제가 되고 있으며 특히 항생제 저항성으로 인한 사망자가 현재는 연간 100만 명이지만 2050년에는 전 세계적으로 항생제 저항성균으로 인해 사망하는 사람의 수가 1,000만 명에 이를 것이라는 연구 결과가 보고된 바 있어 인류의 공중 보건에 상당한 위협이 되고 있음을 알 수 있다(Dixit 등, 2019).
항생제 저항성균 발생의 가장 주요한 인자가 항생제의 오남용으로 널리 알려져 있으며, 세계보건기구(World Health Organization, WHO)에 따르면 농·축·수산업에서의 무분별한 항생제 사용이 체내 항생제 저항성 발생의 주요 원인 중 하나라고 보고하였다(Lee 등, 2019, 2022). 지난 수십 년간 농작물용에 비해 의약품, 축수산물 분야에서 항생제의 사용이 특히 높은 것으로 나타나 그동안 항생제 과다 사용 문제는 인간, 가축, 양식업 분야에서 주로 대두되어 왔으나, 최근 농작물에서도 항생제가 빈번하게 과다 사용되고 있다고 밝혀져 농산물에서도 항생제 저항성균 발생에 대한 우려가 존재하고 있다(Mann 등, 2021).
전 세계적으로 실제로 농작물에 사용되고 있는 항생제의 양이 의료 분야 및 가축 분야에 비해 상대적으로 적긴 하나, 그로 인해 농작물에 존재하는 식중독세균 등 인간과 관련된 병원균에 저항성이 생길 수도 있다는 우려가 제기되고 있으며, 항생제를 다른 농약과 함께 사용할 경우 항생제에 대한 저항성이 최대 10만 배까지 빠르게 증가할 수 있다는 연구가 보고되어(Kurenbach 등, 2018; Srichamnong 등, 2021) 농업에서의 무분별한 항생제 사용에 대한 제제가 필요한 것으로 나타났다.
농약은 먹거리를 안정적으로 생산하기 위한 필수 자재로 작물의 재배기간 중 발생하는 병해충으로부터 농작물을 보호하고, 수확한 농산물을 저장하는 동안 병해충에 의한 손실을 방지하기 위해 사용되고 있다(Yoo 등, 2022). 그 중 작물의 무름병을 방제하기 위하여 농용 항생제가 사용되고 있으며, 그 종류에는 발리다마이신(validamycin), 스트렙토마이신(streptomycin), 옥시테트라사이클린(oxytetracycline), 옥솔린산(oxolinic acid), 가스가마이신(kasugamycin)이 있다(Koh 등, 2017). 농용 항생제의 사용으로 인해 신속 정확한 식물병 방제 효과를 얻을 수 있으나, 앞서 언급된 부작용으로 인해 농용 항생제에 대한 여러 연구들이 수행될 필요가 있다. 또한 대상 식물 병원균의 항생제에 대한 저항성은 농약 사용의 효과에 큰 영향을 미칠 수 있다.
하지만 아직까지 농용 항생제 및 식물 병원균의 항생제 저항성에 대한 관련 연구가 매우 부족한 실정이다. 따라서 본 연구에서는 시중에 판매되고 있는 3종의 항생제 계통의 농약에 대한 식물병원세균의 저항성을 평가하고, 저항성이 높게 나타난 농약의 주요 항생제 성분인 발리다마이신에이에 대한 식물병원세균의 항생제 저항성 특성에 대하여 조사하였다.
재료 및 방법
사용 균주
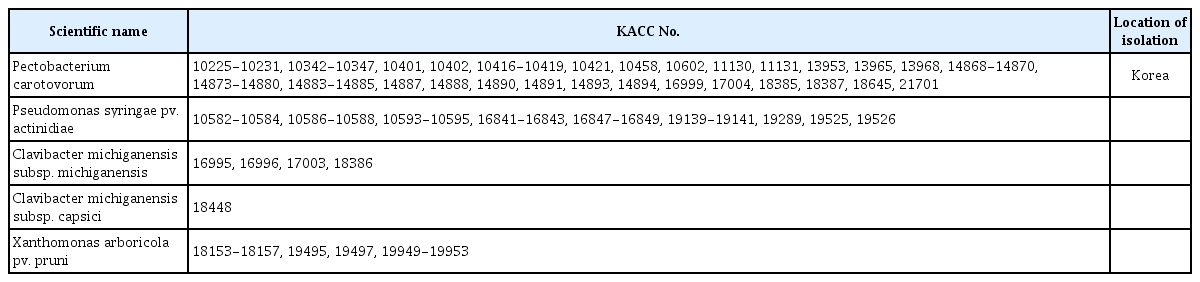
농용 항생제에 대한 저항성을 확인하기 위하여 신선채소인 배추, 상추, 고추, 토마토 등에 병을 일으키는 주요 식물병원세균인 Pectobacterium carotovorum subsp. carotovorum (배추와 상추 무름병균), Clavibacter michiganensis subsp. michiganensis (고추 더뎅이병균, 토마토 궤양병균), C. michiganensis subsp. capsici (고추 궤양병균), Xanthomonas arboricola pv. pruni (핵과류 세균구멍병균)와 고소득 작물인 키위에 막대한 피해를 주는 Pseudomonas syringae pv. actinidiae (참다래 궤양병균)를 선정하였다. 균주는 국립농업과학원 농업미생물은행(Korean Agricultural Culture Collection, KACC, http://genebank.rda.go.kr/mi-crobeMain.do)에서 영남대학교 생명공학과로 분양된 총 6종의 91개 균주를 사용하였으며(Table 1), 모든 균주는 –70°C 초저온냉동고에서 stock culture하여 보관하였다. 시험 균주는 nutrient broth (NB; Difco, Becton Dickinson, Sparks, MD, USA) 배지를 이용하여 28°C에서 24–48시간 동안 최소 2회 이상 계대 배양하여 실험에 사용하였다.
사용된 농용 항생제의 종류
시중에 판매되고 있는 항생 물질계 농약 3종인 Sungbo Chemical Co. (Seoul, Korea), Dong-bang Agro Co. (Seoul, Korea), Syngenta Co. (Seoul, Korea)사의 제품을 대상으로 하여 각각의 주성분이 옥시테트라사이클린 및 스트렙토마이신, 스트렙토마이신, 발리다마이신에이를 선정하였다. 항생제 성분의 약제 중 가장 많이 사용되는 항생제가 스트렙토마이신과 옥시테트라사이클린이며, 발리다마이신에이 또한 최근 채소 등의 무름병을 막기 위해 널리 사용되어 선정하였다. 발리다마이신에이 단독처리에 의한 저항성을 확인하기 위한 발리다마이신에이 표준물질은 Sigma-Aldrich Co. (St. Louis, MO, USA)사의 제품을 사용하였다.
농용 항생제에 대한 저항성 평가
농용 항생제 저항성 균주 확인 시험은 배양된 91개의 식물병원세균을 이용하여 실시하였다. Nutrient agar (NA; Difco, Detroit, MI, USA)를 1-well cell culture plate에 굳힌 후 배양시킨 각 균주의 콜로니를 멸균된 면봉으로 채취하여 사용하였다. 농용 항생제의 농도를 안전사용기준 농도와 같은 1배(1×) 또는 기준의 10배(10×), 100배(100×)가 되도록 첨가된 0.75% soft agar에 멸균된 replica plater for 96-well plate를 이용하여 콜로니를 찍은 후 28°C에서 24–48시간 배양하여 콜로니 형성 유무를 통해 항생제에 대한 저항성을 확인하였다.
발리다마이신에이의 최소억제농도 시험
고체배지희석법(agar dilution method) 및 액체배지희석법(broth dilution method)을 통하여 발리다마이신에이의 최소억제농도(minimum inhibitory concentration, MIC) 또는 최소살균농도(minimum bactericidal concentration, MBC)를 평가하였다. 발리다마이신에이를 최고 농도인 1% (고체배지) 또는 0.5% (액체배지)에서부터 최저 농도인 0.0313%까지 2배씩 희석하였으며 28°C 에서 24시간 배양한 후 세균의 증식을 억제하는 가장 낮은 농도를 MIC로 설정하였으며, MBC는 세균의 증식을 완전히 억제하는 가장 낮은 농도로 선정하였다.
결과 및 고찰
농용 항생제에 대한 저항성 평가
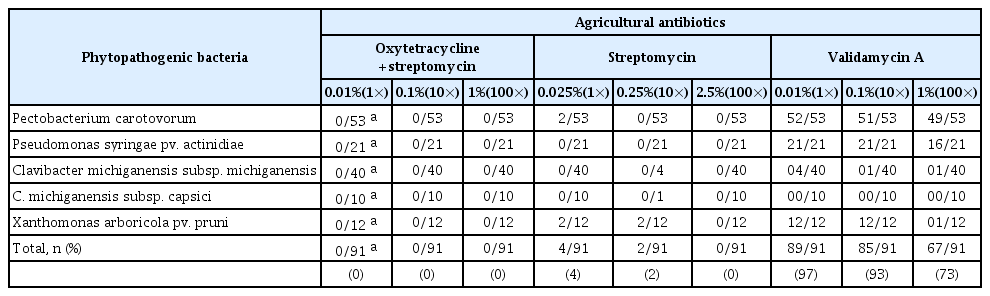
농약의 안전사용기준인 1× 농도 및 10×, 100×의 농도에서 91개 균주를 대상으로 옥시테트라사이클린 및 스트렙토마이신, 스트렙토마이신, 발리다마이신에이 항생제에 대해 저항성 평가를 수행한 결과는 Table 2, Supplementary Table 1에 나타내었다. 모든 식물병원세균에 대해서 주성분이 발리다마이신에이인 농약에서 가장 높은 저항성을 나타내었으며, 옥시테트라사이클린 및 스트렙토마이신이 주성분인 농약에 대해서 가장 낮은 저항성을 나타내었다. 특히, 옥시테트라사이클린 및 스트렙토마이신의 경우에는 모든 농도에서 생장이 일어나지 않는 것으로 나타났다. 스트렙토마이신이 주성분인 농약의 경우에는 1×와 ×10× 농도에서는 각각 4개(Pectobacterium carotovorum KACC 10227, 14874, Xanthomonas arboricola pv. pruni KACC 19951, 19953), 2개(X. arboricola pv. pruni KACC 19951, 19953)의 균주가 성장하였으나, 100× 농도에서는 모두 생장이 일어나지 않는 것으로 나타났다. 이는 일반적으로 스트렙토마이신에 비해 옥시테트라사이클린이 생장 저해 효과가 더 낮은 것으로 알려져 있으므로 두 농용 항생제 간의 저항성 차이가 나타난 것으로 판단된다(Stockwell과 Duffy, 2012). 하지만 본 연구에 사용된 균주인 키위에 궤양병을 일으키는 P. syringae pv. actinidiae를 방제하기 위해 우리나라에 등록된 약제로 옥시테트라사이클린 단제는 등록되어 있지 않고 옥시테트라사이클린 및 스트렙토마이신이 합제된 농용 항생제만이 등록되어 있어(Kim과 Koh, 2018), 본 논문에서는 합제에 의한 효과만 확인하였으므로 옥시테트라사이클린 단독성분에 의한 저항성 평가 연구가 추가적으로 필요할 것으로 사료된다.
The resistance of phytopathogenic bacteria to commercial agricultural antibiotics at various concentrations
반면, 발리다마이신에이의 경우 안전사용기준 농도에서 91개 균주 중 2개의 균주(P. carotovorum KACC 14885, Clavibacter michiganensis subsp. capsici KACC 18448)를 제외한 89개의 균주의 생장이 관찰되었으며, 10× 농도에서도 2개의 P. carotovorum 균주(KACC 14885, 16999)와 1개의 C. michiganensis subsp. capsici 균주(KACC 18448), 3개의 C. michiganensis subsp. michiganensis 균주(KACC 16995, 16996, 18386)를 제외한 93%의 균주가 발리다마이신에이에 대하여 저항성을 가지는 것으로 나타났다. 특히, 100× 농도에서도 73%가 생장하는 것으로 확인되어 다소 높은 농도에서도 식물병원세균의 생육이 억제되지 않았다.
작물의 병해를 막기 위해 사용되는 농약에 대한 식물병원세균의 저항성에 관한 연구는 많지 않은 실정으로, 특히 국내의 경우 키위 궤양병을 일으키는 P. syringae pv. actinidiae 균주의 스트렙토마이신에 대한 저항성에 관한 연구와 P. carotovorum subsp. carotovorum 균주의 스트렙토마이신 및 테트라사이클린에 대한 저항성 연구만이 보고되었다. 이 연구들에 따르면 734개의 P. syringae pv. actinidiae 균주 중 5.18%인 38개 균주가 스트렙토마이신에 대하여 저항성을 보였으며, P. carotovorum subsp. carotovorum의 경우 6.58%인 5개 균주가 스트렙토마이신에 대한 저항성을 보였으며, 테트라사이클린에 대해서는 저항성을 나타낸 균주가 나타나지 않았다고 보고하였다(Kim 등, 2021; Lee 등, 2020). 또한, 국내에서 분리된 Pectobacterium 균주들 중 일부 균주들이 안전사용기준 농도에서의 스트렙토마이신에 대해 저항성을 보이는 것으로 나타났다(Vu 등, 2022). 국내 본 연구에서도 두 연구의 결과와 유사하게 안전사용농도의 스트렙토마이신에 대하여 약 4%인 4개 균주(P. carotovorum KACC 10227, 14874, X. arboricola pv. pruni KACC 19951, 19953)에서 저항성을 나타내었으며, 테트라사이클린계에 속하여 테트라사이클린과 유사한 구조 및 약리작용을 가지는 옥시테트라사이클린과(Lee 등, 2017) 스트렙토마이신이 혼합된 항생제에 대해서는 저항성을 보이는 균주가 나타나지 않았다.
액체배지상 발리다마이신에이의 MIC 및 MBC
농용 항생제에서의 높은 저항성이 농약의 다른 성분을 제외한 발리다마이신에이 단독 성분에 의한 효과인지 확인하기 위해 액체배지 상에서의 MIC를 측정하였다(Table 3). MIC 시험은 농용 항생제에 대해 낮은 저항성을 나타낸 균주(S) (P. carotovorum KACC 14885, P. syringae pv. actinidiae KACC 10586, C. michiganensis subsp. capsici KACC 18448, X. arboricola pv. pruni KACC 19950)와 저항성이 높은 균주(R) (P. carotovorum KACC 10230, P. syringae pv. actinidiae KACC 10588, C. michiganensis subsp. michiganensis KACC 17003, X. arboricola pv. pruni KACC 18154)를 선정하여 총 8개의 균주를 대상으로 진행하였다. 모든 균에서의 발리다마이신에이 MIC는 0.031–0.5%로 나타났으며, C. michiganensis subsp. michiganensis에 대해서 0.031%로 가장 낮은 MIC를 그리고 P. carotovorum (S), P. syringae pv. actinidiae (S, R), C. michiganensis subsp. capsici에 대해서 0.5%로 가장 높은 MIC를 나타내었다. 농용 항생제에 대한 저항성에 따른 MIC의 경향은 P. carotovorum 균주를 제외하고는 관찰되지 않았다. MBC의 경우에도 MIC의 결과와 유사하게 C. michiganensis subsp. michiganensis에 대해서 0.25%로 가장 낮은 MBC를 나타내었으며, 나머지 균주에 대해서는 0.5% 이상인 것으로 확인되었다.
고체배지상 발리다마이신에이의 MIC
고체배지상에서의 발리다마이신에이 MIC 결과는 Table 3에 나타내었다. 전반적으로 고체배지에서의 발리다마이신에이에 대한 식물병원세균의 MIC 농도가 ≥0.5%인 것에 비해 액체배지에서의 MIC 농도는 0.031–0.5%인 것으로 나타나 고체배지상에서 더 높은 MIC 를 가지는 것으로 나타났다. 이는 호주에서 분리된 Brachyspira hyodysenteriae 균의 항생제 감수성에 대해 조사한 결과 agar dilution method에 비해 broth dilution method에서 더 낮은 MIC를 보인 Karlsson 등(2002)의 연구결과와 유사하였다.
액체배지상에서의 MIC 결과와 유사하게 고체배지에서도 C. michiganensis subsp. michiganensis에 대하여 0.25%로 가장 낮은 MIC를 나타내었으며, 나머지 균주에 대해서는 모두 ≥1%의 MIC 농도를 나타내었다. 고체배지상에서도 액체배지에서의 결과와 동일하게 농용 항생제의 저항성 정도와 MIC 농도 간의 경향은 보이지 않았다. 한편, 단독성분에서의 경우 액체배지와 고체배지 모두 농용 항생제 상에서에 비해 저항성이 낮은 것으로 나타나 차이가 있는 것으로 보였다. Zhou와 Wang (2020)에 의하면 항균물질로 널리 사용되는 양이온 계면활성제가 과다 축적될 경우 세균의 저항성을 유발한다고 보고하였으며, 계면활성제에 저항성을 갖게 된 세균은 항생제에도 저항성을 갖게 된다고 보고되어(Louvado 등, 2012), 이는 농용 항생제에 항생제 외에 함유되어 있는 다른 성분들(계면활성제, 색소, 보조제, 증량제 등)에 의해 나타난 차이일 수 있을 것으로 생각된다.
발리다마이신에이의 경우 안전사용기준에서도 대부분의 식물병원세균이 생장하여 높은 항생제 저항성으로 인해 큰 문제가 발생할 수 있을 것으로 생각되어 항생제 단독성분에 의한 직접적인 효과인지에 대해 검증하고자 단독성분에 대한 항생제 저항성을 평가해보았다. 농용 항생제에 함유된 발리다마이신에이에서의 저항성 결과에 따르면 1× 농도인 0.01%에도 대부분의 균주가 생장하였으며, 발리다마이신에이 단독성분에서도 해당 농도의 고체배지에서 생장하는 것으로 나타나 발리다마이신에이 성분에 대해 항생제 저항성을 갖는 것이 큰 문제임을 확인하였다. 따라서 발리다마이신에이가 trehalase를 저해함으로써 세포의 주요 에너지원을 고갈시킴으로써 항균작용을 하는 것으로 보고되었으나(Takahashi와 Igarashi, 2018), 본 연구 결과에 따르면 작물 재배용으로 쓰는 것이 바람직하지 않은 것으로 판단된다. 그러나 Bian 등(2020)의 연구에 따르면 in vitro 실험에서의 발리다미이신에이 처리 시 직접적으로 P. syringae, Fusarium graminearum 및 Botrytis cinerea의 생장이 억제되지 않았으나 발리다마이신에이를 식물에 처리할 경우 salicylic acid와 jasmonic acid/ethylene 신호전달체계와 연관된 식물 면역 반응을 유도하여 식물의 면역력을 증진시켜 P. syringae, F. graminearum, B. cinerea에 의한 식물병의 발생을 줄여주는 것으로 밝혀졌다. 따라서 발리다마이신에이가 병원성균에 대해 직접적으로 항균작용을 갖진 못하지만 방어반응을 증가시켜 저항성을 유도하며, 이를 통해 병의 발생을 감소시키는 데 기여하는 것으로 생각된다.
하지만 대부분의 균주가 안전사용농도에서 생장이 일어나는 것은 항생제 저항성 문제와 직결되어 있으며 국내 농용 항생제 저항성 연구 보고가 많지 않은 실정이기 때문에 발리다마이신에이 저항성 획득과 식물에서의 식물병 발생의 연관성에 대한 추가적인 연구가 필요할 것으로 판단된다.
Electronic Supplementary Material
Supplementary materials are available at Research in Plant Disease website (http://www.online-rpd.org/).
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This work was carried out with the support of “ Cooperative Research Program for Agriculture Science and Technology Development (Project No. PJ01572602)” Rural Development Administration, Republic of Korea.