Barham, E. 2016. The unique role of sentinel trees, botanic gardens and arboreta in safeguarding global plant health.
Plant Biosyst. 150: 377-380.

Choi, H. J., Kim, Y. J., Lim, Y.-J. and Park, D. H. 2019. Survival of
Erwinia amylovora on surfaces of materials used in orchards.
Res. Plant Dis. 25: 89-93.


Choi, H. J., Kim, Y. J. and Park, D. H. 2022a. Extended longevity of
Erwinia amylovora vectored by honeybees under in vitro conditions and its capacity for dissemination.
Plant Pathol. 71: 762-771.


Choi, J. H., Kim, J.-Y. and Park, D. H. 2022b. Evidence of greater competitive fitness of
Erwinia amylovora over
E. pyrifoliae in Korean isolates.
Plant Pathol. J. 38: 355-365.




Doolotkeldieva, T. and Bobusheva, S. 2016. Fire blight disease caused by Erwinia amylovora on Rosaceae plants in Kyrgyzstan and biological agents to control this disease. Adv. Microbiol. 6: 831-851.
Drenova, N. V., Isin, M. M., Dzhaimurzina, A. A., Zharmukhamedova, G. A. and Aitkulov, A. K. 2013. Bacterial fire blight in the republic of Kazakhstan. Plant Health Res. Pract. 1: 44-48.
Duffy, B., Schärer, H.-J., Bünter, M., Klay, A. and Holliger, K. E. 2005. Regulatory measures against
Erwinia amylovora in Switzerland.
EPPO Bull. 35: 239-244.

Duncan, J. M. 1976. The use of bait plants to detect
Phytophthora fragariae in soil.
Trans. Br. Mycol. Soc. 66: 85-89.

El-Helaly, A. F., Abo-el-Dahab, M. K. and El-Goorani, M. A. 1964. The occurrence of the fire blight disease of pear in Egypt. Phytopathol. Mediterr. 3: 156-163.
Emmett, B. J. and Baker, L. A. E. 1971. Insect transmission of fireblight.
Plant Pathol. 20: 41-45.

Fatmi, M., Bougsiba, M. and Saoud, H. 2008. First report of fire blight caused by
Erwinia amylovora on pear, apple, and quince in Morocco.
Plant Dis. 92: 314.

Ham, H., Kim, K., Yang, S., Kong, H. G., Lee, M.-H., Jin, Y. J. et al. 2022a. Discrimination and detection of
Erwinia amylovora and
Erwinia pyrifoliae with a single primer set.
Plant. Pathol. J. 38: 194-202.




Ham, H., Lee, K. J., Hong, S. J., Kong, H. G., Lee, M.-H., Kim, H.-R. et al. 2020. Outbreak of fire blight of apple and pear and its characteristics in Korea in 2019.
Res. Plant Dis. 26: 239-249. (In Korean)


Ham, H., Oh, G.-R., Park, D. S. and Lee, Y. H. 2022b. Survey of oxolinic acid-resistant
Erwinia amylovora in Korean apple and pear orchards, and the fitness impact of constructed mutants.
Plant Pathol. J. 38: 482-489.




Hildebrand, M., Dickler, E. and Geider, K. 2000. Occurrence of
Erwinia amylovora on insects in a fire blight orchard.
J. Phytopathol. 148: 251-256.

Khan, M. A., Zhao, Y. F. and Korban, S. S. 2012. Molecular mechanisms of pathogenesis and resistance to the bacterial pathogen
Erwinia amylovora, causal agent of fire blight disease in
Rosaceae
.
Plant Mol. Biol. Rep. 30: 247-260.


Kim, M.-S. and Yun, S.-C. 2018. MARYBLYT study for potential spread and prediction of future infection risk of fire blight on blossom of Singo pear in Korea.
Res. Plant Dis. 24: 182-192. (In Korean)


Kim, S.-H., Cho, G., Lee, S. I., Kim, D.-R. and Kwak, Y.-S. 2021. Comparison of bacterial community of healthy and
Erwinia amylovora infected apples.
Plant Pathol. J. 37: 396-403.




Kim, Y. E., Kim, J. Y., Noh, H. J., Lee, D. H., Kim, S. S. and Kim, S. H. 2019. Investigating survival of
Erwinia amylovora from fire blight-diseased apple and pear trees buried in soil as control measure.
Korean J. Environ. Agric. 38: 269-272. (In Korean)

Lagonenko, A. L., Komardina, V. S., Nikolaichik, Y. A. and Evtushen-kov, A. N. 2008. First report of
Erwinia amylovora fire blight in Belarus.
J. Phytopathol. 156: 638-640.

Lecoq, H., Desbiez, C., Wipf-Scheibel, C. and Girard, M. 2003. Potential involvement of melon fruit in the long distance dissemination of cucurbit potyviruses.
Plant Dis. 87: 955-959.


Lee, H. J., Lee, S. W., Suh, S.-J. and Hyun, I.-H. 2022. Recent spread and potential pathways for fire blight in South Korea.
EPPO Bull. 52: 135-140.


Lee, M. S., Lee, I., Kim, S. K., Oh, C.-S. and Park, D. H. 2018.
In vitro screening of antibacterial agents for suppression of fire blight disease in Korea.
Res. Plant Dis. 24: 41-51. (In Korean)


Mansfield, S., McNeill, M. R., Aalders, L. T., Bell, N. L., Kean, J. M., Barratt, B. I. P. et al. 2019. The value of sentinel plants for risk assessment and surveillance to support biosecurity.
NeoBiota 48: 1-24.


Murakami, H., Tsushima, S., Akimoto, T. and Shishido, Y. 2001. Reduction of spore density of
Plasmodiophora brassicae in soil by decoy plants.
J. Gen. Plant Pathol. 67: 85-88.


Norelli, J. L., Jones, A. L. and Aldwinckle, H. S. 2003. Fire blight management in the twenty-first century: using new technologies that enhance host resistance in apple.
Plant Dis. 87: 756-765.


Park, D. H., Lee, Y.-G., Kim, J.-S., Cha, J.-S. and Oh, C.-S. 2017. Current status of fire blight caused by Erwinia amylovora and action for its management in Korea. J. Plant Pathol. 99: 59-63.
Park, D. H., Yu, J.-G., Oh, E.-J., Han, K.-S., Yea, M. C., Lee, S. J. et al. 2016. First report of fire blight disease on Asian pear caused by
Erwinia amylovora in Korea.
Plant Dis. 100: 1946.

Park, J., Kim, B., Song, S., Lee, Y. W. and Roh, E. 2022. Isolation of nine bacteriophages shown effective against
Erwinia amylovora in Korea.
Plant Pathol. J. 38: 248-253.




Park, J., Lee, G. M., Kim, D., Park, D. H. and Oh, C.-S. 2018. Characterization of the lytic bacteriophage phiEaP-8 effective against both
Erwinia amylovora and
Erwinia pyrifoliae causing severe diseases in apple and pear.
Plant Pathol. J. 34: 445-450.




Pastalka, T., Rooney-Latham, S., Kosta, K., Suslow, K., Huffman, V., Ghosh, S. et al. 2017. Monitoring using a sentinel plant system reveals very limited aerial spread of
Phytophthora ramorum from infected ornamental plants in a quarantine research nursery.
Plant Health Prog. 18: 9-16.

Peil, A., Bus, V. G. M., Geider, K., Richter, K., Flachowsky, H. and Hanke, M.-V. 2009. Improvement of fire blight resistance in apple and pear. Int. J. Plant. Breed. 3: 1-27.
Powney, R., Beer, S. V., Plummer, K., Luck, J. and Rodoni, B. 2011. The specificity of PCR-based protocols for detection of Erwinia amylovora. Australas. Plant Pathol. 40: 87-97.
Shin, D.-S., Heo, G.-I., Son, S.-H., Oh, C.-S., Lee, Y.-K. and Cha, J.-S. 2018. Development of an improved loop-mediated isothermal amplification assay for on-site diagnosis of fire blight in apple and pear.
Plant Pathol. J. 34: 191-198.




Shtienberg, D., Manulis-Sasson, S., Zilberstaine, M., Oppenheim, D. and Shwartz, H. 2015. The incessant battle against fire blight in pears: 30 years of challenges and successes in managing the disease in Israel.
Plant Dis. 99: 1048-1058.


Sletten, A., Talgø, V., Rafoss, T. and Melbøe, N. S. 2017. Fire blight in Norway: a review of strategies and control measures from 1986 to 2016. J. Plant Pathol. 99: 137-139.
Smits, T. H. M., Guerrero-Prieto, V. M., Hernández-Escarcega, G., Blom, J., Goesmann, A., Rezzonico, F. et al. 2014. Whole-genome sequencing of
Erwinia amylovora strains from Mexico detects single nucleotide polymorphisms in rpsL conferring streptomy-cin resistance and in the
avrRpt2 effector altering host interactions.
Genome Announc. 2: e01229-13.




Sosnowski, M. R., Fletcher, J. D., Daly, A. M., Rodoni, B. C. and Viljanen-Rollinson, S. L. H. 2009. Techniques for the treatment, removal and disposal of host material during programmes for plant pathogen eradication.
Plant Pathol. 58: 621-635.

Van der Zwet, T., Orolaza-Halbrendt, N. and Zeller, W. 2012. Fire Blight: History, Biology, and Management. APS Press, St. Paul, MN, USA. 421 pp.
Zhao, Y.-Q., Tian, Y.-l., Wang, L.-M., Geng, G.-M., Zhao, W.-J., Hu, B.-S. et al. 2019. Fire blight disease, a fast-approaching threat to apple and pear production in China.
J. Integr. Agric. 18: 815-820.

Wang, J., Gao, J., Bayinkexike, Muyassar M., Zhang, J. and Tian, Y. 2022. Blocking field spread of fire blight by electric heating automatic disinfection pruning scissors. Plant Quar. 2: 25-28.

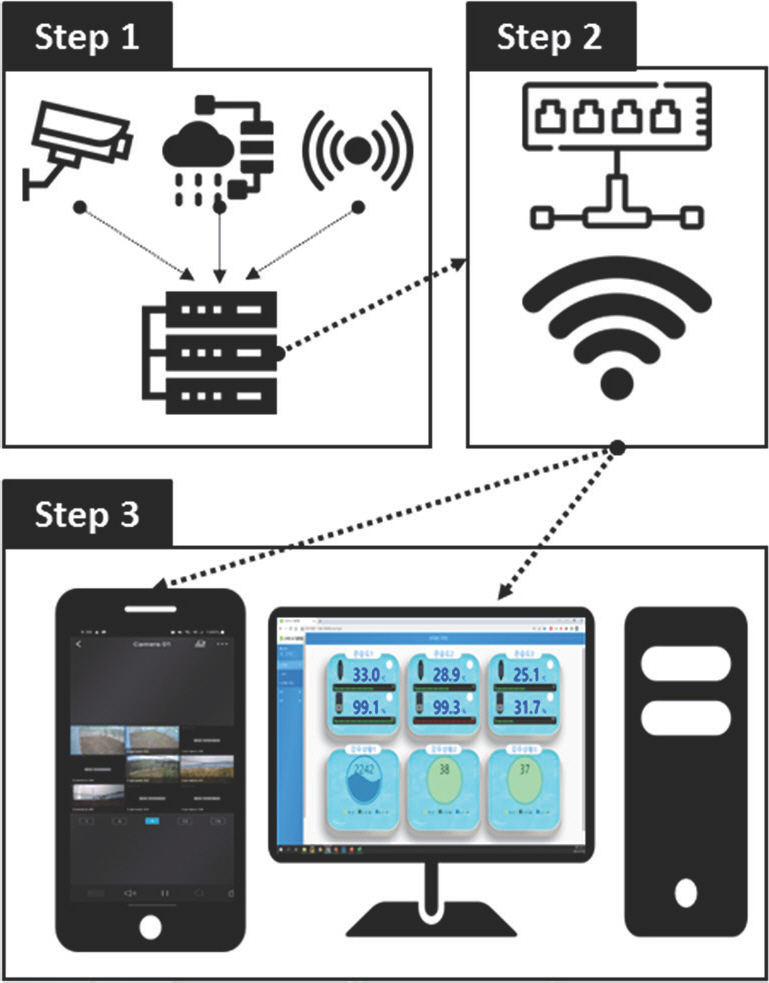

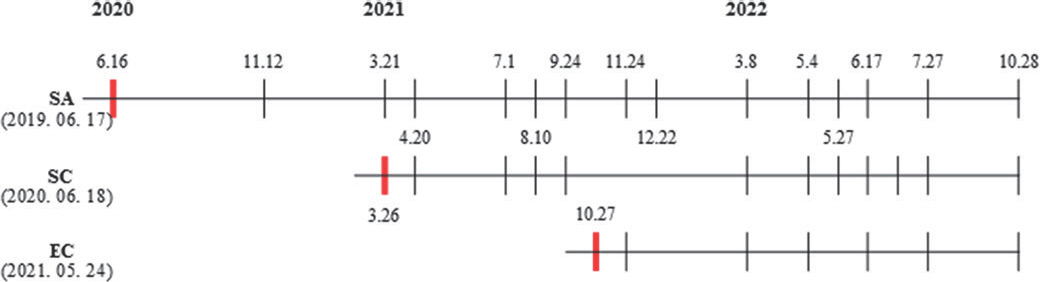
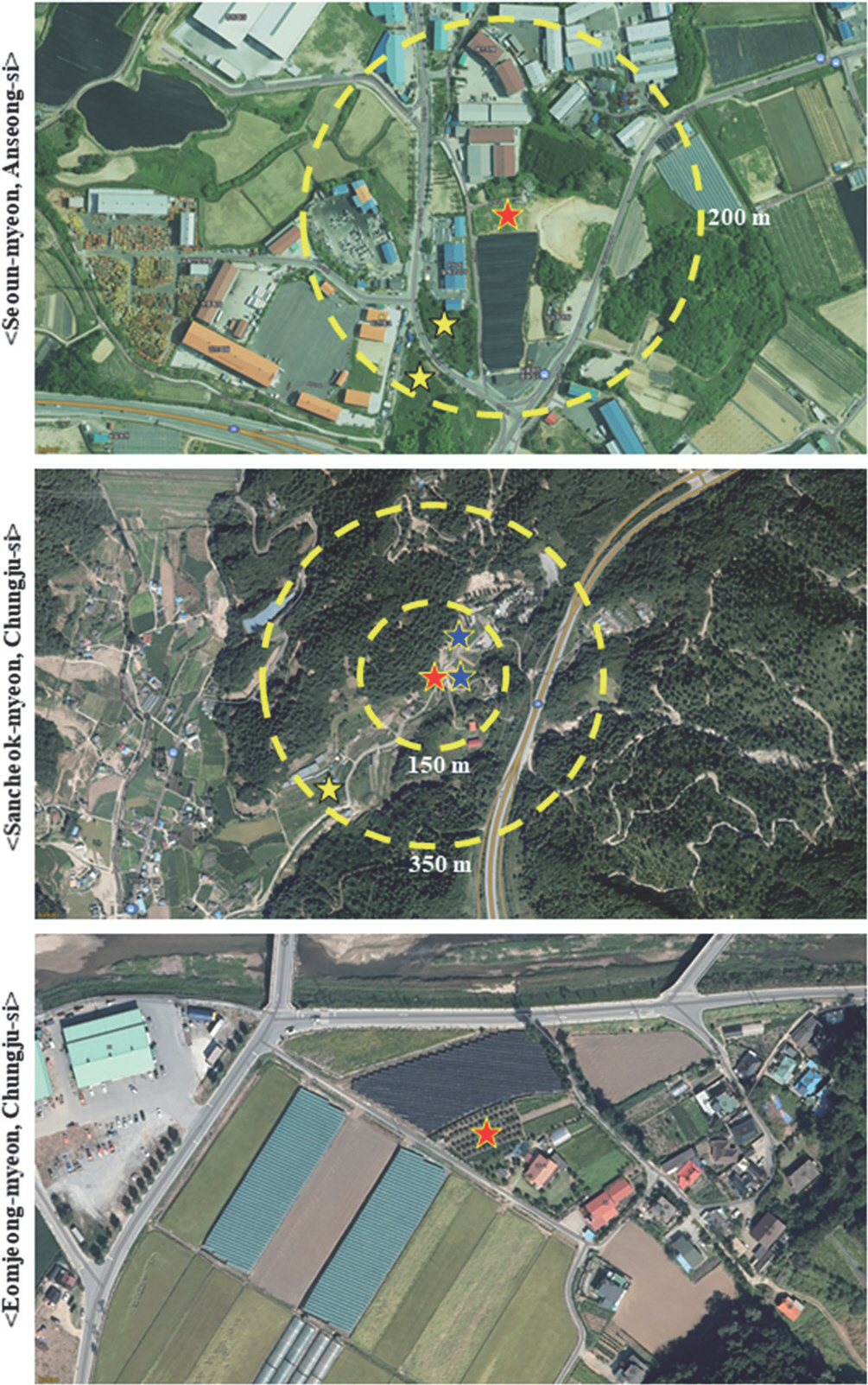




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






