향기농업: 휘발성 물질을 이용한 식물병 진단과 방제
Aromatic Agriculture: Volatile Compound-Based Plant Disease Diagnosis and Crop Protection
Article information
Abstract
휘발성물질은 자연에서 어디에나 존재한다. 생태학적으로 식물이나 미생물이 생산하는 휘발성물질은 식물-미생물이나 미생물-미생물간 대화에 중요한 역할을 수행한다. 정족수 인식 신호는 세균과 세균 사이의 짧은 거리에서만 영향을 미치지만 휘발성물질은 20 cm 이상의 거리에서 생명체 간 신호전달이 가능하다. 이번 리뷰에서는 휘발성물질을 이용한 식물병진단과 진균, 세균, 바이러스병의 생물적방제의 최신 결과를 소개하였다. 더불어 이러한 휘발성물질을 농업에 적용하기 위한 다양한 기술들도 소개하였다. 휘발성물질의 캡슐화와 서방형 제제화 그리고 바이오나노 융합기술은 기존의 휘발성 물질 적용 한계를 넘게 해 줄 것이다. 종합하면 휘발성물질은 식물병을 효과적으로 방제할 수 있는 새로운 방법이다. 이번 리뷰를 통하여 농민들과 젊은 연구자들이 휘발성물질에 대한 이해를 높이고 향기농업으로의 전환을 앞당기는 계기가 되기를 희망한다.
Trans Abstract
Volatiles exist ubiquitously in nature. Volatile compounds produced by plants and microorganisms confer inter-kingdom and intra-kingdom communications. Autoinducer signaling molecules from contact-based chemical communication, such as bacterial quorum sensing, are relayed through short distances. By contrast, biogenic volatiles derived from plant-microbe interactions generate long-distance (>20 cm) alarm signals for sensing harmful microorganisms. In this review, we discuss prior work on volatile compound-mediated diagnosis of plant diseases, and the use of volatile packaging and dispensing approaches for the biological control of fungi, bacteria, and viruses. In this regard, recent developments on technologies to analyze and detect microbial volatile compounds are introduced. Furthermore, we survey the chemical encapsulation, slow-release, and bio-nano techniques for volatile formulation and delivery that are expected to overcome limitations in the application of biogenic volatiles to modern agriculture. Collectively, technological advances in volatile compound detection, packaging, and delivery provide great potential for the implementation of ecologically-sound plant disease management strategies. We hope that this review will help farmers and young scientists understand the nature of microbial volatile compounds, and shift paradigms on disease diagnosis and management to aromatic (volatile-based) agriculture.
서론
우리가 사는 세상은 향기로 가득 차 있다. 공기 중에 인간이 인지할 수 있든지 아니든지 ‘냄새’로 불리는 이 향기는 화학적 으로 휘발성물질로 분류된다. 화학적으로 휘발성물질은 분자량이 300 Da 이하며, 낮은 끊는 점, 높은 휘산도, 그리고 친유성 부분을 함유하고 있는 것이 특징이다(Schulz-Bohm 등, 2017). 이러한 특징 때문에 공기중으로 휘산이 용이하여 20 cm 이상 공간적으로 분리된 환경에서 생명체 간 상호작용에 사용될 수 있는 대사물질이다(Schulz-Bohm 등, 017, 2018). 1-2 μ m 크기의 세균은 휘발성물질을 이용하여 세균 크기의 100,000배 이상의 상당히 먼 거리에 있는 다른 세균이나 식물체에 신호를 주고받을 수 있는 것이다. 일반적으로 공기중으로 비산되지만 특이하게 휘발성 물질은 액체에 녹아서 존재하기도 한다(Boland, 1995). 예를 들어, 분자량이 17 Da인 암모니아와 272 Da인 카로보닐 다이테르펜은 공기중에도 존재하지만 물에도 용해되는 특징을 가지고 있다. 또다른 예로, 조류의 페로몬으로 알려진 카로보닐 물질(C11)은 물에 대한 용해도는 낮지만 물속에도 존재한다(Boland, 1995). 이러한 휘발성물질의 화학적 구조는 다양하다. 예를 들어 세균의 휘발성물질은 알코올, 카르보닐기, 탄화수소, 방향족 화합물, 황이나 질소 함유 화합물로 분류된다(Schulz와 Dickschat, 2007). 세균은 1차 대사경로, 발효, 황 대사, 지질대사 등을 통하여 이러한 물질을 합성한다(Schulz 와 Dickschat, 2007). 세균이외에도 진균 휘발성물질에 대한 연구는 비교적 많이 진행되어 있는 반면 고세균(archaea)과 원생생물(protest)에 대한 결과는 더디게 진행되고 있다(Weisskopf 등, 2021). 이들 화합물의 동정과 정량은 주로 기체 크로마토그래피 질량 분석법(gas chromatography-mass spectrometry, GC-MS)으로 진행된다(Farag 등, 2017).
앞서 언급한 미생물유래의 휘발성 물질 외에도 다양한 식물과 동물과 같은 다세포 생명체의 휘발성물질에 대한 연구도 훨씬 이전부터 진행되었다(Kishimoto 등, 2005; Miekisch 등, 2004; Sholberg와 Randall, 2007). 특히, 인간의 휘발성물질에 대한 연구는 수용체에 대한 연구가 집중적으로 진행되었다. 다양한 휘발성 물질을 어떻게 한정된 냄새 수용체 뉴런이 인지하고 뇌로 신호로 전달되는지 연구가 잘 되어 있다(Maßberg와 Hatt, 2018). 동물에서의 휘발성물질의 수용체와 이를 인식한 후의 반응에 대한 기전연구가 많이 진행되었다. 응용측면에서 휘발성물질의 분석을 통하여 인간과 동물의 질병을 진단하려는 연구가 진행되었다. 실재 진단 기기의 개발이 이루어져 폐암과 위암의 경우 휘발성물질을 통하여 진단하는 기기가 병원에 보급되어 있는 실정이다(Elmassry와 Piechulla, 2020; Miekisch 등, 2004). 하지만 본 리뷰에서는 동물에 대한 휘발성물질과 동물-미생물간의 상호작용에 대한 언급을 지양하고 주로 미생물의 휘발성물질과 미생물-식물 상호작용 시 휘발성물질의 역할에 대한 주제를 다루기로 한다.
식물에 대한 휘발성물질에 대한 연구는 미생물 휘발성물질에 대한 연구가 진행되기 전부터 많은 결과가 축적되어 있었다. 대표적인 식물유래휘발성물질인 녹색잎휘발성물질(green leaf volatile)에 의한 간접방어(indirect defense) 기전이 많이 보고되었다(Heil, 2014; Scala 등, 2013; Ul Hassan 등, 2015). 식물은 주로 잎을 가해하는 곤충의 공격에 의해서 탄소 6개의 휘발성물질을 생산한다. 이를 통하여 천적을 불러들이는 도움신호(cry-for-help signal)를 보내서 곤충으로부터 자신을 보호한다. 동시에, 향후 곤충의 공격에 대비하기 위하여 주위에 있는 같은 종이나 다른 종의 식물들에게 경고 신호(warning signal)을 보내, 곤충 소화효소 억제물질(protease inhibitor) 등을 미리 생산하게 만든다. 곤충에 의해서 식물이 생산하는 휘발성물질을 곤충유래식물휘발성물질(herbivore-induced plant volatile, HIPV)이라고 부른다. 최근 결과에 따르면, HIPV는 단순히 곤충의 공격에 대한 방어활성에 국한되어 있지 않고, 식물병에 대한 경고 신호로 작용하여 식물의 병저항성을 유도할 수 있다(Kishimoto 등, 2005; Sholberg 와 Randall, 2005, 2007). 이와 대비하여 최근에는 식물과 상호작용하는 세균, 진균, 바이러스에 의해서 새롭게 식물에서 만들어지는 휘발성물질을 통칭하여 미생물유래식물휘발성물질(microbe-induced plant volatiles, MIPV)이라고 한다(Sharifi 등, 2018). 이러한 휘발성물질을 농업에 적용하여 식물병을 진단하거나 방제하는 데 사용할 수 있다. 따라서 2000년에 들어오면서 휘발성물질을 이용한 향기농약과 향기비료의 가능성에 대한 연구가 수행되고 있다. 본 리뷰에서는 휘발성물질을 농업에 적용하여 작물생산성을 늘리고(향기비료) 병방제(향기농약)에 이용하는 것을 ‘향기농업’으로 명명하는 것을 제안한다.
향기농업의역사
휘발성물질을 식물에 처리하여 식물의 반응을 발표한 것은 2003년과 2004년 Ryu 등이 식물생장촉진세균(plant growth-promoting rhizobacteria, PGPR)이 생산한 휘발성물질에 의한 생장촉진과 병저항성 유도(induced systemic resistance)를 보고한 것이 최초이다(Ryu 등, 2003, 2004). 이 실험에서 휘발성물질의 효과를 손쉽게 검정하기 위하여 “ I-플레이트”를 최초로 도입하였다. I-플레이트는 중간의 막에 의해서 두 부분으로 나누어 한쪽에는 PGPR을 접종하고 다른 한쪽에는 모델 식물인 애기장대 종자를 파종하였을 때, 3-4주 후 식물의 지상부와 뿌리의 생장이 월등하게 향상되는 현상을 관찰하였다(Ryu 등, 2003). 이후 PGPR이 생산하는 휘발성물질을 GC-MS로 분석하여 최종 결정인자로 2,3-부탄디올(2,3-butanediol)을 동정하였다. 이 물질만 처리 시에도 비슷한 생장 촉진 효과가 관찰되었다. 세균의 2,3-부탄디올 생산 경로의 효소 유전자를 돌연변이하여 휘발성물질 생산을 하지 못한 돌연변이 균주의 경우 생장촉진 효과가 사라지는 것을 관찰하였다(Ryu 등, 2003). 이어진 연구에서 동일한 생장촉진세균과 2,3-부탄디올을 처리한 애기장대의 경우 무름병을 일으키는 세균인 Pectobacterium carotovorum subsp. carotovorum에 대한 식물의 저항성이 증가하여 식물면역반응이 향상되는 것을 관찰되었다(Ryu 등, 2004). 이를 계기로 많은 연구에서 다른 세균 종과 진균에 의 하여 다양한 종류의 휘발성물질이 생산되며 공간적으로 분리된 상태에서도 식물의 생장촉진과 병을 막는 현상들이 보고 되었다(Audrain 등, 2015; Chung 등, 2016; Sharifi와 Ryu, 2018; Weisskopf 등, 2021). 미생물유래휘발성물질은 식물병원균에 대한 유도저항성 증진 이외에도 직접적으로 병원균의 생장을 억제하는 기전이 있음이 새롭게 발견되었다(Garbeva와 Weisskopf, 2020; Lammers 등, 2022). 이러한 연구들을 바탕으로 미생물 휘발성물질의 종류와 종별 특성에 대한 데이터베이스화의 요구가 대두되었다. 2018년, 독일의 Piechulla 그룹에서는 미생물 휘발성물질을 체계적으로 분류하여 미생물 휘발성 물질(microbial volatile organic compounds, mVOCs) DB를 제작하였다. 이 데이터베이스를 기반으로 미생물 종별 휘발성물질의 특성을 손쉽게 확인할 수 있게 되었다(Lemfack 등, 2017). 하지만 여전히 미생물 휘발성물질의 정확한 기능에 대한 연구와 농업현장 적용법에 관한 추가적인 연구가 필요한 실정이다.
지금까지 언급한 농업에 적용 가능한 휘발성물질의 특징을 이해하기 위해서 몇 가지 사전 지식이 필요하다. 첫 번째로 식물의 휘발성물질들은 탄소를 함유하고 있어 유기휘발물질(volatile organic compound, VOC)이라고 불린다. 하지만 미생물의 경우 암모니아, 황화 수소, 시안화합물과 같은 무기화합물인 휘발성 물질을 생산한다. 따라서 세균이 생산하는 휘발성물질의 경우 “유기”라는 말을 붙일 수 없어 세균휘발성물질(bacterial volatile compound, BVC)라고 부른다(Audrain 등, 2015). 두 번째로 간혹 식물유래휘발성물질에서 미생물에 의해 생산되는 것으로 보이는 물질이 관찰된다. 이러한 현상은 식물이 미생물과 유사한 대사경로를 가지기 때문에 나타나기도 하지만, 많은 경우 식물 내부나 표면에 존재하는 미생물이 생산한 것으로 유추된다. 그 이유는 식물유래휘발성물질 알코올과 같은 혐기 호흡을 통하여 만들어지는 휘발성물질들이 발견되는데, 식물의 경우 물에 잠긴 몇몇 식물을 제외하고는 알코올 등을 혐기조건에서 생산할 수 없기 때문이다. 따라서 이에 대한 자세한 연구가 필요하다. 세 번째는 현재 휘발성물질의 기기적 검출한계에 의하여 자연 상태에 존재하는 휘발성물질의 생태에 대한 연구가 제한되고 있다. 따라서 민감도를 높인 새로운 휘발성물질 동정 시스템 개발이 필요하다. 특히 특별한 조작이나 추출단계 없이 현장에서 휘발성물질을 직접 측정할 수 있는 기기가 개발되어야 한다.
이 리뷰에서는 휘발성물질을 농업에 응용하기 위하여 이전의 논문들에 나타난 다양한 결과를 소개하고, 이들을 식물병 진단 및 방제 적용 방안을 제시할 것이다. 또한 리뷰를 통하여 농민들과 휘발성물질에 관심을 가지고 있는 과학자들에게 정보를 제공하여 농업에 적용할 수 있는 새로운 기술로 자기 매김 하길 바란다.
휘발성물질 분석에 의한 식물병 진단
휘발성물질을 이용하여 식물병을 진단하는 방법은 크게 두가지가 있다. 먼저 병원균이 직접 생산하는 휘발성 물질을 검출하여 진단에 이용하는 것과 두 번째로 병원균의 감염에 의해서 기주식물에서 생산되는 휘발성 물질을 바이오마커로 사용하여 진단하는 두 가지 방법이 있다. 본 단락에서는 먼저 mVOCs 분석법을 설명하고, 진균 및 세균 등 병원균 유래 휘발성 물질 분석 기반 식물병 진단 예시와 병원균에 감염된 식물의 휘발성 물질인 MIPV를 이용한 식물병 진단 예시를 소개하고자 한다.
휘발성 물질 분석법.
GC-MS는 낮은 농도로 존재하는 물질을 분석할 수 있는 고감도 분석장비이며, 300 Da 이하의 저분자 휘발성 물질 및 방향족 휘발성 물질을 검출하기 적합하다(Lisec 등, 2006; Santos와 Galceran, 2003). 그러나 전통적인 GC-MS 분석법의 경우, 유기용매를 이용하여 시료로부터 타겟 물질을 분리한 후 액-액분배(liquid-liquid extraction) 및 정제 등의 시료 전처리과정이 필요하다(Prosen와 Zupančič-Kralj, 1999). 이러한 전처리과정에는 진공농축(evaporation) 단계가 필수적으로 동반되는데, 타겟 물질이 휘발성 물질이라면 이 과정에서 유실될 가능성이 있으며 전체 시료준비과정 중에 발생하는 3-4번의 진공농축 단계를 거친 후 최종 단계에서 타겟 물질은 기기상 검출한계 이하가 될 가능성이 있다(Prosen와 Zupančič-Kralj, 1999; Santos 와 Galceran, 2003). 이러한 단점을 극복하기 위하여 농축 단계가 생략된 휘발성 물질 분석법 개발이 요구되었다. 고체상 미량추출법(solid phase micro extraction, SPME)은 흡착제가 코팅된 섬유(fiber)를 시료에 노출시켜 휘발성 물질을 흡착하고 분석장비에서 탈착하는 시료 채취법으로 특별한 전처리 없이 공기중에 있는 휘발성 물질을 정량하고 동정할 수 있는 장점이 있다(Prosen와 Zupančič-Kralj, 1999). 주로 GC-MS와 결합하여(SPME-GC-MS) 식품학, 의료, 악취분석 등 다양한 분야에서 활용되고 있다(Deng 등, 2004; Havenga와 Rohwer, 2000; Miekisch 등, 2004; Sholberg 와 Randall, 2005). SPME-GC-MS법의 경우 고감도 검출 성능과 라이브러리를 포함하고 있어, 여러 물질들이 섞여있는 시료 내 특정 휘발성 물질을 단성분 단위 분리하여 동정하는 데 유리하다.
SPME-GC-MS가 상기의 장점에도 불구하고 기기가 고가이고 무게가 무겁고 커서 농업현장에 바로 적용하기에는 공간적 제약이 존재한다. 그 이유는 GC-MS 시스템을 유지하기 위해서는 장비 내부의 고온과 진공을 유지해기 위한 장치가 필요하기 때문이다. 이를 극복하기 위해 Aksenov 등(2014)은 휴대용 GC 와 differential mobility spectrometry (DMS)를 결합하였다. 이 방법을 이용하여 진단법 중에 고감도로 인정되는 polymerase chain reaction 기반의 진단법과 유사한 진단 성능을 확인하였다(Aksenov 등, 2014). Contreras 등(2008)은 저온질량기법(low thermal mass GC)을 이용하여 13 kg 이하의 휴대용 GC-TMS (toroidal ion trap mass analyzer)-MS를 개발했고 이를 통해 야외조건에서 질량분석이 가능해졌다(Contreras 등, 2008).
지금까지 언급한 GC-MS를 이용한 분석법의 한계점 중 하나는 기기 내 휘발성물질의 정보를 가지고 있는 라이브러리가 존재해야 하는 오프라인 분석법이라는 점이다. 그래서 최근 인터넷을 연결한 온라인 라이브러리가 제안되었다. 먼저, SPME나 흡착튜브 등 시료 채취도구를 이용하여 특정 시기에 먼저 시료채취 후 분석장비에서 분석을 진행하는 두 단계 분석법이므로 이러한 분석법의 결과는 시시각각으로 변화하는 환경을 반영하지는 못한다는 것이다. Lindinge와 Jordan (1998)은 휘발성 물질 시료를 실시간(online)으로 분석하기 위해 proton-transfer-reaction mass spectrometry (PTR-MS)를 개발하였다(Blake 등, 2009). PTR-MS 외에도 Beck 등(2015)은 휴대용 GC-TMS에 동적 바늘 시스템(dy-namic needle trap system)을 도입하여 식물 휘발성 물질의 온라인 탐지법을 개선하였다(Beck 등, 2015).
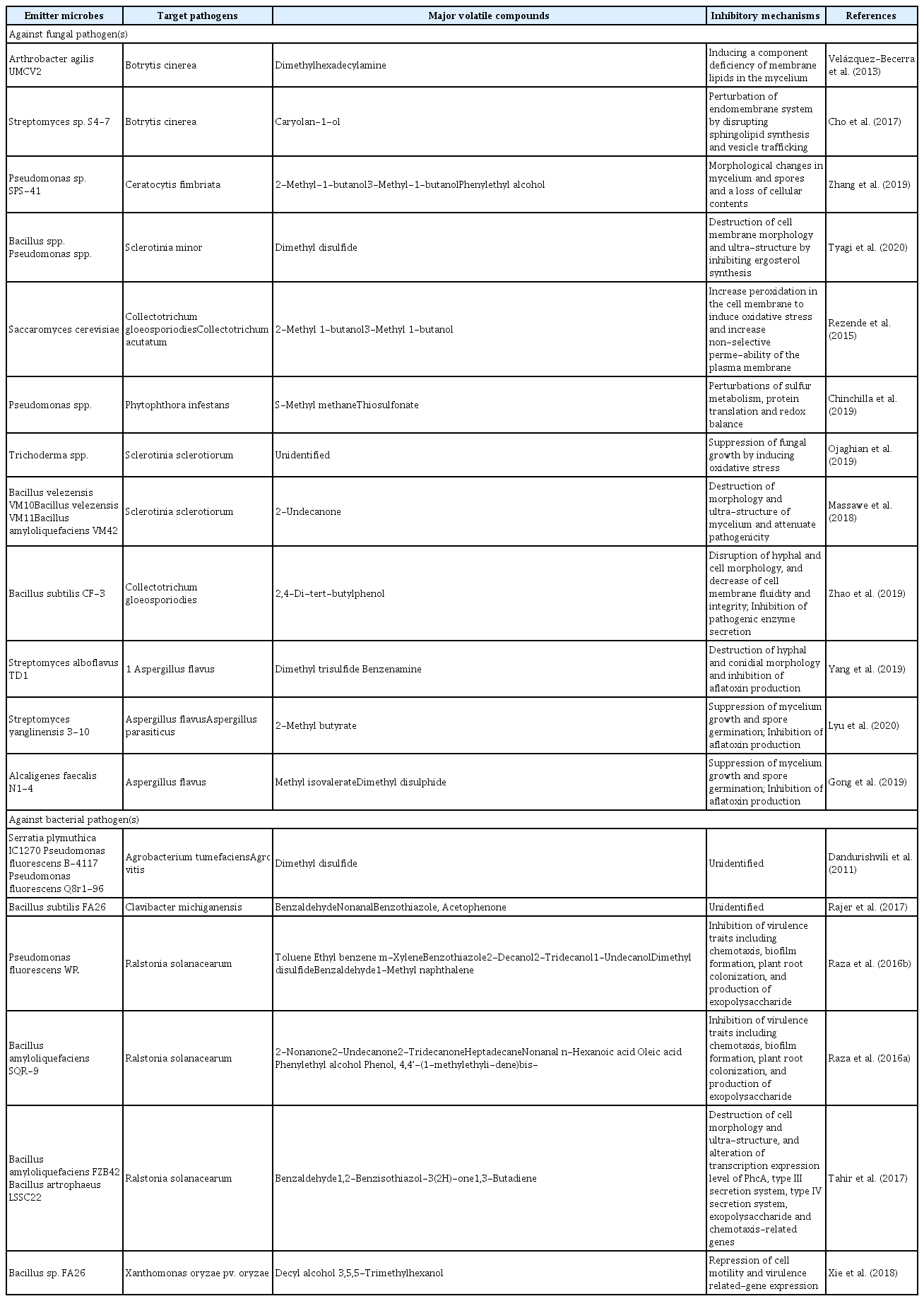
이러한 기술들은 각 분석법별 강점이 있다. 연구자들은 식물병 진단을 위해 고검출감도와 간편한 시료채취 단계 SPME-GC-MS법, 휴대가능한 GC-DMS와 GC-TMS, 그리고 온라인 분석이 가능한 PTR-MS법, 위에서 설명한 방법 이외에도 휘발성 물 질을 전체적으로 프로파일링하는 전자코(electronic nose, E-nose) 기술 등을 이용하여 병과 직접적/간접적으로 관련된 마커 휘발성 물질을 동정해왔다(Fig. 1) (Cellini 등, 2021). 이 다음 문단에서 사례를 통해 설명하겠다.
Analytical technologies for volatile compound-based diagnosis. Solid phase microextraction (SPME) combined with gas chromatog-raphy-mass spectrometry (GC-MS) contributes high analytical performance without pre-extraction processes. To apply volatile compound detection outside the laboratory, potable detection methods, such as GC-differential mobility spectrometry (DMS), GC-toroidal ion trap mass analyzer (TMS), proton-transfer-reaction mass spectrometry (PTR-MS), and electronic nose (E-nose), are needed. These methods provide rapid data acquisition. PTR-MS and E-nose techniques are more powerful through online-based analysis. The smartphone-based volatile organic compound (VOC) sensing platform is a portable device that responds quickly to target molecules. These technologies allow the diagnosis of plant diseases by microbial volatile compound and microbe-induced plant volatile detection.
병원균 휘발성 물질 기반 식물병 진단.
식물병원균이 생산하는 휘발성물질을 통하여 식물병을 진단하는 방법은 기존의 병징 기반의 진단보다 정확도와 민감도를 높일 수 있다. 특히 병징이 육안으로 보이기전에 진단이 가능한 장점이 있다. 하지만 이러한 진단이 가능하기 위해서는 미생물 종 특이적 바이오마커(휘발성물질) 발굴이 선행되어야 하며, 저농도의 휘발성물질을 측정할 수 있는 민감한 GC-MS가 필요하다. 여기에서는 세균병을 중심으로 공기 전염성 병원균과 토양 전염성 병원균으로 나누어 설명하겠다.
식물 잎에 병을 내는 병원균 중에서 Weise 등(2012)은 고추에 세균성점무늬병(bacterial leaf spot)을 일으킬 수 있는 Xanthomonas campestris pv. vesicatoria의 휘발성 물질을 in vitro 조건에서 분석하여 decan-2-one, undecan-2-on, dodecan-2-one등 ketone과 methylketone류 화합물을 포함한 50여개 휘발성 물질을 검출하였고, 그 중 가장 특징적으로 나타난 10-methylundecan-2-one을 확인하였다(Weise 등, 2012). 우리 나라에서도 큰 문제를 일으키는 사과나 배에 화상 병(fire blight)을 일으키는 Erwinia amylovora는 in vitro 조건에서 2,3-butanedione, 3-methyl-1-butanol, 2,3-butanediol, phenylethyl alcohol, 3-hydroxy-2-butanone, 2-methyl-1-pro-panol을 생산하는 것이 밝혀졌다(Spinelli 등, 2012). 이들 물질을 이용하여 포장에서 E-nose를 통하여 화상병을 진단하려는 시도들이 진행되었다.
키위나무에 병을 내는 세균성 줄기 궤양-마름병(bacterial canker)의 원인균인 Pseudomonas syringae pv. actinidiae의 경우 in vitro 조건에서 1-undecene이 마커 휘발성물질로 밝혀졌다(Cellini 등, 2016). 감자에 병을 일으키는 두가지 대표적인 세균병인 갈색썩음병(brown rot)과 고리썩음병(ring rot)은 각각 Ralstonia solanacearum과 Clavibacter michiganensis에 의해 유발된다. Blasioli 등(2014)은 R. solanacearum이 감염된 감자에서 5가지 물질, 1-hepten-3-ol, 3,6-dimethyl-3-octanone, 3-ethyl-3-methylpentane, 1-chloroctane, benzothiazole 을 갈색썩음병의 바이오마커 휘발성 물질로 밝혀냈고, C. michiganensis가 감염된 감자에서 2가지 물질 2-propanol과 toluene을 감자둘레썩음병균의 마커 휘발성 물질로 밝혀냈다(Blasioli 등, 2014).
MIPV 기반 식물병 진단.
앞서 언급했듯이 MIPV란 병원균의 감염 시 미생물이 내는 휘발성물질을 제외한 식물이 새롭게 생산하는 휘발성물질을 통칭한다(Sharifi 등, 2018). 식물은 병원균 감염에 대한 반응으로 휘발성 물질 방출하며, 이 물질은 식물의 면역을 증가시키는 작용을 한다(Frost 등, 2007; Kishimoto 등, 2006). 흥미롭게도 병원균에 감염 시 감수성인 식물과 저항성인 식물이 서로 다른 휘발성물질을 생산한다는 것이다(Sharifi 등, 2018). 본 문단에서는 병원성 진균과 세균 감염에 의하여 식물체가 생산하는 휘발성 물질 검출 사례에 대해 소개하겠다.
지상부에 감염하는 진균의 예로 줄무늬녹병을 저항성 밀에 접종한 후 ocimene과 같은 sesquiterpenes가 관찰되었고, 감수성 품종의 경우 oxylipin 유도체가 우세하게 나타났다(Castelyn 등, 2014). 잿빛곰팡이병을 일으키는 Botrytis cinerea의 경우, 딸기 감염했을 때 특정적으로 나타나는 휘발성 물질인, 3-methylbutanal, cis-4-decenal, 2-methyl-1-butanol, 2-methyl-1-propanol, 1-octen-3-one, 1-octen-3-ol가 바이오마커로 제안되었다(Vandendriessche 등, 2012). 도열병을 일으키는 Magnaporthe grisea 의 경우, 감염된 손가락조(finger millet, Eleusine coracana) 식물체 잎 조직에서 1-hexadecene, 1-octadecene, quinic acid, 1,2-ben-zenedicarboxylic acid-bis(2-ethylhexyl) ester가 검출되었다. 4가지 휘발성물질은 추가적인 연구를 통하여 도열병 진단에 이용가 능 할 것으로 보인다.
세균병의 경우에는 대부분 지상부 병에 대한 연구가 집중되었다. 하지만 Huang 등(2003)은 병원성 Pseudomonas syringae pv. tomato DC3000와 P. syringae pv. maculicola ES4326를 비기주 식물인 담배 (Nicotiana tabacum)잎에 감염시켰을 때 식물체가 methylsalicylic acid (MeSA)와 methyl jasmonate (MeJA), sesquiterpenes가 생산된다는 것을 확인하였다. 기주식물인 애기장대에 P. syringae pv. maculicola를 접종하였을 시 β-io-none와 α-farnesene를 생산하였다. P. syringae pv. maculicola 병원력인자(virulence factor)를 제거시 동일한 애기장대에 접종했을 때 기존에 생산되지 않던 MeSA가 생산되었다(Attaran 등, 2008). 이러한 결과를 통하여 세균이 비기주 식물에 감염했을 때 MeSA가 MIPV의 바이오마커로 사용될 수 있는 것을 보여준다.
배와 사과에서 발생하는 화상병은 E. amylovora에 의해 발생한다. Spinelli 등(2010)은 E-nose 시스템을 이용하여 감염식물체와 건전식물체에서 유래한 식물 휘발성 물질이 유의적 차이가 있다는 것을 확인하였고, 바이오마커 휘발성물질로 hex-enal isomer와 2,3-butanediol을 밝혔다(Cellini 등, 2018).
위 사례에서 밝혀진 이러한 마커 휘발성 물질들은 병원균과 식물의 상호작용을 이해하는데 도움을 줄 것이라고 생각되며, 추후 진단기술 개발에 이용될 수 있을 것이라고 생각된다.
휘발성물질에 의한 식물병 방제
미생물 유래 휘발성 물질은 다양한 병원균을 직접 혹은 간접적으로 억제하여 병발생을 감소시킬 수 있다. 본 세션에서는 미생물휘발성물질에 의한 식물병원균 방제 기작을 직접적으로 병원균의 생장을 억제하는 기작과 식물의 면역을 유도하여 간접적으로 식물병 발생을 감소시키는 두가지 방법으로 나누어 설명하겠다.
직접적인 병원균 억제.
미생물 휘발성물질중에서 세균 휘발성물질에 대한 연구가 많이 되어 있기 때문에 여기에서는 세균휘발성물질인 BVC를 처리하여 직접 병원균의 생육을 저해하거나 병원균의 병원성을 억제하여 식물의 병 발생을 줄일 수 있는 연구결과를 소개하겠다. 미생물 휘발성물질은 병원균을 직접 저해할 뿐만 아니라, 기존 농약에 대한 감수성을 높일 수 있어 농약 저항성 병원균을 대처하기위한 좋은 대안이 될 수 있다(Avalos 등, 2018; Kim 등, 2013; Lammers 등, 2022). 최근 항균 효과를 가진 BVC를 발굴하고자 하는 다양한 연구들이 수행되고 있으며(Table 1), 이러한 물질을 제품화하여 사용한다면 차세대 농약 혹은 농약효과를 높여주는 보조제로서 가치가 있을 것으로 기대한다.
진균 억제: 항진균성 BVC는 미생물 유래 항균휘발성물질 중 가장 연구가 활발히 수행되어 왔다(Table 1). 미생물유래 휘발성물질은 진균의 생장억제제(fungistatic) 혹은 살진균제(fungicide) 역할을 할 수 있으며, 주로 진균의 균사 생장을 억제하거나 포자의 발아를 억제한다. 세균이 발산하는 항진균물질은 2,4-Di-tert-butylphenol, benzothiazole, 2-nonanone, 2-heptanone, 3-methyl 1-butanol, 2-ethyl-1-hexanol 등 케톤류, 알데히드류, 알코올류 등을 포함하며, 일부 휘발성물질 dimethyl sulfide 등은 황을 포함하고 있다(Poveda, 2021). 본 세션에서는 BVC가 병원성 진균에 미치는 영향을 작용 기작에 따라 나누어 설명하고자 한다. 휘발성 항진균물질의 작용 기작에 대해서는 아직 추가적인 연구가 필요하지만, 주로 세포막에 작용하여 막구성성분 변형시키고, 이를 통하여 비정상적인 균사와 포자를 생성하여 진균의 생육을 억제하는 것으로 보고 되고 있다(Cho 등, 2017; Zhang 등, 2019). 또한, 일부 물질은 병원균의 병원성을 줄여 식물에 피해를 줄이는 것으로 밝혀졌다(Massawe 등, 2018; Zhao 등, 2019).
BVC는 세포막 구성성분에 변형을 야기하여 병원성진균의 생장을 억제한다. Arthrobacter agilis UMCV2 유래 BVC인 dimethylhexadecylamine은 Botrytis cinerea의 막지질 구성요소인 eicosanoic acid와 (Z)-9-octadecanoic acid의 결손을 야기하여 세포막의 온전성(integrity)을 파괴하여 균사생장을 억제한다(Velázquez-Becerra 등, 2013). Streptomyces sp. S4-7 유래 caryolan-1-ol은 B. cinerea의 스핑고지질 형성, 소낭 형성 등 세포내막지질 형성과정을 저해하여 진균의 균사와 포자 형성 저해한다(Cho 등, 2017). 또한 Pseudomonas sp. SPS-41의 2-methyl-1-butanol, 3-methyl-1-butanol, phenylethyl alcohol 는 Ceratocystis fimbriata, Alternaria alternata, Phytophthora capsici의 생장을 각각 89.5%, 82.6%, 63.5% 억제하며, C. fimbriata의 균사와 포자의 세포벽의 형태 변형을 야기하는 것이 확인되었다(Zhang 등, 2019). 2020년 Tyagi 등은 BVCs 중 하나인 dimethyl disulfide를 이용하여 토마토의 균핵병을 일으키는 Sclerotinia minor의 생육억제 실험을 실시하였으며, 포자발아, 균핵생산 억제와 더불어 약 70%의 균사 생장을 억제하는 것을 확인하였다. 또한 dimethyl disulfide는 진균 세포막의 구성성분인 ergosterol의 생합성관련 유전자의 발현을 약 80% 줄여 S. minor의 균사 형태 및 초미세구조(ultra-structure)의 변형을 야기하여 생육을 저해하며, 이를 통하여 균사의 식물 부착을 51% 가량 억제할 수 있었다.
일부 휘발성물질은 세포막의 산화스트레스를 야기하여 진균의 생육을 저해한다. Saccaromyces cerevisiae 유래 휘발성물질인 2-methyl 1-butanol, 3-methyl 1-butanol은 탄저균 (Collectotrichum gloeosporiodies, C. acutatum)의 세포막을 과산화하여 산화스트레스를 유도하고, 전해질 유출을 야기하여 균사의 생장을 억제하는 것으로 확인되었다(Rezende 등, 2015). 또한, BVC 중 하나인 S-methyl methane thiosulfonate는 P. infestans의 황 대사과정(sulfur metabolism), 단백질 번역, 산화-환원 균형(redox balance)에 영향을 주어 균사의 생장을 억제하는 것이 확인되었다(Chinchilla 등, 2019). 세균의 휘발성물질뿐만 아니라 진균의 휘발성물질에서도 유사한 현상이 관찰되었다. Trichoderma. ceramicum, T. atroviride, T. viridescens, T. virens, T. koningii, T. koningiopsis의 VOC는 균핵병원균의 항산화효소인 glutathi-one S-transferase 유전자의 발현을 증가시켜 균사의 성장을 억제하는 것으로 확인되었다(Ojaghian 등, 2019).
휘발성물질은 식물병 원인균의 병원성을 줄여 병징을 줄일 수 있다. Bacillus spp. 유래 2-Undecanone은 균사 세포에 활성산소의 축적을 유도하여 균핵병원균 (S. sclerotiorum)의 균사생장 및 균핵 생성을 억제하며 균사의 형태에 변형을 야기하는 것이 확인되었다. 또한 세포 내 oxalic acid의 축적을 저해하여 병원균의 병원성을 억제할 수 있음이 확인되었다(Massawe 등, 2018). 유사하게, Bacillus subtilis CF-3은 2,4-di-tert-butylphenol 을 분비하여 탄저균(C. gloeosporioides)의 균사와 세포의 형태를 파괴하여 생육을 저해하며, 탄저균의 병원성 관련 효소(pectinase, cellulase)의 분비 또한 억제하는 것이 확인되었다(Zhao 등, 2019).
미생물의 휘발성물질은 작물 수확 후 관리에 문제를 야기하는 진균과 그 진균에 의해 발생하는 진균독소(mycotoxin)를 줄일 수 있다. Streptomyces alboflavus TD1은 dimethyl trisulfide 와 benzenamine 생산을 통해 Aspergillus flavus의 미토콘드리아 막전위 감소를 야기하여 균사의 생장을 억제한다. 또한, 아플라톡신(aflatoxin) 관련 생합성유전자의 발현을 저해하여 발암물질의 생산을 줄일 수 있다(Yang 등, 2019). 유사하게 S. yanglinensis 3-10의 2-methyl butyrate을 주요성분으로 하는 BVCs는 땅콩의 저장에 피해를 주는 A. flavus와 A. parasiticus 의 균사 생장과 포자 발아를 억제하며 아플라톡신 생합성유전자의 발현을 저해할 수 있음이 확인되었다(Lyu 등, 2020). 또한, Alcaligenes faecalis N1-4 유래 BVC인 dimethyl disulphide와 methyl isovalerate는 A. flavus의 균사생장과 포자발아를 억제함과 동시에 아플라톡신 생합성 경로를 저해하여 독성물질의 생성을 억제함이 확인되었다(Gong 등, 2019).
BVC에 의한 항진균효과는 병원균을 직접 저해하고, 병원균의 병원성을 줄여 식물의 병발생 감소에 도움을 줄 수 있다. 또한 수확 후 작물의 저장에 관여하는 병원성 진균의 생육저해와 발암물질인 아플라톡신의 생산을 감소시킬 수 있어, 이를 잘 이용한다면 농약 및 수확 후 작물 관리 등에 사용될 수 있을 것으로 여겨진다.
세균 억제: BVC를 이용한 식물병원성 세균의 방제는 2011년 Dandurishvili 등에 의해 처음 보고되었다. 식물 유익균인 Pseudomonas fluorescens와 Serratia plymuthica의 BVC는 토마토뿌리혹병(tomato crown gall)을 야기하는 토양병원균인 Agrobacterium tumefaciens와 A. vitis의 성장을 감소시켰으며, dimethyl disulfide가 주된 항세균물질로 확인되었다(Dandurishvili 등, 2011). B. subtilis FA26은 benzaldehyde, nonanal, benzothiazole, acetophenone를 발산하여 감자 둘레썩음병(bacterial ring rot)의 병원균인 C. michiganensis 생장을 저해하는 것이 확인되었다(Rajer 등, 2017). 대표적인 토양병원균인 R. solanacearum의 방제는 Pseudomonas속과 Bacillus속 세균의 BVC를 이용하여 방제에 대한 연구가 수행되었다. P. fluorescens WR과 Bacillus amyloliquefaciens SQR-9는 각각 10가지 및 9가지 항세균 휘발성물질을 분비하여 R. solanacearum의 생장을 억제하는 것으로 확인되었다. 휘발성물질을 받은 R. solanacearum은 식물세포-병원균 간의 접촉 시, 초기 병원성인자로 작용하는 polygalacturonase의 생산이 감소하는 것으로 확인되었다. 또한, 뿌리 부착 및 생물막 형성과 관련된 병원성 인자인 세포외다당류(exopolysaccharide)의 합성을 저해하여, 병원균의 병원성에 영향을 미칠 수 있는 것으로 확인되었다(Raza 등, 2016a, 2016b). 유사하게, Tahir 등(2017)은 항세균성 benzaldehyde, 1,2-benzisothiazol-3(2H)-one, 1,3-butadiene을 생성하는 2종의 Bacillus spp.를 보고하였다(Tahir 등, 2017). 앞의 결과와 유사하게 Bacillus spp. 유래 휘발성물질은 병원균의 병원성에 관여하는 PhcA (범병원성조절인자, global virulence regulator), 제3형 분비시스템(type III secretion system), 제4형 분비시스템(type IV secretion system), 세포외다당류, 주화성(chemotaxis) 관련 유전자의 전사를 감소시켜 식물병 발생을 줄이는 것으로 확인되었다. 또한 Bacillus spp. 유래 휘발성물질은 R. solanacearum 세포의 형태와 세포 내 미세구조(ultrastructure)를 심각하게 변형시켜 세포의 온전성에 영향을 미치는 것으로 확인되었다. 이러한 연구는 벼의 흰잎마름병을 야기하는 Bacillus sp. FA26 균주를 이용한 Xanthomonas oryzae pv. oryzae 방제 연구에서 재확인되었다. Bacillus sp. FA26는 휘발성 decyl alcohol과 3,5,5-trimethylhexanol을 분비하여 X. oryzae pv. oryzae 세포의 형태를 변형시키고, 병원성 관련 유전자의 발현을 억제하여 병 발생을 줄이는 것으로 확인되었다(Xie 등, 2018)
미생물 유래 휘발성물질이 병원성 세균의 생장 저해와 병원성에 직접 관여하는 것이 확인된 만큼 새로운 농약으로 활용가치가 매우 높을 것으로 예측된다. 또한 대부분의 항세균 BVC가 Bacillus와 Pseudomonas속에 제한되어 수행된 만큼, 다른 속의 BVC를 이용한 항세균활성 연구가 수행된다면 새로운 신규 물질이 추가로 발굴될 가능성은 매우 높을 것으로 생각된다. 하지만 농업에 대단위로 적용하기 위해서 이러한 물질의 안전성을 추가적으로 평가하여 인축에 대한 약해가 없는지 확인 하는 일이 선행되어야 한다.
휘발성물질에 의한 식물 면역유도(유도저항성).
휘발성물질은 병원균에 직접적인 효과를 줄 뿐만 아니라 식물의 면역반응을 유도하여 다양한 병원균으로부터 식물을 보호할 수 있다. 앞서 언급한 바와 같이 휘발성물질에 의한 식물면역반응 유도는 2004년 Ryu 등의 연구에서 최초 발견되었으며, 이후 식물면역증진을 위한 새로운 미생물의 결정인자로 관심을 받아 많은 연구가 진행되고 있다(Table 2). BVC에 의한 식물면역 증진은 한번 처리로 장기간 효과가 지속되며, 다양한 병원균에 대하여 방제 효과를 보일 수 있기 때문에, 기존 농약의 패러다임을 바꿀 수 있는 획기적인 대안책으로 주목받고 있다. 하지만 효과가 기존 농약만큼 크지 않은 단점도 가지고 있다.
Induced systemic resistance by microbial volatile organic compounds against fungal, bacterial and viral pathogens
진균에 대한 유도저항성: 2,3-Butanediol은 대표적인 세균 휘발성물질중에 하나로 식물에 처리시 세균병과 진균병을 효과적으로 방제할 수 있다(Table 2). Cortes-Barco 등(2010a)은 2R,3R-butanediol을 이용하여 탄저병을 야기하는 Collectotrichum orbiculare에 대한 담배의 면역유도 반응을 확인하였으며, 담배의 자스몬산과 에틸렌 경로를 통하여 면역반응이 활성화된다는 것을 밝혔다. 이후, 그들은 애기겨이삭 (Agrostis stolonifera)을 대상으로 3가지 병원성 진균 (Microdochium nivale, Rhizoctonia solani, Sclerotinia homoeocarpa)에 대한 2R,3R-butanediol의 식물의 유도면역반응을 실험하였고, 그 결과, 자스몬산/에틸렌 경로를 통하여 식물의 면역반응이 활성화된다는 것을 재확인하였다(Cortes-Barco 등, 2010b). 2014년 D’ Alesandro 등은 옥수수에 검은잎마름병을 야기하는 Setosphaeria turcica에 대한 2,3-butanediol의 면역증진효과를 확인하였으며, 2016년 Sharifi와 Ryu는 2,3-butanediol이 자스몬산과 에틸렌 경로를 통하여 Botrytis cinerea에 대한 애기장대 면역증진에 관여한다는 것을 보고하였다.
2,3-Butanediol 외에 미생물은 다양한 휘발성물질을 통하여 진균병에 대한 식물의 면역을 유도한다(Table 2). B. cereus C1L 의 dimethyl disulfide은 담배와 옥수수에 잿빛곰팡이병(B. cinerea)과 잎마름병 (Cochliobolus heterostrophus)에 대한 식물의 면역 증진효과를 야기하였다(Huang 등, 2012). Pseudomonas aeruginosa PM12은 3-hydroxy-5-methoxy benzene methanol을 발산하여 토마토의 시들음병을 야기하는 Fusarium oxysporum 에 대하여 토마토의 병징을 감소시켰으며, 추가적인 연구를 통하여 살리실산 경로를 통하여 면역증진 효과를 유도한다는 것이 밝혀졌다(Fatima와 Anjum, 2017). 버섯휘발성물질로 잘 알려진 진균 유래 1-octen-3-ol은 애기장대의 자스몬산과 에틸렌경로를 통하여 잿빛곰팡이병에 대한 면역증진 효과를 유도하였다(Kishimoto 등, 2007).
휘발성물질 처리를 통한 식물 면역증진 반응은 직접적인 항진균 효과와 분리하여 실험하기 힘들기 때문에 추가적인 정확한 기전연구가 필요하다. 예를 들어 dimethyl disulfide과 같이 일부 물질은 항진균효과와 식물유도저항성을 함께 가지고 있기 때문에, 기존 항진균 BVC를 대상으로 식물유도저항성 유도 여부에 대해 조사해볼 필요가 있다. 또한, 세균 유래 휘발성 물질 외에, 진균 유래 휘발성 물질에 의한 식물면역증진에 대한 연구는 아직 부족한 점이 많다. 진균의 휘발성 물질에 대해 추가적인 연구가 수행된다면, 다양한 신규물질이 추가로 발굴될 가능성이 있을 것으로 생각된다.
세균에 대한 유도저항성: Ryu 등(2004)의 보고 이후, 2,3-butanediol과 acetoin은 미생물의 대표적인 휘발성 식물면역증진 결정인자로 식물병원성 세균, 진균, 바이러스를 대상으로 연구가 수행되었다. 이후 Pseudomonas chlororaphis O6균을 사용한 실험에서 2R,3R-butanediol만이 담배짓무름병에 대한 식물면역 증진 효과를 가지는 것이 확인되어, 이성질체의 형태에 따라 그 효과가 상이할 수 있음을 확인하였다(Han 등, 2006). 또한 2R,3R-butanediol은 식물의 살리실산과 에틸렌 경로를 통하여 식물 면역증진 반응을 유도하였으며, 자스몬산 경로는 관여하지 않는 것으로 확인되었다(Han 등, 2006). 반면에 Song 등(2019)의 연구에서 2,3-butanediol은 오이의 자스몬산 경로를 통하여 오이세균성모무늬병균 (P. syringae pv. lachrymans)에 대한 면역 증진효과를 보이는 것으로 보여, BVC에 의한 식물면역반응은 기주 식물에 따라 상이할 수 있음을 암시하였다(Song 등, 2019).
2,3-Butanediol의 전구물질인 acetoin에 의한 식물면역 증진은 Ryu 등(2004) 이후, Rudrappa 등(2010)에 해 B. subtilis FB17 유래 BVC를 이용한 실험에서 재확인되었다. Acetoin은 애기장대의 살리실산과 에틸렌 경로를 식물의 면역증진반응을 유도하며 P. syringae pv. tomato DC3000에 의해 발병하는 세균성흑반병의 병징을 줄였다(Rudrappa 등, 2010). Acetoin에 의한 식물 병저항 메커니즘에 관한 연구는 Peng 등(2019)에 의해 acetoin을 과생산하는 B. velezensis 돌연변이 균주를 이용하여 연구를 수행하였다. 이 실험에서 acetoin은 병원균에 대한 애기장대의 면역반응을 빠르게 유도하였으며, 식물 세포내 병원균 사멸을 위한 과산화수소 생산 및 세포내 선천면역의 지표인 칼로스축적(callose deposition)을 촉진시켜 세균성흑반병의 병징을 줄이는 것을 확인하였다(Peng 등, 2019).
그 외 Paenibacillus polymyxa E681 유래 tridecane은 애기장대의 살리실산, 자스몬산, 에틸렌 경로를 통하여 P. syringae pv. maculicola에 대한 면역증진에 관여하는 것으로 확인되었다(Lee 등, 2012). 2013년 Song과 Ryu에 의해 미생물 유래 휘발성물질인 2-butanone과 3-pentanol이 오이의 자스몬산 경로를 통하여 오이모무늬병균에 대한 식물의 면역을 증진시키는 것으로 확인되었다. 이후, 3-pentanol 실제 고추농업환경에 적용하여 세균성점무늬병 (X. axonopodis pv. veicatoria)에 대한 방제효과를 확인하였고, 살리실산과 자스몬산 경로를 고추의 면역증진효과를 보이는 것으로 확인되었다(Choi 등, 2014). 2017년 Tahir 등은 R. solanacearum를 직접 저해하며 담배의 면역증진도 할 수 있는 물질을 보고하였다. 세 가지 Bacillus spp.에서 발견된 benzaldehyde, 1,2-benzisothiazol-3(2 H)-one, 1,3-bu-tadiene, albuterol, 1,3-propanediole은 담배의 시들음병을 야기하는 R. solanacearum 균 자체를 저해함과 동시에 살리실산 경로를 통하여 담배의 면역을 증진시키는 것으로 확인되었다. 진균의 휘발성 물질 또한 식물의 면역증진 반응을 유도할 수 있다. 식물생장촉진진균인 Ampelomyces sp.와 Cladosporium sp.는 휘발성물질을 발산하여 P. syringae pv. tomato에 대한 애기장대의 면역증진 반응을 유도하였다(Naznin 등, 2014). 두 진균의 면역증진유발 휘발성물질은 m-cresol과 methyl benzo-ate로 확인되었으며, 살리실산과 자스몬산 경로를 통하여 애기장대의 면역증진을 야기하는 것으로 확인되었다.
2,3-Butanediol은 식물유익균이 발산하는 휘발성 물질로 잘 알려져 있지만, 식물 병원균(e.g., P. carotovorum subsp. carotovorum 등) 역시 2,3-butanediol을 생산하는 것으로 알려져 있다. 병원균은 약산성환경(<pH 6)인 식물 아포플라스트(apoplast) 를 알칼리화시켜 중성으로 만들기 위하여 2,3-butanediol을 생산한다. 알칼리화된 환경(>pH 7)은 병 원균의 병원성인자인 효소들의 활성을 증가시켜 병원균의 증식에 도움을 줄 수 있다. 식물이 유익균과 병원균의 2,3-butanediol 을 어떻게 구분하는 지에 대해서는 아직 추가적인 연구가 필요하다. 일부 연구결과들에 따르면, 유익균 유래 2,3-butanediol 은 병원균(P. carotovorum subsp. carotovorum)의 병원성인자인 RsmA를 저해하여, 식물 내 병원균의 증식을 억제하는 것이 확인되었다(Broberg 등, 2014; Kõiv 등, 2013). 이러한 결과들을 종합하여 추측해보면, (1) 식물이 어떠한 세균(유익균 혹은 병원균)의 2,3-butanediol을 먼저 접촉하는지가 중요해 보인다(Chung 등, 2016). 이는 식물이 유익균을 먼저 접촉할 시, 식물의 면역증진 반응이 일어나 다양한 병원균에 대한 저항성을 지니게 되며 주변 병원균의 병원성을 낮추어 식물을 보호하지만, 병원균을 먼저 접촉하면 식물이 충분한 방어체계를 갖추기 전에 병이 발생됨을 의미한다. (2) 또한, 유익균과 유해균이 분비하는 2,3-butanediol의 구조에 대한 조사가 필요해 보인다. 실제로, 2,3-butanediol은 이성질체로 존재하기 때문에 세균종의 차이에 의해서 서로 다른 이성질체를 생산, 인식할 수 있을 것이다. 추가적인 연구를 통하여 2,3-butanediol의 정확한 기전을 밝힌다면 농업에 직접 적용할 수 있는 폭이 넓어질 것이다.
바이러스에 대한 유도저항성: B. amyloliquefaciens IN937a 유래 3-pentanol은 고추의 면역반응을 증진시켜 오이 모자이크 바이러스(Cucumber mosaic virus)에 대한 병징을 감소시킬 수 있음이 포장실험을 통해 확인하였다(Choi 등, 2014). 2R,3R-butanediol과 2S,3S-butanediol은 고추에서 살리실산, 자스몬산, 에틸렌의존적 병저항성 신호전달을 통하여 오이 모자이크 바이러스, 담배 모자이크 바이러스, 토마토황화잎말림바이러스(Tomato yellow leaf curl virus), 고추모틀바이러스(Pepper mottle virus), 토마토반점시듦바이러스(Tomato spotted wilt virus)에 대한 병징을 감소시키는 것이 확인되었다. 식물의 세균과 진균병 방제에 비하여, 휘발성물질을 이용한 식물바이러스병 방제에 대한 연구는 아직 초기단계이다. 현재 발굴된 다양한 미생물 유래 휘발성물질을 식물바이러스에 적용하는 추가 연구가 필요하다. 바이러스를 방제하는 방법 중 하나로는 저항성 신품종을 개발하는 방법이 있다. 하지만 품종개발에는 많은 시간을 필요로 하는 단점이 있다. 이를 극복하기 위하여 휘발성물질을 이용한 유도저항성을 적용한다면 보다 효과적으로 바이러스병을 방제할 수 있을 것이다.
휘발성물질에의한 작물의 품질 향상
휘발성 물질은 병원균으로부터 작물을 보호할 뿐만 아니라, 작물이 생산하는 아로마나 에센셜오일과 같은 2차 대사산물의 생산에 영향을 주어 작물의 품질향상에 기여할 수 있다. B. velezensis GB03 휘발성물질은 바질 (Ocimum basilicum)의 생장을 촉진함과 동시에 향미성분인 α-terpineol과 eugenol의 합성을 각각 2배 및 10배 증가시켜 바질의 품질향상에 기여할 수 있다(Banchio 등, 2009). 또한, Bacillus spp.는 라즈베리의 주요 향미성분인 라즈베리 케톤(frambinone)의 전구체인 4-hydroxybenzylidene acetone을 합성하여, 라즈베리의 품질향상에 기여한다(Feron 등, 2007). P. fluorescens ALEB7B균은 benzaldehyde를 발산하여 약용식물인 창출 (Atractylodes lancea)의 면역증진을 야기함과 동시에 주요 약용 성분을 함유한 에센셜 오일의 함량을 증가시키며, 유사하게, P. fluorescens spp.는 BVC를 발산하여 페퍼민트의 주요 에센셜오일인 멘솔(methol)의 함량을 증가시켜 작물의 품질을 향상시킬 수 있다(Santoro 등, 2011; Zhou 등, 2016).
식물의 성장 및 방어에 긍정적인 역할을 주는 BVC에 대한 연구에 비하여, 발견된 물질이 작물의 품질에 어떠한 영향을 미치는지에 대한 연구는 아직 부족한 실정이다. 따라서 분리된 BVC 결정인자들이 작물의 품질에 미치는 영향에 대한 추가적인 조사가 필요하다. 또한, 앞서 언급한 듯이, BVC는 작물의 품질뿐만 아니라 작물의 수확 후 저장에도 긍정적인 영향을 줄 수 있다. 따라서, 작물의 품질 향상 및 유지에 BVC를 적용하는 방안에 대한 추가 연구가 필요해 보인다.
풀리지않는 의문: 세균 유래 CO2 생산에 의한 식물 생장촉진 효과
2003-2004년 Ryu 등에 의해 BVC가 식물의 생장 및 면역체계에 긍정적인 영향을 줄 수 있다는 연구가 보고된 이후, BVC 의 효과가 미생물이 발산하는 CO2 때문이 아닌가 하는 논쟁이 지속적으로 발생되고 있다. 실제로 여러 논문에서 미생물 유래 CO2가 식물의 이차대사산물을 증가시켜 식물의 성장 촉진에 관여한다고 보고하였다(Hao 등, 2016; Kai와 Piechulla, 2009; Zhang 등, 2021). 하지만 유익균과 비슷한 농도의 CO2를 발산하는 E. coli DH5α를 음성대조군으로 사용한 실험을 살펴보면, 식물의 생장촉진은 미생물 유래 CO2 외에 다른 물질(2,3-butanediol, tridecane 등)이 주요 인자로 작용함을 알 수 있다(Amavizca 등, 2017; Lee 등, 2012). 하지만 대부분의 실험의 경우 페트리접시 내 밀폐된 환경에서 수행되었기 때문에, 미생물 유래 CO2의 영향에 대해 간과할 수는 없다. 실제로 Zhang 등(2021)은 제한된 페트리접시 환경에서 유익균 유래 CO2가 중요한 생장촉진 요인이 될 수 있다는 연구를 발표한 바 있다. 하지만, CO2를 흡착하는 물질을 처리를 하였음에도 식물생장촉진 및 면역증진반응이 유도되는 것으로 보아, 미생물 휘발성물질의 효과를 CO2 때문이라고 간주하기엔 어려움이 있어 보인다(Bui 등, 2020; Lee 등, 2012). 또한, 실제 식물과 미생물이 상호작용하고 있는 자연환경에서는 식물이 광합성을 할 수 있는 충분한 CO2가 있기 때문에, CO2가 BVC의 생장촉진 인자라고 보기에는 다소 어려움이 있어 보인다. 이미 다양한 연구를 통하여 BVC의 생장촉진 및 면역증진관련 결정인자들이 분리 및 동정되었고, 이러한 물질을 실제 포장 환경에 적용하여 식물의 생장 및 병원균에 대한 방어효과들이 검증되고 있다(Choi 등, 2014; Kong 등, 2018). 이러한 이유로 BVC의 효과를 미생물의 CO2의 효과로 간주하기에는 다소 어려움이 있어 보인다.
휘발성물질의농업적용
캡슐화를 통한 제제화.
농업에 유용한 휘발성 물질을 밝혔다 하더라도 공기중으로 분산이 용이한 물리화학적 특성 때문에 농업 제품 개발에 적합한 제형은 현재까지 개발되지 않았다. 이를 해결하기 위해 화장품 산업이나 식품 산업에서 사용하는 캡슐화(encapsulation)라는 고분자공학 기술을 휘발성 물질의 농업 적용에 제시하는 의견이 제시되었다(Sharifi와 Ryu, 2018). 이전 연구에서는 페로몬이나 향미 물질은 빛이나 산소에 민감한 물질로써, 캡슐화 또는 미세캡슐화(microencapsulation) 방법을 통해 산화, UV, 증발, 그리고 미생물 분해로부터 안정화할 수 있음이 보고되었다(Bakry 등, 2016; Sri 등, 2012). 캡슐화 기술은 타겟 성분과 캡슐 재료 성분이 혼합된 에멀전 형성한 후, 캡슐 또는 미세캡슐을 이루는데, 이 때 사용되는 기법은 화학적 기법, 물리-화학적 기법, 물리-기계적 기법을 통해 크게 세가지로 나눌 수 있다(Ghosh, 2006; Jyothi 등, 2010). 또한 각 방법마다 다양한 캡슐화 제작 기술이 요구되며 그에 따라 제작 가능한 입자범위가 서로 다르다. 물리-화학 기반인 코아세르베이션법은 지름 2-1,200 μ m 입자를, 졸겔법은 2-20 μ m 입자를 제작할 수 있고, 물리-기계적 기반인 압출법은 250-2,500 μ m 입자를 제작할 수 있다(Ghosh, 2006). 농업현장에 적용되는 대표적인 캡슐화 기법은 주로 물리-화학적 기법과 물리-기계적 기법에 포함된다. 본 문단에서는 캡슐화 기법들에 대해 설명하고 사례를 소개하고자 한다(Fig. 2). 더 전문적인 이해를 위해서 비슷한 주제를 다룬 문헌도 참고하길 바란다(Ghosh, 2006; Lisec 등, 2006; Sharifi와 Ryu, 2018).
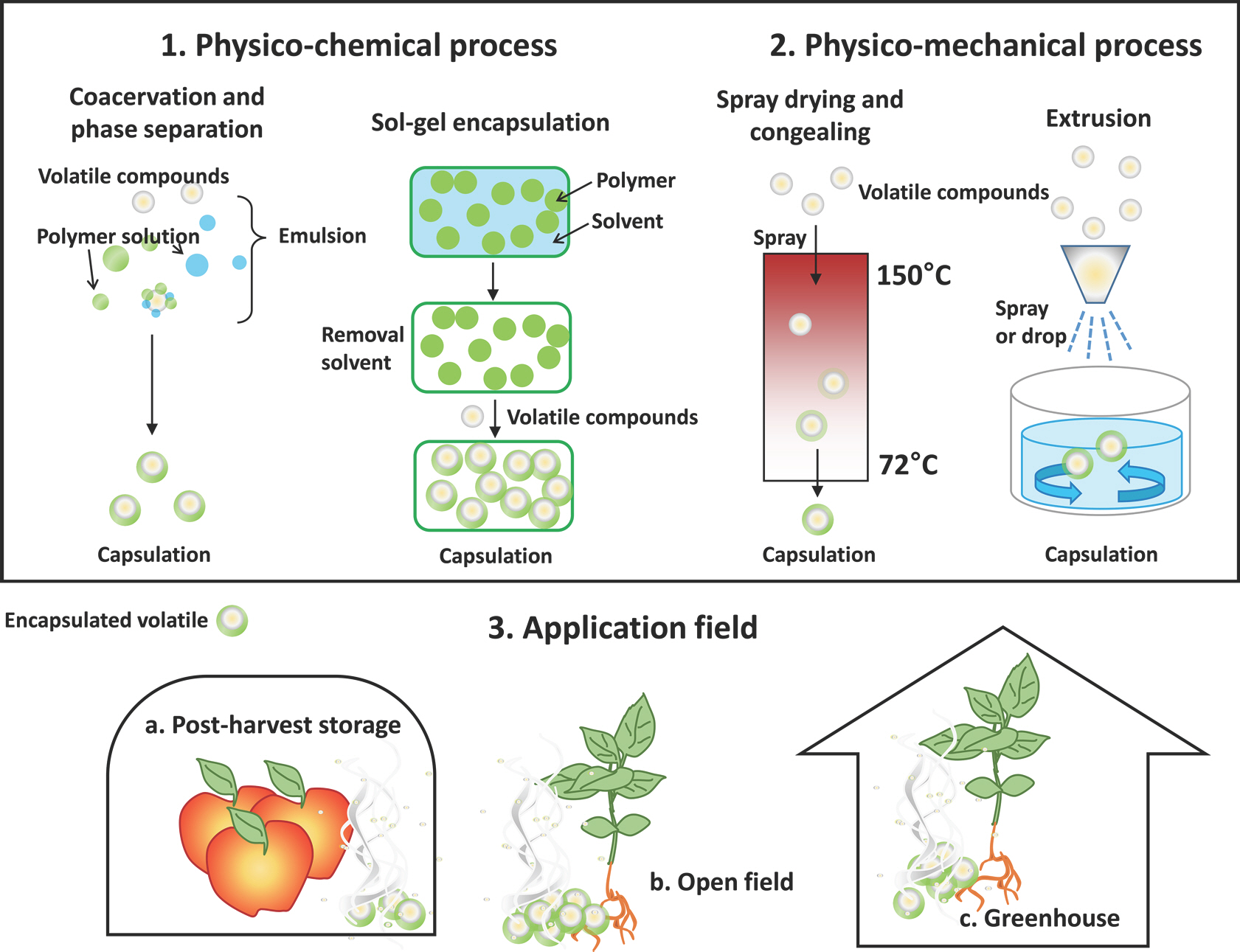
Preparation of biogenic volatiles and plant health application. 1, Coacervation-phase separation, and solgel encapsulation are classified as physico-chemical processes for biogenic volatile preparation; 2, Spray drying–congealing, and extrusion method are classified as physico-mechanical processes for biogenic volatile preparation. 3, After formulation, encapsulated volatiles (microcapsule and sol-gel of biogenic volatiles) can be used in a range of situations: a, storage application; b, open-field application; c, greenhouse application.
물리-기계적기반 캡슐화 기법.
코아세르베이션-상분리(coacervation and phase separation): 코아세르베이트(coacervate)란 여러 유기물이 모인 액체 방울 형태의 구조로써, 유기물이 물 분자를 붙여 콜로이드 입자 상태로 존재하다가 막이 생기면 발생한다. 코아세르베이션법에서는 반대 전하를 가진 두 개의 폴리머를 에멀젼에 첨가한 다음 폴리머가 타겟 물질 주위에 구조를 이루어 캡슐화하는 방법이다. 이 때 사용되는 폴리머는 젤라틴(gelatin)과 아라비아검(Arabic gum)이다. pH와 온도를 낮추면 캡슐 형성이 촉진되며, 글루타르알데히드나 포름알데히드는 미세입자를 경화시키는 가교제로 사용할 수 있다. 코아세르베이션은 소수성 휘발성 물질에 적합하지만 친수성 화합물에는 제한적으로 사용된다(Xiao 등, 2014).
졸-겔 캡슐화(sol-gel encapsulation): 졸-겔 기법의 경우 일반적인 캡슐화 기법과는 조금 달리, 비드(bead) 형태의 캡슐화를 만드는 것은 아니다. 비드 대신 매트릭스(matrix) 구조를 형성하고, 내부의 포어(pore) 구조에 타겟 휘발성 물질 등을 넣는 기술이다(Buckley와 Greenblatt, 1994).
물리-기기기반 캡슐화 기법.
분무 건조-응고법(spray drying and congealing): 분무 건조-응고법에서는 에멀젼을 구배 가열 챔버(gradient heat chamber)로 빠르게 분사하는데, 분사된 입자의 외부층(outer layer)는 빠르게 건조되어 내부 물질을 보호할 수 있는 코트(coat)를 형성한다. 분무 건조법은 대량생산에 유리한 장점이 있으나(Bakry 등, 2016), 고온에 민감한 휘발성 물질을 이 공정에 사용하기 위해서는 최적화가 필요하다(Rosenberg 등, 1990; Soottitantawat 등, 2003).
압출법(extrusion method): 압출법은 젤란(gellan)이라는 가교제 용액(cross-linking agent solution)에 에멀전을 분사하거나 떨어뜨려, 용액 내 고분자가 타겟 주위에 층을 형성하는 방식이다. 이 방식을 통해 얻은 캡슐은 표면에 나노포어(nano-pore)가 존재하는데 이 때문에 휘발성 물질을 천천히 방출시킬 수 있다. 이러한 나노포어는 장기 보관을 위해서 온도를 이용한 처리를 하여 부분적으로 포어를 밀봉할 수 있다(Bakry 등, 2016; Sharifi와 Ryu, 2018).
캡슐화 기법 농업 적용 사례.
압출법 기법으로 제작한 알긴산(alginate) 비드에 진딧물 유인제 β-caryophyllene을 캡슐화하면 현장 조건에서 15일 동안 휘발성 물질이 방출되었다(Heuskin 등, 2012). 젤라틴 미세 캡슐화는 49일 동안 60° C의 보관에 불리한 조건에서 바질 에센셜 오일을 보존했다(Sharifi와 Ryu, 2018). 11일 미만의 기간 동안 BVC에 노출되면 식물 건강에 장기적으로 유익한 효과를 이끌어내기에 충분했다(Ledger 등, 2016). 코아세르베이션은 dodecanol 및 dodecyl acetate와 같은 곤충 페로몬의 미세 캡슐화에 가장 일반적으로 사용되는 기술이다(Yu 등, 2012). 이와 같이 다양한 기법으로 제작한 비드 형태의 캡슐화가 농업에 적용되고 있다. 다음 문단에서는 메트릭스 형태인 졸-겔법의 예시도 소개하고자 한다.
졸-겔법의 경우 곤충 페로몬인 (E)-5-decenyl acetate를 캡슐화하면 이 화합물이 14-45 μ g/day로 28일 동안 지속적이고 서방형으로 방출된다(Zada 등, 2009). 폴리비닐알코올을 중합체로 사용하여 졸-겔법으로 캡슐화하면 서방성을 향상되어 곤충 휘발성 N,N-diethyl-2-methoxybenzammide를 장기간 방출되었다(Chan 등, 2009).
전망
휘발성 물질은 공기중에 쉽게 휘산되는 특징 때문에 농업에 적용하기 쉽지 않다는 생각을 해 왔다. 하지만 근권세균의 식물생장촉진과 유도저항성의 결정인자 중 하나가 휘발성물질인 2,3-butanediol이며, 쉽게 휘발되지 않고 효과를 보이는 것이 관찰된 후 많은 과학자들의 관심을 가지게 되었다. 지금까지 2,000종류 이상의 미생물유래 물질이 보고되었으며 식물병의 원인 미생물을 직접적으로 억제하거나 식물의 면역을 증가하여 간접적으로 식물병을 막는 40여종의 휘발성물질들이 보고되었다. 이러한 지금까지의 연구를 바탕으로 앞으로 휘발성물질을 적극적으로 농업에 적용시키기 위한 많은 기술들이 보급될 것이다. 우리 나라처럼 시설재배 면적이 늘어 가는 상황에서 밀폐된 시설 내에서 휘발성물질을 적정 농도 처리하여 작물병해의 효과적인 방제뿐만 아니라 생산량 증대도 기대할 수 있어 잠재력이 큰 분야이다. 휘발성물질의 진단 부분에서 최근 급속도로 발전하고 있는 나노기술과 융합하여 휘발성물질인 냄새분자를 인식하는 수용체 단백질을 나노구초체에 결합하여 스마트폰이나 자동모니터링 기기를 통하여 손쉽게 특정 휘발성물질의 유무와 정량까지 가능할 것이다(Li 등, 2019). 그렇게 된다면 포장이나 실내에서 공기 순환 장치에 부착하여 식물병의 초기 단계에 진단하여 효과적인 병방제 전략을 수립할 수 있을 것이다. MIPV와 BVC는 다양한 휘발성물질이 혼합체이기 때문에 AI를 이용한 머신러닝을 통하여 휘발성물질의 조합에 대한 이해를 통하여 보다 현장에 가까운 기술 개발이 필요할 것이다.
결언
미생물 유래 휘발성 물질을 이용한 식물병의 진단과 방제 그리고 식물생장촉진은 지난 20년간 과학자들의 관심을 가져왔다. 하지만 휘발성이 강하고 화학 물질의 안정성에 대한 문제를 해결할 수 없어 농업현장에 적용하는 것은 힘들었다. 하지만 최근 들어 화학물질의 캡술화기술과 바이오나노 기술의 발달로 기존의 문제를 해결해 나가고 있다. 마이크로바이옴을 농업에 적용하려는 시도들과 함께 이들이 생산하는 대사산물의 안정적인 생산이 효과의 지속성을 담보할 수 있기 때문에 오믹스 기술을 이용한 마이크로바이옴 내에서 벌어지고 있는 휘발성물질과 같은 대사산물 생산과 식물 반응에 대한 기전 연구가 우선되어야 한다. 이를 바탕으로 마이크로바이옴의 조절과 휘발성물질 생산 조성의 조절을 통하여 지금까지 생물비료나 생물농약이 해결할 수 없었던 문제를 해결할 수 있기를 바란다.
농민들도 기존의 독성이 강한 화학 농약의 사용량을 줄이는 전세계적인 분위기를 이해하고 비교적 해가 적은 휘발성물질을 농업에 적용하기 위한 시도가 필요하다. 휘발성물질이 공기 중으로 휘산되기는 하지만 토양속이나 식물의 조직에 머무르는 시간 동안 충분히 식물의 병저항성이나 생장촉진 프라이밍을 유도할 수 있기 때문에 이용 가능성은 충분하다. 2,3-butanediol과 같이 휘산도가 낮은 휘발성물질의 경우, 별도의 처리 없이 관주하거나 지상부에 분사하는 것이 가능한 가능한 경우도 있기 때문에 휘발성물질의 특성 이해를 바탕으로 한 농업 적용 기술 도입이 필요하다. 기업에서는 휘발성물질을 상용화하기 위하여 독성시험과 기존 농약에서 적용하고 있는 서방형 제제 개발 기술의 적용도 보다 적극적으로 검토되어야 한다. 휘발성물질 이 농업현장에 많은 범위에 적용되는 날이 빨리 왔으면 한다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This research was supported by grants from a project of the National Research Foundation of Korea (NRF) funded by the Ministry of Science & ICT (NRF-2020M3E9A1111636), and from the KRIBB initiative program, South Korea.