Podosphaera xanthii의 새로운 Race 2F에 의한 오이 흰가루병 국내 발병 보고
Occurrence of Powdery Mildew Caused by New Race 2F of Podosphaera xanthii on Cucumber in Korea
Article information
Abstract
Powdery mildew is a common and serious disease of the Cucurbitaceae including cucumber (Cucumis sativus) in most areas of the world. To identify causal agents of the powdery mildew and their physiological race(s), we collected cucumber leaves displaying typical symptoms of powdery mildew from different locations in Korea. Based on morphological and molecular characteristics, all powdery mildew isolates were identified as an obligate biotrophic fungal pathogen, Podosphaera xanthii. After inoculation at melon (Cucumis melo) differentials to identify the fungal race(s), P. xanthii isolate MI180427 and IC190611 were identified as race 1 which has been repeatedly reported as dominant race in Korea. However, another isolate SE180328 produced different disease response in the tested differentials, being identified as race 2 which has not been reported in Korea. To confirm the race of SE180328, we inoculated additional melon differentials and determined the isolate as race 2F that is the prevalent race of powdery mildew in Beijing, China. Report of this new race 2F in Korea will be helpful for future breeding programs to develop resistant varieties to this race.
흰가루병(Powdery mildew)은 오이(Cucumis sativus)를 포함하는 모든 박과(Cucurbitaceae) 작물에서 가장 심각한 피해를 일으키는 병 중 하나이다. 오이 흰가루병에 감염되면 오이의 잎과 줄기를 중심으로 흰색 분말 형태의 균사체와 분생포자가 생성되고, 심하게 감염된 잎은 광합성이 감소하고 꽃과 과실의 생성에도 영향을 준다(Rabelo 등, 2017). 감염 초기 단계의 흰가루병은 식물 자체에 영향을 주어 식물의 괴사를 일으키거나 수확량을 감소시키는 반면, 감염 후기 단계는 일반적으로 과실의 품질을 저하시킨다(Huang 등, 2000). 오이에 흰가루병을 일으키는 대표적인 병원균은 두 가지의 절대기생균(obligate parasite) Golovinomyces cichoracearum (syn. Erysiphe cichoracearum)과 Podosphaera xanthii (syn. Sphaerotheca fuliginea)이며(Bertrand와 Pitrat, 1989; Hosoya 등, 1999), 현재 국내에서 는 P. xanthii가 주로 흰가루병을 일으키는 것으로 보고되어 있다(Kim 등, 2015). 최근 시설 재배가 증가하고 온난화가 가속화됨에 따라 P. xanthii에 의한 병 피해가 증가하고 있는 추세이며 (Hong 등, 2018; Tetteh 등, 2013), 흰가루병 저항성 품종이 새롭게 출현하는 race에 의해 이병화되는 현상이 반복되고 있다. 본 연구는 국내 오이 흰가루병을 일으키는 원인균으로 P. xanthii isolates을 분리 동정하였으며 멜론 판별 식물을 이용하여 race 1와 race 2로 판별하였다. 또한, 국내에서 새롭게 발견된 race 2의 경우 추가적인 멜론 판별 기주를 이용하여 최종적으로 race 2F로 결정하였다.
국내 오이 흰가루병 잎의 채집
국내에서 발생하고 있는 오이 흰가루병균 조사를 위하여 경기도 광주(Gwangju), 경기도 이천(Icheon), 전라북도 김제(Gimje), 서울특별시(Seoul), 경상남도 밀양(Miryang) 지역의 재배농가에서 흰가루병이 발생한 오이 잎을 채집하였다(Fig. 1A, B). 채집한 잎에 형성된 흰가루병균의 균주를 동정하기 위해 이들을 이병성인 조은백다다기오이(FarmHannong, Seoul, Korea)의 떡잎 혹은 본잎에 증식하는 방법(Lee 등, 2004)으로 흰가루병균을 순수 분리하였다.

Regional distribution and photographs of powdery mildew isolated from cucumber (Cucumis sativus) in Korea. (A) Five locations where samples were harvested in Korea. (B) Cucumber leaf samples displaying typical powdery mildew symptom from five different locations. 1, Gimje (isolate KI170723); 2, Gwangju (isolate GW170710); 3, Seoul (isolate SE180328); 4, Miryang (isolate MI180427); 5, Icheon (isolate IC190611). (C) Conidia spore of Podosphaera xanthii isolates. Scale bars=50 μm.
흰가루병균의 순수 분리와 증식
오이와 멜론은 종자 소독 후 멸균된 증류수에서 발아를 유도하였고 다공 플라스틱 포트에 원예용상토 2호(Seoul Bio, Gwangmyeong, Korea)를 넣고 발아된 종자를 포트당 1립씩 심어주었다. 모든 식물은 23° 16시간 광조건, 8시간 암조건이 유지되는 식물 생장상 혹은 세종대학교 캠퍼스에 있는 유리온실에서 재배하였다. 오이 흰가루병균의 순수 분리와 효과적인 증식을 위하여 본 연구에서는 잎 절편(leaf disk)을 이용한 방법(Fanourakis, 1991; Lee 등, 2004)을 일부 변형하여, 감염잎 절편을 건전잎 혹은 건전잎 절편과 접촉시켜 접종을 유도하는 ‘disk-to-disk’ 방법을 사용하였다. 건전잎 혹은 건전잎 절편(1.5×1.5 cm)을 70% 에탄올로 소독하고, 배지(25 mg/ml benzimidazol, 1% phytoagar) (Gafni 등, 2015)가 분주된 페트리디쉬에 치상한 후 재배 농가에서 채집한 흰가루병 감염잎의 절편(0.8×0.8 cm)을 건전잎 혹은 건전잎 절편 위에 올려주고 밀봉하였다. 흰가루병균은 밀봉된 페트리디쉬에서 23°, 24시간 광조건으로 약 10일간 증식하고, 이상의 증식을 최소 3회 이상 반복하여 순수 분리하였다. 경기도 광주, 경기도 이천, 전라북도 김제,서울특별시, 경상남도 밀양에서 수집된 흰가루병균의 분리 균주를 각각 GW170710, IC190611, KI170723, SE180328, MI180427라고 명명하였다.
국내 흰가루병균의 형태학적 관찰과 염기서열 분석
분리 균주들의 형태적 분석을 위하여 증식된 흰가루병균의 균사체를 멸균된 팁으로 긁어내어 멸균 증류수 200 μl로 희석하고 광학현미경(Eclipse Ti, Nikon, Tokyo, Japan)에서 관찰하였다. 국내에서 채집한 오이 흰가루병의 5가지 분리 균주들의(KI170723, GW170710, SE180328, MI180427 및 IC190611) 포자들은 무색 타원형의 형태학적 특징이 P. xanthii와 동일하였다(Fig. 1C). 각 지역별 흰가루병균의 분자생물학적 특징을 비교하기 위하여 KI170723, GW170710, SE180328, MI180427 및 IC190611의 genomic DNA를 cetyl trimethyl ammonium bromide (CTAB)법(Porebski 등, 1997)을 이용하여 추출하였다. 선행 연구(Pirondi 등, 2015)를 따라서 internal transcribed spacer (ITS) 영역을 ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)과 ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)를 사용하여 중합효소연쇄반응(polymerase chain reaction)으로 증폭시켰다. 증폭된 산물들의 염기서열은 BLAST search (https://blast.ncbi.nlm.nih.gov/Blast.cgi)를 이용한 비교 분석 결과 GenBanK에 등록된 P. xanthii의 ITS (accession no. KJ698669.1)의 염기서열과 100% 일치하였다(data not shown). 따라서, 채집된 흰가루병균들의 분리균주들은 P. xanthii임을 알 수 있었다.
흰가루병균 분리 균주들의 race 판별
병 저항성 품종 육성을 위해서는 저항성 검정에 사용할 병원균의 race 규명이 선행되어야 하는데, 오이에서 발병하는 P. xanthii 경우 다양한 생리형(physiological race)들이 보고되어 있으나 정립되어 있지 않아 육종에 이용하기 어렵다(Lee 등, 2014). 대신에 P. xanthii 는 박과 작물인 멜론, 수박, 오이를 모두 교차감염하기 때문에 (Cohen 등, 2000) 주로 멜론 판별 품종을 이용하여 race를 결정하고 있다(Kuzuya 등, 2006). 1935년 미국에서 육성된 멜론 흰가루병 저항성 계통인 ‘PMR 45’에 발병하는 균을 race 1, ‘PMR 45’에 발병하지 않는 균을 race 2로 분류하였다(Jagger 등, 1938). 1946년 미국에서 육성된 race 1과 race 2에 저항성을 갖는 ‘PMR 5’를 이병화 시키는 균을 race 3으로 분류하였다(Pryor 등, 1946). 이를 기본으로 하여 P. xanthii의 race 판별은 일반적으로 4가지 멜론 품종(‘Topmark’, ‘PMR 45’, ‘PMR 6’ 및 ‘MR-1’)을 이용하여 race 1, 2, 3으로 판별하고 있다(Zitter et al., 1996) (Table 1). 본 연구의 race 판별을 위해서는 위에서 설명한 바와 같이 잎 절편을 이용한 방법(Fanourakis, 1991; Lee 등, 2004)을 일부 변형한 ‘disk-to-disk’법을 이용하였다. 접종 후 약 14일에 사진 촬영 후 ImageJ 프로그램(ver. 1.53c, National Institutes of Health, Bethesda, MD, USA)의 “Color threshold” (https://imagej.nih.gov/ij/)을 이용하여 정량화하였으며 감염잎 절편의 크기를 기준으로 건전잎의 흰가루병 병반면적률(%)을 계산하였다. 평균 발병 정도가 10% 이하의 경우에는 저항성(resistant, R) 11%–30%는 중도저항성(intermediate resistant, IR), 31% 이상은 감수성(susceptible, S)으로 판정하였다.

Expected disease reaction and summary of reactions of melon cultigens to Podosphaera xanthii races based on previous reports and present results
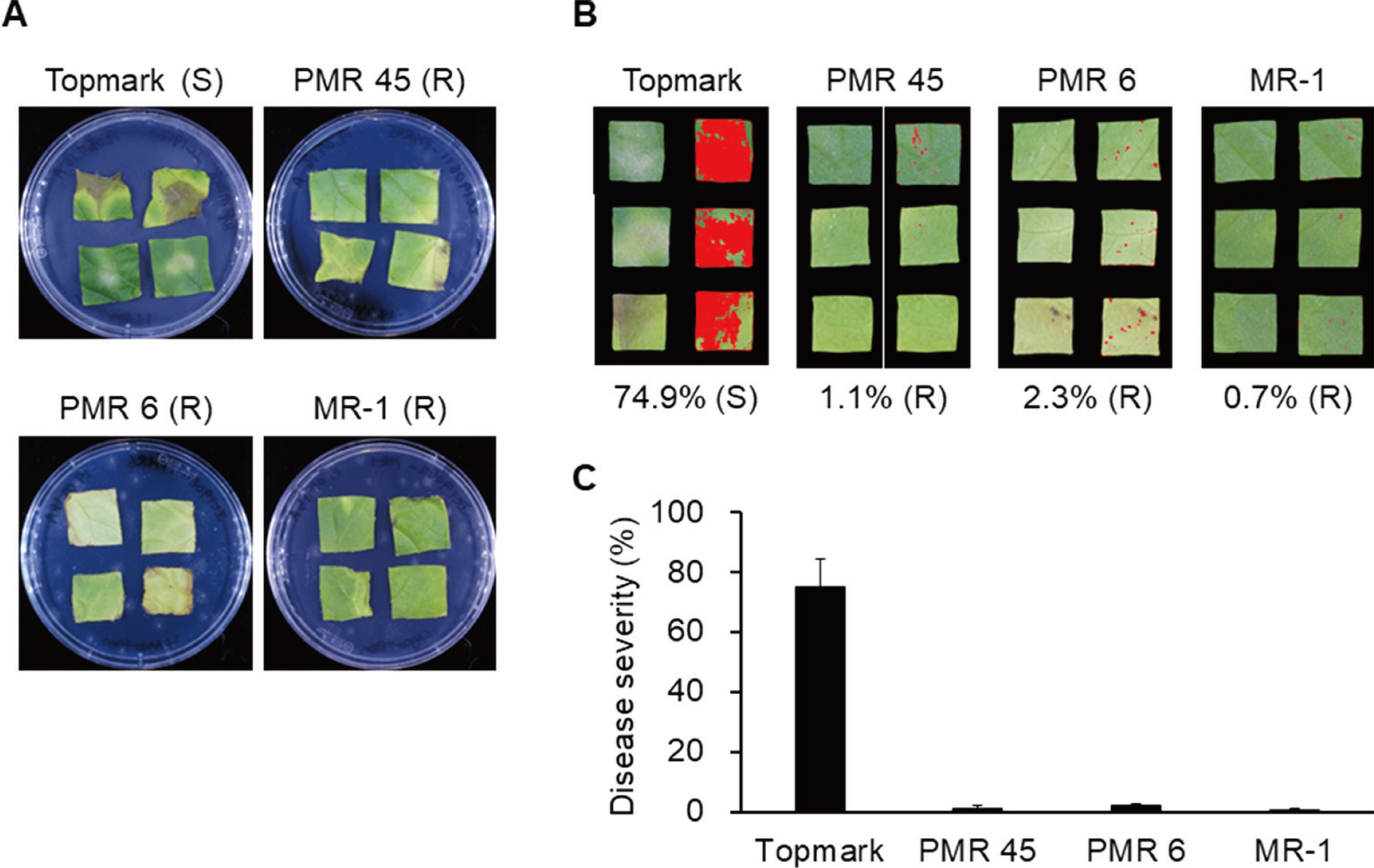
분리 균주 MI180427와 IC190611의 race를 규명하기 위한 접종 결과, MI180427는 ‘Topmark’에서는 51.1%로 감수성(S)을 보였으며, ‘PMR 45’에서 1.6%, ‘PMR 6’에서 0.6% 그리고 ‘MR-1’에서 0.3%의 발병 정도로 저항성(resistance, R)을 나타내었다(Fig. 2). IC190611는 ‘Topmark’에서 74.9% (S), ‘PMR 45’에서 1.1% (R), ‘PMR 6’에서 2.3% (R) 그리고 ‘MR-1’에서 0.7% (R)의 발병 정도를 나타내었다(Fig. 3). 따라서, 밀양과 이천에서 분리한 흰가루병균은 Zitter 등(1996)의 race 판별 기준에 따라 race 1이라는 것을 알 수 있었다 (Table 1). P. xanthii의 여러 race 중 race 1은 미국 동부지역에서 가장 흔하게 존재하는 주요한 흰가루병균이며(Zitter et al., 1996), 국내에서도 우점하는 것으로 보고된 race이다(Kim 등, 2016; Lee 등, 2014).

Inoculation of four melon differentials (Cucumis melo cv. Topmark, PMR 45, PMR 6, and MR-1) with Podosphaera xanthii isolate MI180427. (A) Representative images of leaf disks 12 days after inoculation. S, susceptible; R, resistance. (B) Representative images using disease severity analysis with ImageJ software. (C) Disease severity of four melon differentials. Data are shown as relative lesion area compared to the leaf disk. Experiments were performed in at least triplicate and repeated three times with similar results.
Inoculation of four melon differentials (Cucumis melo cv. Topmark, PMR 45, PMR 6, and MR-1) with Podosphaera xanthii isolate IC190611. (A) Representative images of leaf disks 12 days after inoculation. S, susceptible; R, resistance. (B) Representative images using disease severity analysis with ImageJ software. (C) Disease severity of four melon differentials. Data are shown as relative lesion area compared to the leaf disk. Experiments were performed in at least triplicate and repeated three times with similar results.
분리 균주 SE180328의 저항성 검정 결과, ‘Topmark’에서 68.2% (S), ‘PMR 45’에서 31.0% (S), ‘PMR 6’에서 1.7% (R) 그리고 ‘MR-1’에서 6.9% (R)의 발병 정도를 나타내었다(Fig. 4). 우리는 본 검정 결과를 기존에 보고되었던 연구 결과(Lee 등, 2014; Zitter 등, 1996)와 비교하여 SE180328를 race 2로 결론 내렸다(Table 1). 지금까지 국내의 P. xanthii의 경우 race 2로 분류 보고된 예가 없어 새로운 race가 유입 혹은 변이하고 있음을 시사하였다.
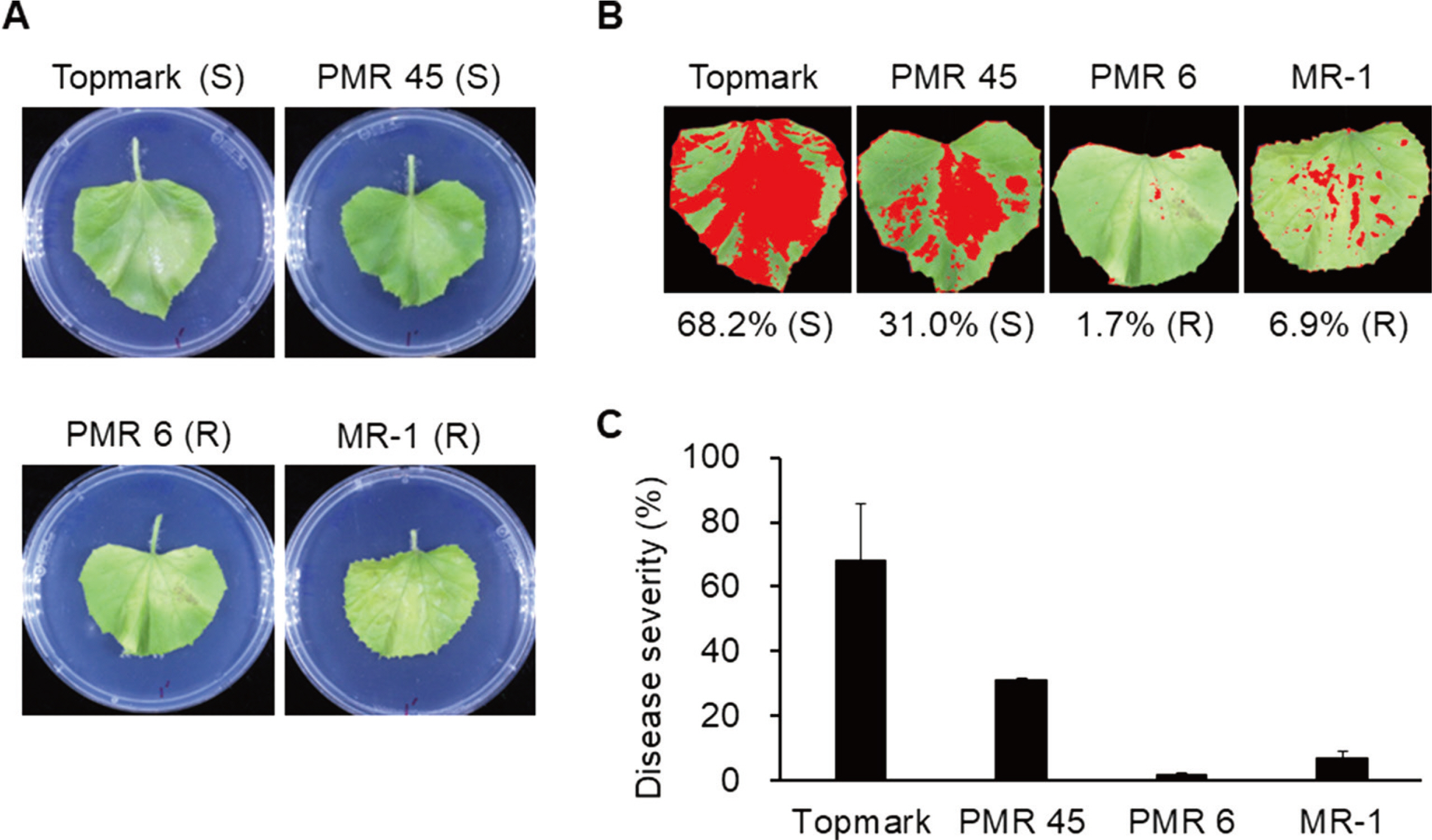
Inoculation of four melon differentials (Cucumis melo cv. Topmark, PMR 45, PMR 6, and MR-1) with Podosphaera xanthii isolate SE180328. (A) Representative images of leaf disks 12 days after inoculation. S, susceptible; R, resistance. (B) Representative images using disease severity analysis with ImageJ software. (C) Disease severity of four melon differentials. Data are shown as relative lesion area compared to the whole leaf. Experiments were repeated three times with similar results.
추가 검정을 통한 Race 2F의 보고
P. xanthii race 1과 race 2의 변이체(variants)에 대한 연구를 보면 race 1에서 8개의 변이체와 race 2에서 6개의 변이체가 보고되어 있다(Cohen 등, 2004; McCreight, 2006). Race 2의 변이체인 2a와 2b의 경우 아직 명확한 연구가 되지 않아 다른 변이체와 동일할 가능성이 제기되고 있다(Cohen 등, 2000; McCreight, 2006). 최근에는 10개의 멜론 판별 식물을 이용하여 race 2를 2S (Salinas), 2US(United States), 2F (France), 2SC (South Carolina)로 분류하였다(Tetteh 등, 2013). 미국에서는 P. xanthii race 2US가 수박에서 좀 더 많은 피해를 일으키는 것으로 보고되었으며(Davis 등, 2007; Tetteh 등, 2013), 중국에서는 멜론에 흰가루병을 일으키는 주요 P. xanthii가 race 2F임이 밝혀져(Wang 등, 2006), 국가별로 작목별로 각기 상이한 race가 우점하고 있는 것으로 보고되고 있다. 이에 기존의 연구들을(Cosme 등, 2012; McCreight, 2006; Tetteh 등, 2013) 따라서 추가적인 멜론 판별 식물인 ‘Edisto 47’와 ‘PI 414723’을 이용하여 SE180328가 race 2의 변이체인 2S, 2US, 2F, 2SC 중에서 어떤 race인지를 조사하였다(Fig. 5). Topmark는 여전히 높은 감수성(83.2%)을 보였으나 ‘Edisto 47’와 ‘PI 414723’은 각각 7.9%와 3.9%로 모두 높은 수준의 저항성을 나타냈다. 이를 바탕으로 SE180328는 P. xanthii race 2F로 최종 결론하였다(Table 1).
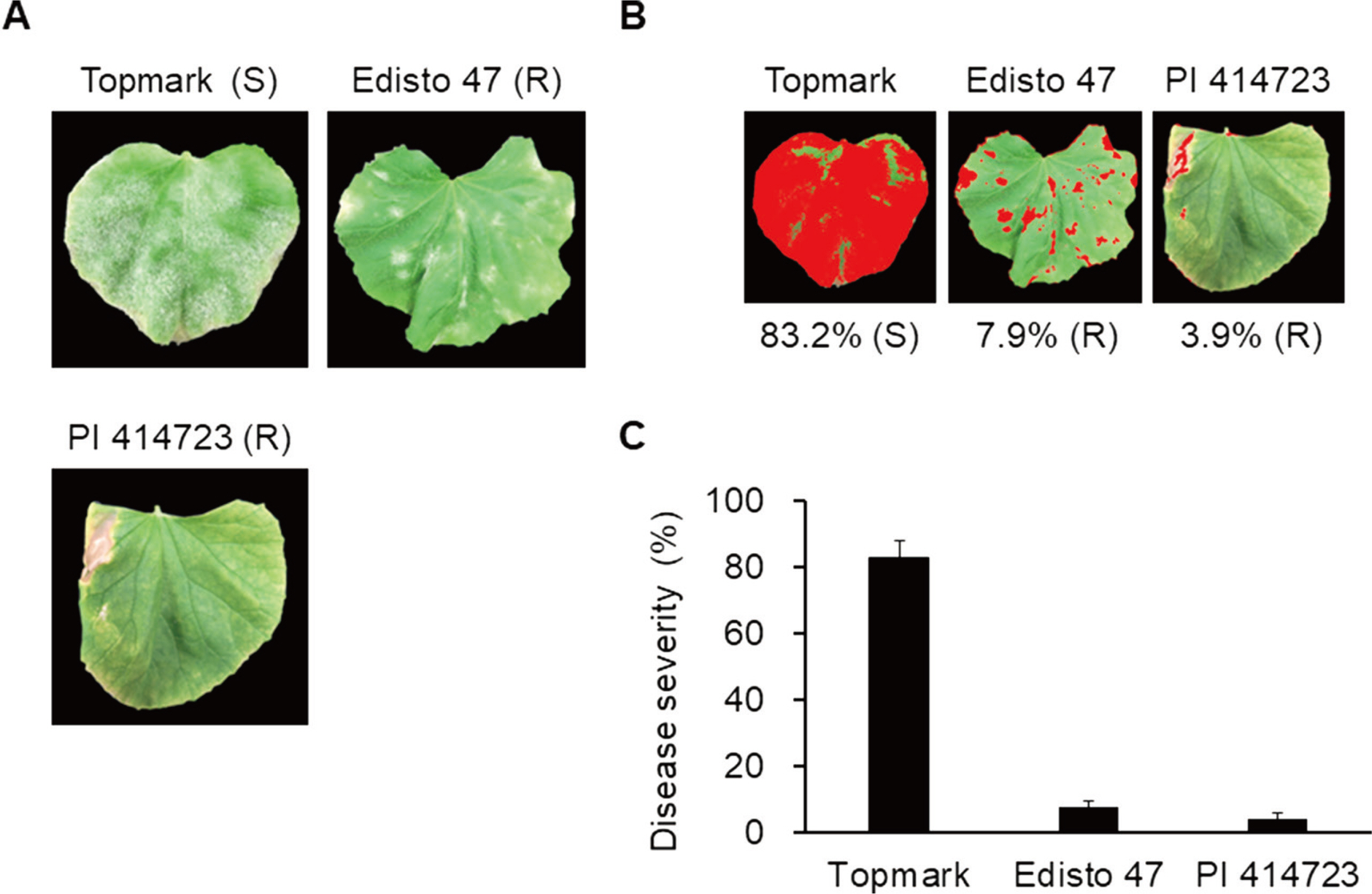
Inoculation of additional melon differentials (Edisto 47 and PI 414723) and susceptible control (Topmark) with Podosphaera xanthii isolate SE180328. (A) Representative images of leaves 20 days after inoculation. S, susceptible; R, resistance. (B) Representative images using disease severity analysis with ImageJ software. (C) Disease severity of melon differentials. Data are shown as relative lesion area compared to the whole leaf. Experiments were repeated two times with similar results.
요 약
흰가루병(powdery mildew)은 오이(Cucumis sativus)를 포함하는 박과(Cucurbitaceae) 작물에서 전 세계적으로 가장 심각한 피해를 일으키는 주요한 병 중 하나이다. 오이 흰가루병의 지속적인 발병과 방제의 어려움 때문에 그 원인 병원균을 밝히고 race를 규명하는 것이 필수적이다. 국내에서 발병하는 오이 흰가루병균의 조사를 위하여 경기도 광주(Gwangju), 경기도 이천(Icheon), 전라북도 김제(Gimje), 서울특별시(Seoul), 경상남도 밀양(Miryang) 지역에서 흰가루병이 발생한 오이 잎을 채집하였다. 형태학적, 분자생물학적 특성 조사 결과 분리된 오이 흰가루병균들은 절대 활물기생균인 Podosphaera xanthii로 동정되었다. P. xanthii의 race 규명에 사용되고 있는 멜론(C. melo) 판별 품종을 이용하여 밀양, 이천 서울에서 분리된 MI180427, IC190611, SE180328의 레이스를 각각 조사하였다. 분리균주 MI180427과 IC190611는 국내에서 가장 광범위하게 발병되고 있는 것으로 보고된 race 1으로 규명되었다. 반면, 분리균주 SE180328는 국내에서 아직까지 보고된 예가 없는 race 2로 판별되었다. SE180328의 정확한 race 판별을 위해서 추가적인 멜론 판별 품종에 접종한 결과, 흰가루병 race 2 중에서 중국 베이징의 주요 race로 알려진 race 2F로 동정되었다. 따라서 새로운 race 2F의 국내 발병을 보고하는 본 연구 결과는 향후 오이 흰가루병 저항성 품종 육성에 고려 되어야 할 기초자료가 될 것으로 생각된다.
Acknowledgments
This study was carried out with the support of ʻʻCooperative Research Program for Agriculture Science & Technology Development (Project No. PJ01421303)’’ Rural Development Administration, Republic of Korea
Notes
Conflicts of interest
No potential conflict of interest relevant to this article was reported.