훈증성 약제 처리용 토양소독기의 클로버씨스트선충 방제 효과
Efficacy of a Soil Disinfection Machine for Fumigants to Clover Cyst Nematode
Article information
Abstract
Clover cyst nematode, Heterodera trifolii, is one of the most important plant-parasitic nematode on Kimchicabbage in highland in Korea. Recently, a demand of soil disinfection machine for fumigants is increasing. This study was conducted to assess the control effects of a newly developed prototype soil disinfection machine to the cyst nematode. Two fumigants, dimethyl disulfide (DMDS) and metam sodium (MNa), were treated using the machine in a field, which was infected with the cyst nematode. After 4 weeks, control effects of fumigants were assessed as eggs hatching rates inside of cysts extracted from the soil, and as a number of females reproduced in roots of Kimchi-cabbage. DMDS (39 l/10 a) suppressed over 99.0% of the eggs hatching rate and the number of females reproduced. On the other hand, MNa (29 l/10 a) controlled the egg hatching rates from minimum 78.3% to maximum 99.4%, and the number of females from 34.7% to 49.3%. The control effects of two fumigants to clover cyst nematode by treated depth were no significant differences statistically. These results showed that DMDS treatment using the soil disinfection machine was expected to have the control effects for the clover cyst nematode.
서 론
2018년 밭작물 재배면적은 751천 ha로 전체 농경지의 45%를 차지하고 있는 주요 농업 소득원이다(Korean Statistical Infor-mation Service, 2019). 하지만, Free Trade Agreement (FTA) 등 시장개방으로 국내산 밭작물의 경쟁력이 감소하고 있어 경쟁력 확보가 더욱 필요한 시점이다(Choi 등, 2014). 밭작물의 경우 연작으로 인해 토양 병해충의 피해가 많이 발생되며, 그중 가장 피해가 많지만 잘 알려지지 않았고 또 방제가 어려운 병해충 중의 하나가 식물기생선충이다(Moens 등, 2018). 국내 밭작물에서 중요한 식물기생선충은 씨스트선충(Heterodera spp.), 뿌리혹선충(Meloidogyne spp.), 뿌리썩이선충(Pratylenchus spp.) 등이다(Cho 등, 2000; Kim 등, 2013).
씨스트선충(Heterodera spp.)은 유럽, 북미, 남미, 아시아, 호주 등 거의 모든 대륙에 분포하고 있으며(Subbotin 등, 2010), 23과 200종의 다양한 식물을 기주로 한다(Curto, 2008; Harveson과 Jackson, 2008). 그중에서 배추, 사탕무 등에 발생하는 사탕무씨스트선충(Heterodera scachtii)과 클로버씨스트선충(Heterodera trifolii)은 배추과 작물에 심각한 수확량 감소를 초래한다(Franklin, 1951). 유럽에서는 사탕무에서만 씨스트선충으로 인한 피해가 연간 9천만 달러에 이르는 것으로 추정되고 있다(Muller, 1999). 경제적 피해한계 밀도도 매우 낮아 토양 1 g당 씨스트선충 알 18개 정도의 낮은 밀도에서도 양배추 수확량의 28%가 감소되는 것으로 보고되었다(Abawi와 Mai, 1980).
국내 고랭지배추 주산지인 강원도에서는 관리병해충으로 지정된 사탕무씨스트선충과 클로버씨스트선충이 2011년, 2017년 각각 태백시, 정선군에서 처음 발생하였고, 그 피해가 정선, 삼척 등 인근 지역으로 계속 확산되고 있다(Kim 등, 2015; Mwamula 등, 2018). 강릉시, 삼척시, 태백시와 정선군의 고랭지배추 재배지를 대상으로 2013년부터 2017년까지 사탕무씨스트선충과 클로버씨스트선충 발생 조사를 수행한 결과 약 133.6 ha의 포장에 두 종의 씨스트선충에 감염된 것으로 나타났다(Kwon 등, 2018). 고랭지배추 포장에 씨스트선충 감염 시 수확량이 최대 50%까지 감소한다고 알려져 있다(Lee 등, 2013).
현재 우리나라에서 씨스트선충에 대해 등록된 훈증성 약제는 메탐소듐(metam sodium, MNa) 액제, 다조멧(dazom-et) 입제가 있다(Korea Crop Protection Association, 2019). Dimethyl disulfide (DMDS)는 씨스트선충 약제로는 아직 등록되지 않았지만 살선충제로 많이 이용되었던 methyl bro-mide 훈증제 대체제로의 사용 가능성에 대한 다양한 연구가 수행되고 있다(Abdalla와 Lear, 1975; Fritsch, 2005; Mao 등, 2019). 최근에는 감자씨스트선충(potato cyst nematode), 뿌리혹선충 등 식물기생선충에도 방제 효과가 있는 것으로 알려져 이를 이용한 식물기생선충 방제 연구가 수행되고 있다(Coosemans, 2005; Curto 등, 2014; Fritsch 등, 2014; Gómez-Tenorio 등, 2015).
지난 수십년간 씨스트선충을 대상으로 훈증성 약제에 대한 방제 연구가 수행되어 왔으나, 국내에서 훈증성 약제를 토양 속에 처리하고 동시에 비닐을 피복하는 기계화 기술에 대한 연구는 수행된 바 없다. 따라서, 본 연구에서는 훈증성 약제 처리와 비닐 피복 작업이 동시에 가능한 토양 소독기를 제작하였고, 이를 이용한 훈증성 약제 2종(DMDS, MNa)의 클로버씨스트선충 방제 효과를 알아보고자 하였다.
재료 및 방법
토양 소독기 제원.
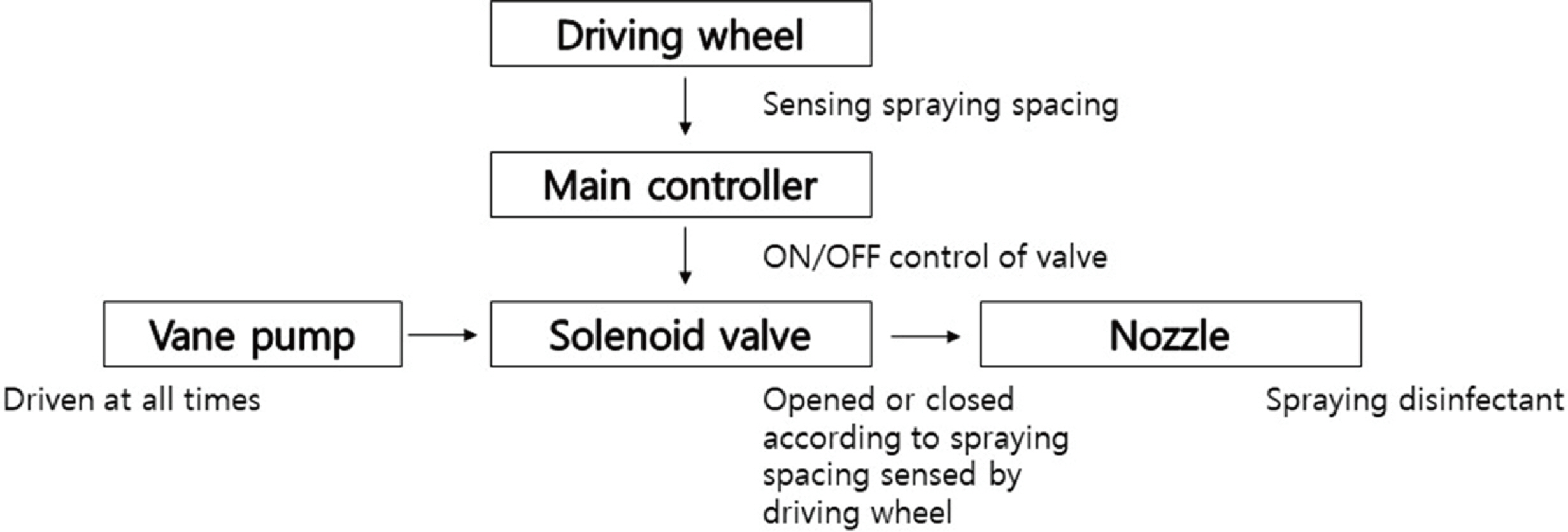
본 실험에 사용된 토양 소독기는 Fig. 1과 같이 트랙터부착형으로 두둑을 성형하고, 훈증성 약제를 지중에 살포한 뒤 비닐피복을 동시에 하도록 제작하였으며 상세 제원은 Table 1과 같다. 소독제 살포 장치는 베인펌프, 구동륜, 제어반, 솔레노이드 밸브로 구성하였다. 베인펌프는 상시 구동되며, 일정간격 마다 일정량의 약제를 분무하기 위해 구동륜에서 일정 간격이 되면 제어반에서 솔레노이드밸브를 개방하여 약제를 분사하고 닫아주는 방식으로 Fig. 2와 같이 작동되도록 약제 살포 시스템을 구성하였다. 약제 살포량은 MNa와 DMDS에 적용할 수 있도록 10 a당 30–40 l로 조절할 수 있도록 제작하였다.
시험포장 선정, 구획 및 선충 초기밀도 조사.
강원도 정선군 임계면 용산리에 위치한 클로버씨스트선충(H. trifolii) 감염 배추 포장에서 실험을 수행하였다. 시험 포장의 총면적은 약 6,300 m2로 클로버씨스트선충 초기 알 감염밀도를 조사하기 위해 2019년 7월 12일 시험 포장으로부터 330 m2당(100평) 10개 지점을 기준으로 토양시료 약 2,000 cm3를 채취하였다. 채취한 토양을 잘 섞은 다음 계량용 컵을 이용하여 토양 100 cm3를 정량하였고, 20 mesh와 60 mesh 체를 이용하여 토양 내 씨스트(cyst)를 분리하였다(Barker 등, 1985). 체에 모인 씨스트를 watch glass에 담고 실체현미경(MZ12, Leica, Wetzlar, Ger-many)을 이용하여 씨스트만 골라냈다. 골라낸 씨스트는 별도 제작한 5 ml tube에 넣고 microhomogenizer를 이용하여 알 현탁액을 만들었고 1 ml씩 3회 추출하여 평균 알 밀도를 조사하였다.
훈증성 약제 처리.
토양 소독기를 이용하여 훈증성 약제인 MNa와 DMDS 2종을 토양 표면으로부터 15 cm, 20 cm 깊이로 0.32 m/sec의 작업속도로 처리하였으며, 시험구는 Fig. 3과 같이약제를 처리하지 않은 무처리구를 포함하여 토양 소독제 종류와 처리 깊이별 3반복으로 배치하였다. 각 처리구는 토양 소독기의 유효작업폭 1.6 m로 20 m 구간을 처리하였으며 각 처리구에 살포된 약량은 Table 2와 같다. 약제처리 후 토양 소독기에부착된 장치에 의해 폭 1.6 m, 두께 0.02 mm의 검정색 저밀도PE 필름이 이랑을 따라 자동으로 피복되었다. 약제는 2019년 8월 13일 처리하였으며 4주간 훈증시킨 뒤 9월 10일 피복된 비닐을 제거하였다.

Designed plots diagram. Area of one plot, 1.6 m×20 m; ① and ②, depth of treatment ①=15 cm, ②=20 cm. P, dimethyl disulfide (DMDS); M, metam sodium (MNa); C, control; 1–3, replication.
훈증성 약제 처리구의 알 부화율 조사.
훈증성 약제 처리에 따른 약효는 씨스트선충 알 부화율과 씨스트선충 암컷 증식률로 평가하였다. 알 부화율 평가를 위해 토양 소독제 처리 4주 후 피복한 비닐을 제거하고 각 처리구별 9개 지점에서 토양시료 약 1,000 cm3를 채취하였다. 채취한 시료는 골고루 잘 섞은 다음 칭량용 컵을 이용하여 100 cm3를 정량한 다음 수돗물과 함께 토양 현탁액을 만들었다. 이를 20 mesh와 60 mesh 체에 차례로 거른 다음 60 mesh 체 위에 남은 잔류물을 watch glass에 옮겨 담았다. 실체현미경(MZ12, Leica)을 이용하여 씨스트만 골라낸 다음 각 처리구별로 크고 작은 씨스트를 20개씩 무작위로 선발하였다. 처리구별 씨스트를 변형된 Baermann 깔때기에 올려놓고 1주 간격으로 매회 부화한 씨스트선충 2기 유충을 수집하였으며 4회 반복하였다. 마지막 2기 유충 채집 후 깔때기 위에 남은 씨스트를 모두 수집하여 5 ml tube에 넣고 microhomogenizer를 이용하여 알 현탁액을 만든 다음 실체현미경(MZ12, Leica) 아래서 부화하지 않은 알 수를 조사하였다. 알 부화율은 전체 알 수(4주간 부화한 씨스트선충 2기 유충수와 부화하지 않은 알 수의 합)에 대한 4주간 부화한 씨스트선충 2기 유충 수의 비율을 계산하여 산출하였다.
훈증성 약제 처리구의 암컷 증식률 평가.
씨스트선충 암컷 증식률 평가는 훈증성 약제를 처리한 포장의 각 처리구별 토양을 채취하여 포트실험으로 수행하였다. 각 처리구별 채취 토양을 각각 500 cm3씩 정량하고 수돗물과 함께 토양 현탁액을 만들었다. 현탁액을 20 mesh와 60 mesh에 차례로 거른 다음 60 mesh 체 위에 남은 잔류물을 watch glass에 넣고 실체현미경(MZ12, Leica) 아래서 씨스트를 골라낸 다음 5 ml tube에 넣고 microhomogenizer를 이용하여 알 현탁액을 만들었다. 실체현미경에서 알 현탁액 1 ml에 들어있는 씨스트선충 알 수를 계수한 다음 수돗물을 첨가하여 1 ml당 알 1,000개의 밀도로 조정하였다. 멸균된 토양(강모래9:황토1) 350 cm3가 들어있는 직경 7 cm 플라스틱 포트에 배추묘(20일묘)를 정식한 다음 알 현탁액 1 ml를 접종하였다. 씨스트선충 알을 접종한 배추 포트는 평균기온 25°C, 상대습도 40–50%, 광주기 14:10으로 유지되는 항온룸의 식물생장베드에 완전임의배치하였고, 필요에 따라 물을 공급하며 50일간 재배하였다. 선충 알 접종 50일 후 형성된 암컷수를 확인하기 위해 포트 토양 전량(350 cm3)을 20 mesh와 60 mesh 체에 차례로 걸렀다. 60 mesh 체 위에 남은 잔류물을 watch glass에 넣고 실체현미경 아래서 씨스트선충 암컷을 계수하였다. 배추 뿌리에서 완전히 떨어지지 않은 씨스트선충 암컷은 뿌리를 실체현미경으로 관찰하며 직접 계수하였다.
통계 분석.
훈증성 약제 종류와 약제 처리 깊이 간의 상호작용 여부를 확인하기 위해 엑셀 데이터분석 툴을 이용하여 이원배치 분산분석(two-way ANOVA)을 수행하였다. 이원배치 분산분석 결과를 토대로 약제 종류별 알 부화율과 암컷 증식수에 따른 약제 방제 효과는 R 통계 패키지(https://www.r-project.org)를 이용하여 Tukey’s studentized range (honestly significant difference, HSD) test를 수행하였고, 약제 처리 깊이에 따른 약제 방제 효과는 R 통계 패키지를 이용하여 T-test를 수행하였다.
결 과
알부화율 검정에 따른 클로버씨스트선충 방제 효과.
시험포장의 클로버씨스트선충 초기 알 감염밀도는 토양 100 cm3 당 307개로 방제 약제 시험을 하기에 충분한 밀도로 조사되어 계획대로 실험을 수행하였다. 알부화율에 따른 방제효과를 분석한 결과는 Table 3과 같다. 이원배치 분산분석 결과 클로버씨스트선충 알 부화율에 대한 토양 소독제 종류와 약제 처리 깊이 간의 상호작용은 나타나지 않았다(df=2, F=2.17, P=0.157). 훈증성 약제 종류에 따른 알 부화율은 통계적으로 유의미한 차이를 보였으나(df=2, F=9.13, P=0.004), Tukey’s HSD test 결과 MNa와 DMDS 간의 알 부화율(15 cm: 5.6%, 0.0%; 20 cm: 0.4%, 0.0%)은 차이가 없는 것으로 나타났다. 토양 소독제 처리 깊이에 따른 알 부화율은 통계적으로 유의미한 차이를 보이는 것으로 나타났다(df=1, F=5.07, P=0.044). 그러나 이러한 차이는 무처리 간의 알 부화율 차이에 의한 것으로 동일한 약제 종류 내에서 처리 깊이에 따른 알 부화율의 차이는 없는 것으로 나타났다. 통계적으로 유의미한 차이를 보이진 않았으나 방제가(control value)는 15 cm 깊이로 약제를 처리했을 때보다 20 cm 깊이로 약제를 처리했을 때 각각 78.3%, 99.4%로 더 높게 나타났다.
암컷 증식수에 따른 클로버씨스트선충 방제 효과.
암컷 증식수에 따른 클로버시스트선충 방제 효과를 분석한 결과는 Table 4와 같다. 이원배치 분산분석 결과에서 클로버씨스트선충 암컷 증식수에 대한 토양 소독제 종류와 약제 처리 깊이 간의 상호작용은 나타나지 않았다(df=2, F=2.85, P=0.097). 훈증성 약제 종류에 따른 클로버씨스트선충 암컷 증식수는 통계적으로 유의미한 차이(df=2, F=12.61, P=0.001)를 보였다. DMDS와 MNa를 15 cm 깊이로 처리하였을 때 무처리(15 cm) 대비 암컷 증식수가 99.1%, 49.3% 감소하였으나, Tukey’s HSD test 결과 DMDS와 무처리(15 cm) 간에만 통계적으로 유의미한 차이가 있었다. 약제 종류(DMDS와 MNa)에 따른 암컷 증식수는 통계적으로 유의미한 차이는 없는 것으로 나타났다. 한편, 20 cm 깊이로 DMDS와 MNa를 처리하였을 때에는 무처리(20 cm) 대비 암컷 증식수가 각각 100.0%, 34.7% 감소하였지만 통계적 유의성 있는 차이는 없었다. 토양 소독제 처리 깊이에 따른 클로버씨스트선충 암컷 증식수는 통계적으로 유의미한 차이를 보이지 않는 것으로 나타났다(df=1, F=1.86, P=0.198).
고 찰
사탕무씨스트선충은 씨스트 내부에 존재하는 알의 부화율이나 부화한 2기 유충을 대상으로 약제 방제 효과를 평가하는 방법이 이용되고 있으며(Kim 등, 2016; Steele, 1978), 클로버씨스트선충은 암컷 증식수를 이용하여 약제 방제 효과를 평가하는 것이 더 실제적이라는 연구 결과도 있다(Lee 등, 2018). 따라서, 본 연구에서는 클로버씨스트선충을 대상으로 씨스트 내부 알의 부화율과 암컷 증식 수 두 가지를 모두 이용하여 약제 방제 효과를 평가하고자 하였다. 클로버씨스트선충은 사탕무씨스트선충과 유연관계가 매우 높음으로 동일한 기준으로 약제 방제 효과를 평가해도 두 종류의 씨스트선충에 동일하게 적용될 것으로 판단된다.
최근 DMDS는 감자씨스트선충, 당근씨스트선충(carrot cyst nematode), 뿌리혹선충류(root-knot nematodes), 뿌리썩이선충류(root-lesion nematodes) 등의 선충 방제 효과가 알려지면서 많은 선충 연구자의 방제 연구 소재로 이용되고 있다(Coosemans, 2005; Curto 등, 2014; Fritsch 등, 2014; Gómez-Tenorio 등, 2015). 국내에서도 시설재배지에서 주로 문제되고 있는 뿌리혹선충류를 대상으로 DMDS의 방제 연구가 수행된 바있다(Korea Crop Protection Association, 2019). 그러나, 세계적으로 클로버씨스트선충(H. trifolii)을 대상으로 수행된 연구결과는 없었다.
본 연구에서 새로 개발한 토양 소독기를 이용해서 DMDS를 15 cm, 20 cm 처리 시 클로버씨스트선충 알 부화율에 대한 방제가가 99% 이상으로 나타나 이 처리 방법이 클로버씨스트선충에 대한 매우 높고 안정적인 방제 효과를 보여주었다(Table 4). 따라서 본 연구에 사용된 토양 소독기를 이용하여 DMDS를 10 a당 40 l토양 처리하면 국내 강원도 고랭지 배추 재배지에서 문제되고 있는 클로버씨스트선충의 방제가 가능할 것으로 판단된다.
약제 처리 시 작업속도인 0.32 m/sec로 연접법을 이용한 작업능률을 분석한 결과(Lee 등, 2020) 토양 소독기의 작업능률은 0.9 h/10 a로 나타났다. 이는 국내에서 관행 Dazomet 입제를 비료살포기로 살포한 후 비닐피복을 하는 작업에 비해 약 40%의 노력절감 효과가 있으며, 약제 살포 및 비닐피복 2가지 작업을 동시에 수행할 수 있어 처리 효율이 높은 것으로 판단된다. 새로 제작한 토양 소독기의 효율을 높이기 위해서는 고속 살포 메커니즘에 대한 추가 연구가 필요할 것으로 판단된다.
MNa (SL)는 DMDS에 비하여 암컷 증식률에서 방제가가 낮았다. 즉, 15 cm, 20 cm 처리 시 알 부화율은 낮은 편이었으나(Table 3), 암컷 증식률이 높아 방제가는 49.3%, 34.7%로 비교적 낮았다. 연구에 의하면 MNa (SL) 10 a당 90 l 처리는 배추에 발생하는 씨스트선충의 평균 암컷 증식수를 효과적으로 억제하였다(Korea Crop Protection Association, 2019; Lee 등, 2018). 계산에 의하면 본 연구에서 처리된 약량은 10 a당 29.125 l (32 m2에 0.932 l 처리)로 처리약량이 증가되면 충분한 방제 효과를 가져올 것으로 예상된다. 네덜란드에서 MNa 전용 살포기가 개발된 바 있으므로(Rabasse, 2004), 본 연구에서 제작한 토양 소독기의 10 a당 살포량을 90 l까지 처리할 수 있도록 개선하면 씨스트선충 방제를 위한 MNa 전용 살포기로도 사용이 가능할 것이다. 따라서, MNa에 적용하기 위해 처리량을 90 l/10a까지 높이기 위한 시작기의 펌프 유량, 살포간격 조절 범위 등의 개선이 필요할 것으로 생각된다.
훈증성 약제는 처리 방법에 따라 살선충 효과가 달라질 수 있다. 피복한 비닐의 종류도 훈증성 약제의 식물기생선충 방제 효과 차이를 나타내는 요인 중의 하나이다. Ou 등(2006)의 연구에서 피복용 비닐 종류 중 하나인 불투과필름(vertually im-permeable film, VIF)가 polyethylene film (PE)를 피복했을 때보다 MNa의 휘발성을 감소시켰다고 하였으며, Yan 등(2019)은 불침투성 비닐을 덮고 관개 시스템을 이용하여 약제를 처리하여도 뿌리혹선충에 방제 효과가 있다고 보고하였다. 또한, MNa를 1,3-D, chloropicrin과 조합하여 처리한 경우 단일 처리보다 뿌리혹선충 방제 효과가 더 높게 나타났다고 하였다(Desaeger 등, 2008). 본 연구는 단일 제제를 일반 두께 0.02 mm의 검정색 저밀도 PE 필름으로 피복한 실험으로 추후 복합제제와 피복제로 VIF을 사용하면 지금보다 더 낮은 처리 약량에서도 효과적인 방제 효과를 거둘 수도 있지 않을까 예상해본다.
본 연구에서 고려한 요인 중의 하나인 토양 소독제의 처리 깊이는 클로버씨스트선충 알의 부화율과 암컷 증식수에 통계적으로 유의미한 차이를 보이지 않아 큰 영향을 주지 않는 것으로 나타났다. 이 결과에 따라 토양 소독기를 이용하여 클로버씨스트선충을 방제할 시에는 토양 소독제의 처리 깊이는 작토층인 15 cm에서 20 cm 사이에 처리하면 무방할 것으로 생각된다.
요 약
클로버씨스트선충은 국내 고랭지배추 재배지에서 가장 문제되고 있는 식물기생선충 중 하나이다. 본 연구는 새로 개발한 훈증성 약제 처리기의 성능을 시험하기 위하여 고랭지배추 문제 클로버씨스트선충을 대상으로 훈증성 약제 2종(dimethyl disulfide [DMDS], metam sodium [MNa])의 살선충 활성을 검정하였다. 훈증성 약제의 방제 효과는 약제 처리 4주 후 처리구별 토양으로부터 씨스트를 채집하여 클로버씨스트선충 알 부화율을 조사하였고, 씨스트 내부의 알을 배추에 접종하여 얻은 암컷 증식 수를 조사하여 평가했다. DMDS (39 l/10 a)는 클로버씨스트선충 알 부화율과 암컷 증식 수를 각각 99.0% 이상 억제하였으나, MNa (29 l/10 a)는 알 부화율은 78.3–99.4%, 암컷 증식 수는 34.7–49.3% 정도 억제하였다. 훈증성 약제 2종의 처리 깊이에 따른 클로버씨스트선충 알 부화율과 암컷 증식수는 통계적으로 유의미한 차이를 보이지 않았다. 본 연구에서 개발된 토양 소독기를 이용하여 DMDS를 토양 처리하면 클로버씨스트선충 방제 효과가 있을 것으로 보인다.
Acknowledgments
This research was supported by a grant (Project No. 013391) from Rural Development Administration, Republic of Korea.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.