 |
 |
| Res. Plant Dis > Volume 26(1); 2020 > Article |
|
요 약
2019년 7월 안동지역 노지 재배지에서 복숭아에 과실 썩음 병 피해가 발생하였다. 피해 과실에서는 병이 진전됨에 따라, 썩음증상과 함께, 흰색과 자주색을 띄는 균사 및 포자가 관찰되 었다. 병원균을 순수 분리한 뒤, 건전한 복숭아 과일에 접종하 였을 때 동일한 과실 썩음 증상을 유도하였다. 분리된 병원균의 internal transcribed spacer (ITS), translation elongation factor 1-alpha (TEF) 그리고 β-tubulin (β-TUB) sequence 분석을 통해 Fusarium avenaceum으로 동정되었다. 따라서, 이 증상을 Fusarium avenaceum에 의한 “복숭아 과실 썩음병”으로 명명하 고자 한다. 분리된 균주는 농촌진흥청 국립농업과학원 미생물 은행[Korean Agricultural Culture Collection(KACC)]에 기탁되었다(KACC accession number 48936).
ABSTRACT
In July 2019, typical rot symptom was observed on peach fruits harvested from the fields at Andong, Korea. As the disease progressed, white and purple colored mycelial mat developed on the surface of the infected fruits. A causal pathogen was isolated from the infected fruit and cultured on potato dextrose agar media for identification. Fungal colonies on potato dextrose agar produced 3 pigments, including purple, yellow, and white colors. The isolate incited fruit rot symptoms on artificially inoculated peach fruits, from which the same fungus was isolated, fulfilling Koch’s postulates. Based on the morphological characteristics and sequence analysis of rDNA internal transcribed spacer, translation elongation factor 1-alpha, and β-tubulin, the causal agent of the disease was identified as Fusarium avenaceum. This study is the first report of fruit rot of peach fruits caused by Fusarium avenaceum in Korea.
복숭아(Prunus persica L.)는 장미과(Rosaceae) 벚나무속 (Prunus)에 속하며, 사과, 감, 배와 함께 우리나라의 주요 경제 과수로(Bak 등, 2017) 잼이나 젤리 등 다양한 용도로 쓰인다. 현재 2019년 기준 한국에서 복숭아 재배면적은 20,636 ha이고, 그 중 경북지역에서는 9,578 ha (46.4%)에서 재배되고 있다 (Korean Statistical Information Service, 2019). 현재 국내 복 숭아에서 발생하는 것으로 보고된 병은 잿빛무늬병(Rhizopus stolonifera), 잿빛곰팡이(Botrytis cinerea), 줄기썩음병(Botros- phaeria dothidea), 그을음병(Capnophaeum fuliginodes), 탄저병(Glomerella cingulata), 잎오갈병(Taphrina deformans) 등으 로 보고되었다(Arrebola 등, 2010; The Korean Society of Plant Pathology, 2009). 또한 복숭아에 7종의 바이러스와 바이로이 드(Apple chlorotic leaf spot virus [ACLSV], Apple stem grooving virus [ASGV], Cucumber mosaic virus [CMV], Hop stunt viroid [HSVd], Little cherry virus 1 [LChV-1], Peach latent mosaic viroid [PLMVd], Prunus necrotic ringspot virus [PNRSV])가 발생한다고 국내에 보고되었다(Bak 등, 2017).
2019년 7월에 경상북도 안동시의 농가에서 재배 중인 복숭 아에서 흰색, 분홍색의 균사체로 인한 과실부패증상이 나타났다. 본 연구에서는 복숭아 과실 썩음병의 병원균을 분리하고 동정하기 위해 형태적 특징과 internal transcribed spacer (ITS), translation elongation factor 1-alpha (TEF), beta-tubulin (β-TUB) 유전자의 염기서열분석을 수행하였으며, 그 결과 분리된 병원균을 Fusarium avenaceum으로 동정하였으며, 병원성 을 증명함으로써 해당 병원균이 복숭아 과실 썩음병의 원인균임을 증명하였다.
경상북도 안동시의 남후면 하아리(36° 33'08.2''N, 128°34'02.0''E)에서 수확된 복숭아에서 과실 썩음 병 증상이 관찰되었다(Fig. 1A). 과실 썩음병을 일으키는 병원 균을 분리하기 위해 부패된 과실 부위를 소독한 메스로 잘라 1% NaOCl 용액으로 30초간, 70% 에탄올로 30초간 침지하여 표면살균을 실시하였다. 이후 멸균수로 3회 세척하고, 남은 수분을 살균된 필터페이퍼를 이용하여 제거하였다. 이렇게 준비된 이병 과실 샘플을 50 μg/ml streptomycin을 포함하는 감자 한천배지(potato dextrose agar with streptomycin, PDASTP)에 치상하고 25°C에서 3일간 배양하였다. 3일 후 자란 곰팡이의 균사체 선단부를 PDASTP에 옮기고 순수배양하였다(Fig. 1B, C). 분리한 균주를 PDA에서 배양했을 때 25°C에서 매우 빨리 자랐으며 7일 후 직경 9 cm의 Petri dish를 가득 채웠다. 분리된 균주는 배양 초기에 흰색의 균사를 형성하였으며, 배양을 진행 함에 따라 3일째부터는 배지의 중심부로부터 노란색에서 보라색을 띠는 것이 관찰되었다.
분리된 균주의 병원성을 검정하기 위하여 건 전한 복숭아를 70% 에탄올 용액으로 표면살균하고, 멸균수 로 세척한 후 자연 건조하였다. 복숭아에서 순수 분리된 균주 를 PDA 배지에서 7일간 배양시킨 후, 배양시킨 곰팡이 조각을 cork borer를 이용하여 균사체를 분리하고(직경 0.8 cm), 주사 기 바늘을 이용해 상처를 낸 복숭아 표면에 접종하였다. 접종한 복숭아는 플라스틱 용기에 담아 25°C 인큐베이터에 두면서 병진전 상황을 조사하였다. 플라스틱 용기는 살균된 페이퍼 타올을 깔고 멸균수를 넣어 습실이 유지되게 하였다. 접종한 과실은 1일 후부터 병징이 나타나기 시작하였으며 4일 후에는 3 cm 이상의 병징을 보였으며, 10일 후에는 과실의 1/2 이상 이 썩었다(Fig. 1D). 병 발생이 된 부위에서 병원균을 분리한 결과 처음과 같은 곰팡이가 균일하게 분리되었으며, 염기서열 분 석을 통해 같은 곰팡이임을 확인하였다.
Fusarium 균주를 4개의 다른 배지에서 배양하였다: malt extract agar (31.28 g MEA in 1 l of deionized water; MBcell, Seoul, Korea), potato dextrose agar(39 g PDA in 1 l of deionized water; MBcell), oatmeal agar (72.5 g OA in 1 l of deionized water; MBcell), and sabouraud dextrose agar (65 g SDA in 1 l of deionized water; MBcell) (Aktaruzzaman 등, 2018; Choi 등, 2015; Kim 등, 2015; Lee 등, 2016). 배양한 후 플레이트를 25°C 인큐베이터에서 10일 동안 두며 관찰하였다. 10일 후 관찰한 결과 MEA, PDA, OA 그리고 SDA 배지에서 각각 직경이 2.8-3.2 cm (평균, 3 cm), 1.7-1.95cm (평균, 1.9 cm), 2-2.75 cm (평균, 2.4 cm), 2.4-3.1 cm (평균,2.8 cm)였다(Fig. 2). 성장속도는 MEA에서 가장 빨랐으며 SDA, OA, PDA 순으로 성장속도가 빨랐다. 이에 반해, PDA에서 배양하였을 때 균주에서 보라색 색소침착이 가장 빠르고 높은 수준으로 나타났다.
분리된 균주의 형태적 특성 을 관찰하기 위해 PDASTP에서 배양된 균주가 사용되었다. 균주 의 균사는 유격벽균사(septate hypha)로 관찰되었다(Fig. 3A). 균주의 소형분생포자(microconidia)는 넓이는 약 2.2-4.5 µm (평균, 3.4 µm)였으며, 길이는 2.0-6.9 µm (평균, 4.5 µm)로 관 찰되었다(Fig. 3B). 소형분생포자는 격벽을 가지고 있지 않았다(Fig. 3B). 또한, Fusarium spp.에서 전형적으로 나타나는 낫모양 (sickle shaped)의 대형분생포자(macroconidia)가 관찰되었다 (Fig. 3C). 대형분생포자는 넓이는 약 3.0-4.5 µm (평균, 3.8 µm) 였으며, 길이는 32-43.5 µm (평균, 37.5 µm)로 관찰되었고, 3-5 개의 격벽을 가지는 것으로 관찰되었다. 후벽포자(chlamydospore)는 원형에 가까운 타원 모양으로 격벽이 없었으며, 직경은 9.3-13.3 µm (평균, 11.5 µm)로 관찰되었다(Fig. 3D, E). 이와 같이 병원균을 분리•배양하여 형태적 특징과 병원성 검정을 조사한 결과 Fusarium sp.으로 동정되었다.
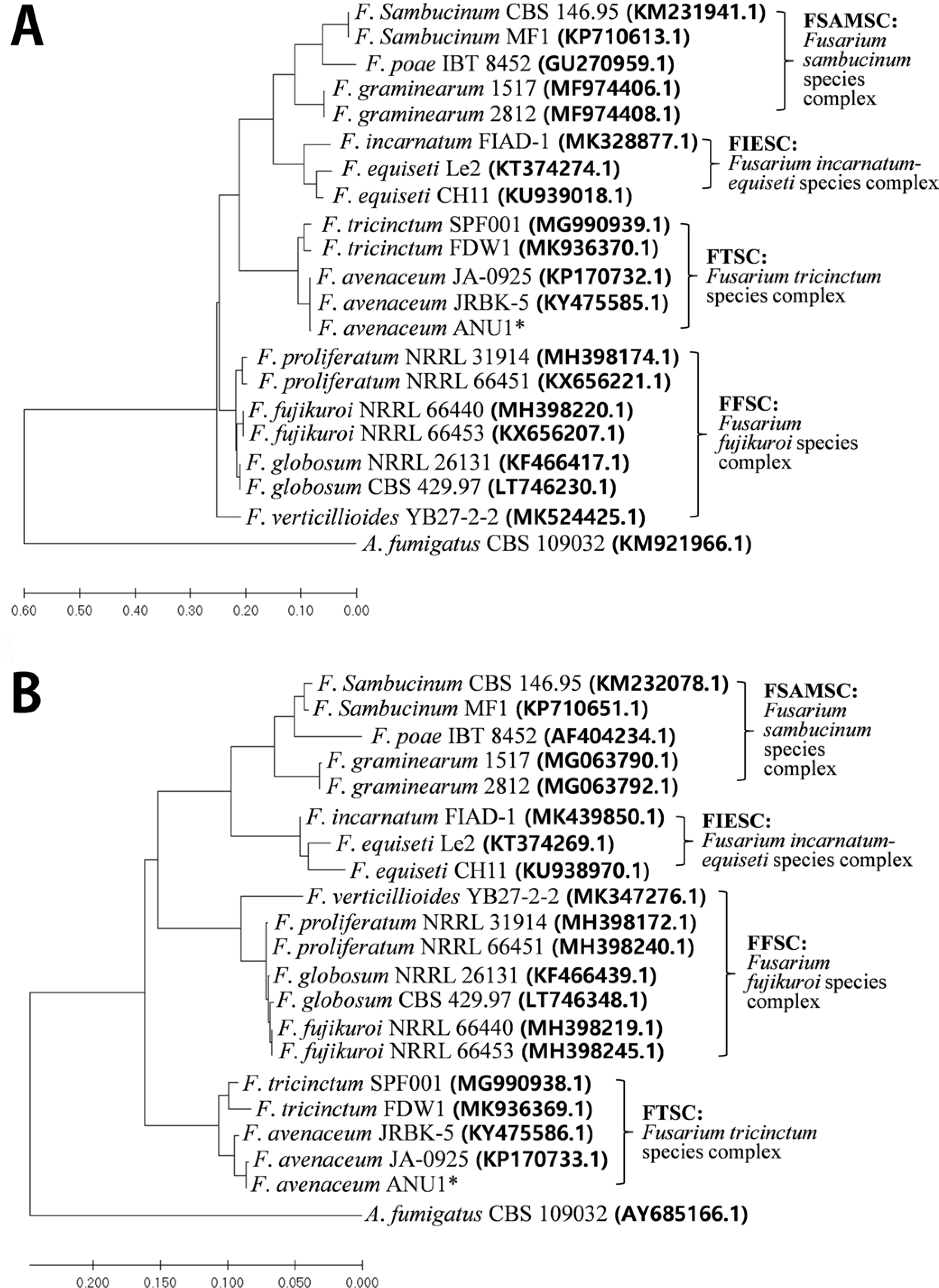
분리된 균주를 분자생물학적으로 동정하기 위해 균주를 PDASTP에서 1주일 동안 배양한 후 HiGene Genomic DNA Prep Kit (BIOFACT, Daejeon, Korea)를 이용하여 genomic DNA를 분리하였고, ITS1/ITS2 primer를 사용하여 ITS 유전자를 증폭하 였다(Kim 등, 2018; Lee 등, 2018; White 등, 1990) (Table 1). 증폭된 PCR 산물은 1.5% agarose gel에서 전기영동하여 band 를 확인한 후, PCR purification kit (BIOFACT, Daejeon, Korea) 를 이용하여 정제한 뒤 염기서열 분석에 이용되었다(Solgent, Daejeon, Korea). Blastn 프로그램을 (https://blast.ncbi.nlm.nih.gov/Blast.cgi?PAGE_TYPE=BlastSearch) 이용하여 ITS sequence (NCBI accession no. MT071567)를 분석한 결과 Fusarium tricinctum 및 F. aveanceum 두 종에서 모두 99.8% 이상의 상동성을 나타내어, ITS sequence 분석만으로는 종명을 결정할 수 없었다. 따라서, 추가적으로 ef1/ef2와 tubT1/tubT22 primer 를 사용하여(Table 1), TEF와 β-TUB 유전자를 추가로 분석하였다(O’Donnell와 Cigelnik, 1997; O’Donnell 등, 1998). Blastn 프로그램을 이용하여 본 연구에서 분리된 균주의 TEF sequence (NCBI accession no. MT118719)를 분석한 결과, F. aveanceum의 TEF sequence와는 최고 99.67%의 상동성을 나타내었으 나(sequence coverage 100%), F. tricinctum의 TEF sequence 와는 98% 미만의 상동성을 나타내었다(sequence coverage 91%). Blastn 프로그램을 이용하여 β-TUB sequence (NCBI accession no. MT118720)를 분석한 결과에서도 F. aveanceum 의 β-TUB sequence와는 최고 99.64%의 상동성을 나타내었으나(sequence coverage 99%), F. tricinctum의 β-TUB sequence 와는 98.5% 미만의 상동성을 나타었다(sequence coverage93%). 따라서 분리된 병원균은 F. aveanceum isolate ANU1 으로 명명되었다. 최종적으로 MEGA-X program을 이용하여 maximum likelihood 방법을 사용하여 계통수를 작성하였다 (Kumar 등, 2018). TEF 및 β-TUB 유전자의 염기서열을 이용하여 분자계통학적 유연관계를 분석한 결과 복숭아과실썩음병균 Fusarium avenaceum isolate ANU1은 Fusarium tricinctum species complex에 속하는 것으로 나타났다(Fig. 4). 국내 다른 작물에서 F. avenaceum에 의한 발생하는 병은 잘 알려져 있지않다. 그러나 최근 연구에 따르면, 귀리의 주산지인 북유럽과 캐나다에서 F. acuminatum, F. avenaceum, F. culmorum, F. poae, F. langsethiae에 의한 붉은빵곰팡이병이 증가 추세에 있는 것으로 보고되었으며, 국내 귀리에서도 F. avenaceum이 분리되었다 (Choi 등, 2019).
Acknowledgments
This work was supported by a grant from 2019 Research Fund of Andong National University.
Fig. 1
Fruit rot disease caused by Fusarium avenaceum ANU1 on peach fruit. (A) A typical rot disease symptom of peach fruit collected from the field in Andong area. (B, C) Growth of pathogen isolated from the diseased peach fruit on potato dextrose agar media. Picture was taken 7 days after inoculation. (D) Pathogenicity test of the isolated pathogen on peach fruit. Typical disease symptoms developed on peach fruits 10 days after inoculation. For pathogenicity test, healthy peach fruits were wounded and inoculated with the isolated pathogen and stored at room temperature (25°C) as indicated above.
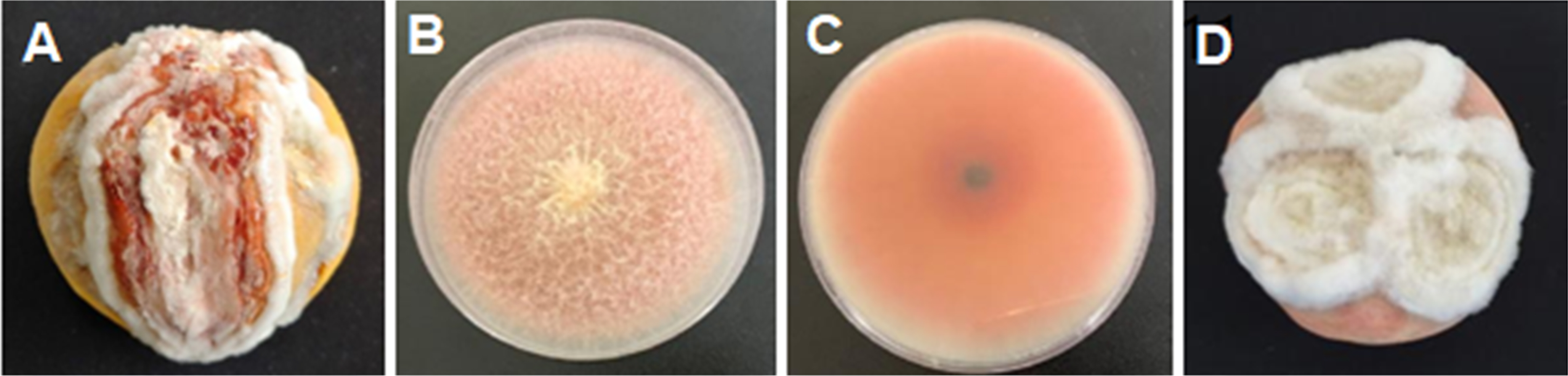
Fig. 2
Colony morphology of Fusarium avenaceum ANU1 on malt extract agar (A, E), potato dextrose agar (B, F), oatmeal agar (C, G), and sabouraud dextrose agar (D, H) media. Pictures were taken 3 (A-D) and 10 (E-H) days after inoculation. Upper and lower rows of each figures are upside and downside views of mycelial growth on each media, respectively. The isolate was inoculated on indicated media and incubated 10 days at 25°C. SDA, sabouraud dextrose agar; PDA, potato dextrose agar; OA, oatmeal agar; MEA, malt extract agar.
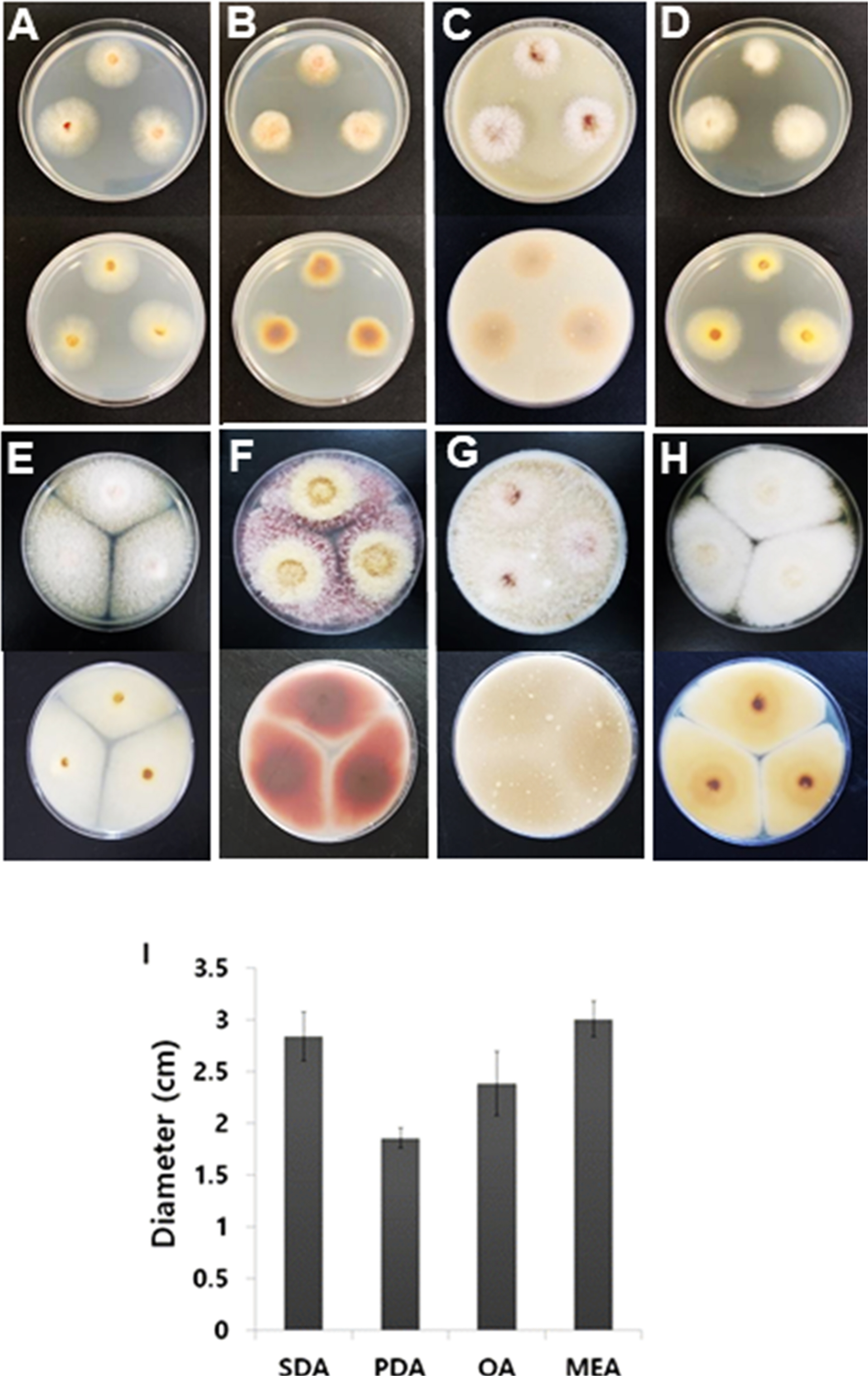
Fig. 3
Morphological characteristics of Fusarium avenaceum ANU1. (A) Hyphae on potato dextrose agar. (B) Microconidia. (C) Macroconidia. (D, E) Chlamydospores. Scale bars=20 µm (A-E).
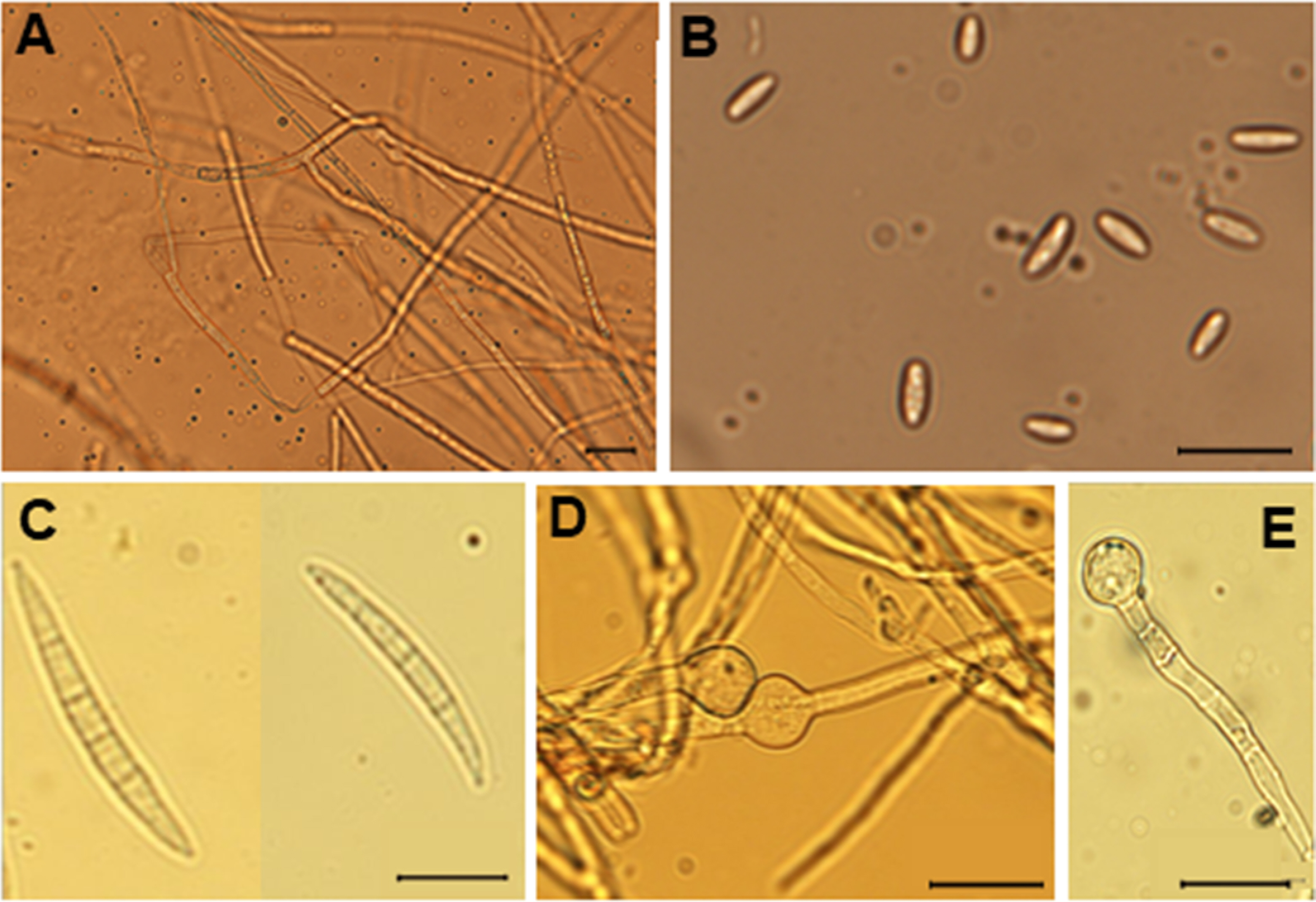
Fig. 4
Phylogenetic tree of Fusarium avenaceum isolate ANU1 and other Fusariumspp. Phylogenetic trees were generated by Maxi mum Likelihood method analysis of translation elongation factor 1-alpha (TEF) (A) and beta-tubulin (β-TUB) (B) sequences of Fusari um spp. in MEGA X program. The nucleotide sequence of Aspergil lus fumigatusstrain CBS 109032 were used as the outgroup to root the phylogeny. The scale bar indicates nucleotide substitutions per site. TEFand β-TUB sequences of 4 different Fusariumspecies com plexes, Fusarium fujikuroi species complex (FFSC), Fusarium incar natum-equisetispecies complex (FIESC), Fusarium tricinctum spe cies complex (FTSC), and Fusarium sambucinum species complex (FSAMSC), were used.
References
Aktaruzzaman, M., Afroz, T., Lee, Y.-G. and Kim, B.-S. 2018. Morphological and molecular characterization of Fusarium tricinctum causing postharvest fruit rot of pumpkin in Korea. J. Gen. Plant Pathol 84: 407-413.

Arrebola, E., Sivakumar, D., Bacigalupo, R. and Korsten, L. 2010. Combined application of antagonist Bacillus amyloliquefaciens and essential oils for the control of peach postharvest diseases. Crop Prot 29: 369-377.

Bak, S., Seo, E., Kim, S. Y., Park, W. H. and Lee, S.-H. 2017. First report of Apricot pseudo-chlorotic leaf spot virus infecting peach trees in South Korea. Res. Plant Dis 23: 75-81. (In Korean)

Choi, J.-H., Nah, J.-Y., Jin, H.-S., Lim, S.-B., Paek, J.-S., Lee, M.-J. et al. 2019. Identification and chemotype profiling of Fusarium species in Korean oat. Res. Plant Dis 25: 157-163. (In Korean)

Choi, I.-Y., Kim, J. and Ju, H.-J. 2015. First report of Fusarium wilt caused by Fusarium oxysporum on Kohlrabi in Korea. Res. Plant Dis 21: 27-31. (In Korean)

Kim, J.-H., Kim, J., Choi, I.-Y., Cheong, S.-S., Uhm, M.-J. and Lee, W. H. 2015. First report of Anthracnose on bitter gourd caused by Colletotrichum gloeosporioides in Korea. Res. Plant Dis 21: 32-35. (In Korean)

Kim, Y. S. and Yun, Y. J. 2018. First report of black rot caused by Diplodia seriata on apple. Res. Plant Dis 24: 321-327. (In Korean)

Korean Statistical Information Service. 2019. Area of cultivated field fruit trees.
URL http://kosis.kr/statHtml/statHtml.do?orgId=101&tblId=DT_1ET0014
[30 February 2019].
Kumar, S., Stecher, G., Li, M., Knyaz, C. and Tamura, K. 2018. MEGA X: molecular evolutionary genetics analysis across computing platforms. Mol. Biol. Evol 35: 1547-1549.



Lee, D., Hassan, O., Kim, C. and Chang, T. 2018. First report of peach (Prunus persica) anthracnose caused by Colletotrichum fioriniae in Korea. Plant Dis 102: 2650

Lee, H. W., Nguyen, T. T. T. and Lee, H. B. 2016. First report of postharvest fruit rot of Aronia melanocarpa caused by Fusarium tricinctum in Korea. Korean J. Mycol 44: 68-71.

O'Donnell, K., Kistler, H. C., Cigelnik, E. and Ploetz, R. C. 1998. Multiple evolutionary origins of the fungus causing Panama disease of banana: concordant evidence from nuclear and mitochondrial gene genealogies. Proc. Natl. Acad. Sci. U. S. A 95: 2044-2049.



O'Donnell, K. and Cigelnik, E. 1997. Two divergent intragenomic rDNA ITS2 types within a monophyletic lineage of the fungus Fusarium are nonorthologous. Mol. Phylogenet. Evol 7: 103-116.


The Korean Society of Plant Pathology. 2009. List of Plant Disease in Korea. 5th ed. The Korean Society of Plant Pathology, Suwon, Korea. pp. 859 pp.
White, T. J., Bruns, T. D., Lee, S. B. and Taylor, J. W. eds. by M. A. Innis, D. H. Gelfand, J. J. Sninsky and T. J. White, 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: PCR Protocols: A Guide to Methods, Applications, Academic Press, New York, NY, USA. pp. 315-322.





 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




