 |
 |
| Res. Plant Dis > Volume 26(1); 2020 > Article |
|
ņÜö ņĢĮ
Ļ│ĀņČöļŖö ĒĢ£ĻĄŁņØś ņŻ╝ņÜö Ļ▓ĮņĀ£ ņ×æļ¼╝ ņżæ ĒĢśļéśņØ┤ņ¦Ćļ¦ī ņ×¼ļ░░Ļ│╝ņĀĢņŚÉņä£ Colletotrichum acutatumņŚÉ ĻĖ░ņØĖĒĢ£ ĒāäņĀĆļ│æņØ┤ ļ¦ÄņØ┤ ļ░£ņāØĒĢ£ļŗż. ņØ┤ņØś ļ░®ņĀ£ļź╝ ņ£äĒĢ┤ ĻĖĖĒĢŁĻĘĀņØĖ Bacillus subtilis YGB36ņØä ņäĀļ░£ ĒĢśņŚ¼ 16S rRNA ņŚ╝ĻĖ░ņä£ņŚ┤ ļ░Å ņāØļ”¼ŌĆóņāØĒÖöĒĢÖņĀü ļČäņäØņØä ĒåĄĒĢ┤ Bacillus subtilisļĪ£ ļÅÖņĀĢĒĢśĻ│Ā ņØ┤ļź╝ ņāØļ¼╝ĒĢÖņĀü ļ░®ņĀ£ņĀ£ļĪ£ Ļ░£ļ░£ĒĢśĻ│Āņ×É ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. In vitro screeningņŚÉņä£ YGB36ņØĆ Cylindrocarpon destructansņŚÉ Ļ░ĢĒĢ£ ĒĢŁĻĘĀĒÖ£ņä▒ņØä ļéśĒāĆļé┤ņŚłĻ│Ā, cellulase, prote- ase, amylase, siderophore ņāØņé░ ļ░Å phosphate solubilityļź╝ ļ│┤ņ£ĀĒĢśĻ│Ā ņ׳ņŚłļŗż. ņØ┤ ĻĘĀņŻ╝ņØś ļ░░ņ¢æņĢĪ(106 cfu/ml) ļ░Å ļ░░ņ¢æņŚ¼ņĢĪņØĆ in vitro ņŗżĒŚśņŚÉņä£ C. acutatumņØś Ēżņ×Éļ░£ņĢäļź╝ Ļ░ĢĒĢśĻ▓ī ņ¢ĄņĀ£ĒĢśņśĆĻ│Ā, Ļ│ĀņČö Ļ│╝ņŗżņØä ņØ┤ņÜ®ĒĢ£ ņŗżļé┤ņŗżĒŚśņŚÉņä£ļÅä ņØ┤ ļ░░ņ¢æņĢĪņØ┤ ĒāäņĀĆļ│æ ļ│æļ░śņØś ņ¦äņĀäņØä ņ¢ĄņĀ£ĒĢśņśĆņ£╝ļ®░, ļ░®ņĀ£Ļ░ĆļŖö 65.7%ļĪ£ ļéśĒāĆļé¼ļŗż. ņĢäņÜĖļ¤¼ YGB36ļ░░ņ¢æņĢĪņØĆ Ļ│ĀņČö ņóģņ×ÉņØś ļ░£ņĢä ļ░Å ņ┤łĻĖ░ ļ┐īļ”¼ ņāØņןņØä ņ┤ēņ¦äĒĢśņśĆĻ│Ā, ņś©ņŗżņŚÉņä£ņØś ņŗØļ¼╝ ņāØņןņØä ņ┤ēņ¦äĒĢśņśĆļŗż. ĻĖ░ņĪ┤ ĒÖöĒĢÖļåŹņĢĮĻ│╝ņØś Ēś╝ņÜ® Ļ░ĆļŖźņä▒ ņĪ░ņé¼ Ļ▓░Ļ│╝, YGB36ņØĆ ņŗżĒŚśņŚÉ ņé¼ņÜ®ĒĢ£ ļ¬©ļōĀ ņé┤ņČ®ņĀ£ņŚÉņä£ ņāØņĪ┤ņŚÉ ņśüĒ¢źņØä ņĀäĒśĆ ļ░øņ¦Ć ņĢŖņĢśņ£╝ļ®░, ņé┤ĻĘĀņĀ£ 21ņóģ ņżæ 11ņóģņŚÉņä£ ņל ņāØņĪ┤ĒĢśņśĆļŗż. ļö░ļØ╝ņä£ YGB36ĻĘĀņŻ╝ļŖö Ļ│ĀņČö ĒāäņĀĆļ│æņŚÉ ļīĆĒĢ£ ņāØļ¼╝ļåŹņĢĮņ£╝ļĪ£ņä£ņØś ņ×Āņ×¼ņĀü Ļ░Ćņ╣śĻ░Ć ņāüļŗ╣ĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
ABSTRACT
Red pepper, one of the major economic crops in Korea, is being affected by anthracnose disease caused by Colletotrichum acutatum. To control this disease, an antagonistic bacterial strain, Bacillus subtilis YGB36 identi- fied by 16S rDNA sequencing, physiological and biochemical analyses is used as a biological control agent. In vitro screening revealed that the strain YGB36 possess strong antifungal activity against the pathogen Cylindrocarpon destructans. The strain exhibited cellulase, protease, amylase, siderophore production and phosphate solubility. In vitro conidial germination of C. acutatum was most drastically inhibited by YGB36 cell suspensions (106 cfu/ml) or culture filtrate. Development of anthracnose symptoms was reduced on de- tached immature green pepper fruits by treatment with cell suspensions, and its control value was recorded as 65.7%. The YGB36 bacterial suspension treatment enhanced the germination rate of red pepper seeds and promoted root development and growth under greenhouse conditions. The in vitroscreening of fungicide and insecticide sensitivity test against YGB36 revealed that the bacterial growth was not affected by any of the insecticides, and 11 fungicides out of 21 used. Collectively, our results clearly suggest that the strain YGB36 is considered as one of the potential biocontrol agents against anthracnose disease in red pepper.
Ļ│ĀņČö(Capsicum spp.)ļŖö ņŚ┤ļīĆņä▒ ņŗØļ¼╝ļĪ£ ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ ņŻ╝ņÜö Ļ▓Į ņĀ£ņ×æļ¼╝ļĪ£ ņ×Éļ”¼ ņ×ĪĻ│Ā ņ׳Ļ│Ā, ņĪ░ļ»Ė ņ▒äņåīļźś ņżæ Ļ░Ćņן ļäōņØĆ ņ×¼ļ░░ļ®┤ņĀü ņØä ņ░©ņ¦ĆĒĢśĻ│Ā ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņĄ£ĻĘ╝ ĻĖ░ņāüņØ┤ļ│ĆĻ│╝ ņ×¼ļ░░ ļåŹļ»╝ņØś Ļ│ĀļĀ╣ĒÖö ļō▒ņŚÉ ļö░ļØ╝ ņ×¼ļ░░ņØś ņ¢┤ļĀżņøĆņØä Ļ▓¬Ļ│Ā ņ׳ņØä ļ┐Éļ¦ī ņĢäļŗłļØ╝, ņÜ░ļ”¼ļéśļØ╝ņŚÉ ņä£ļŖö ņŚ░ņ×æ, ņåīĻĘ£ļ¬© ņ×¼ļ░░, ļģĖļÅÖ ņ¦æņĢĮ, ĻĖ┤ ņ×¼ļ░░ ņ×æĻĖ░ļĪ£ ņØĖĒĢ┤ ņŚ¼ļ¤¼ ļ│æ ĒĢ┤ Ēö╝ĒĢ┤Ļ░Ć Ēü░ ņ×æļ¼╝ņØ┤ĻĖ░ļÅä ĒĢśļŗż(Park ļō▒, 2012). ņÜ░ļ”¼ļéśļØ╝ņŚÉ ļ│┤Ļ│Ā ļÉ£ Ļ│ĀņČöņŚÉ ļ░£ņāØĒĢśļŖö ļ│æĒĢ┤ļŖö 35ņóģņØ┤ļ®░, ĻĘĖ ņżæ ņŚŁļ│æĻ│╝ ĒāäņĀĆļ│æ, ļ¬© ņ×ÉņØ┤Ēü¼ļ│æ ļō▒ ņĢĮ 10ņóģņØś ļ│æņØ┤ ļ¦żļģä Ļ│ĀņČöņŚÉ Ēü░ Ēö╝ĒĢ┤ļź╝ ņŻ╝ļŖö Ļ▓āņ£╝ ļĪ£ ļ│┤Ļ│ĀļÉśņŚłĻ│Ā, Ļ│ĀņČöĒāäņĀĆļ│æĻ│╝ ņŚŁļ│æņØ┤ Ļ░Ćņן ņŗ¼Ļ░üĒĢ£ Ēö╝ĒĢ┤ļź╝ ņØ╝ņ£╝ ĒéżĻ│Ā ņ׳ļŗż(Seo ļō▒, 2011; The Korean Society of Plant Pathology, 2009). Ļ│ĀņČöĒāäņĀĆļ│æĻĘĀ ņżæ ņłśļ¤ēĻ│╝ ĒÆłņ¦łņŚÉ ņ¦üņĀæņĀüņØĖ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ĻĘĀņØĆ C. acutatumĻ│╝ C. gloeosporioidesļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ ļ®░ ņĄ£ĻĘ╝ņŚÉļŖö C. acutatumņØ┤ ņŻ╝ļĪ£ ļ░£ņāØĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż(Kim ļō▒, 2008). ņŻ╝ļĪ£ ļ»ĖņłÖĒĢ£ Ļ│╝ņŗżļĪ£ļČĆĒä░ ņłśĒĢÖ ĒøäĻ╣īņ¦Ć ļ░£ņāØĒĢśļ®░ ņłśņ╣© ņāüņ£╝ļĪ£ ņØīĒæ╣ ļōżņ¢┤Ļ░ä ņøÉĒśĢ ļ░śņĀÉņ£╝ļĪ£ ļéśĒāĆļéśĻ│Ā ļ│æļ░ś ņ£ŚļČĆļČäņŚÉ ļŗ┤ ĒÖ®ņāē ļé┤ņ¦Ć ĒĢæĒü¼ņāēņØ┤ļéś ņśżļĀīņ¦ĆņāēņØś Ēżņ×É ļŹ®ņ¢┤ļ”¼ ņ”ØņāüņØä ļ│┤ņØ┤ļ®░ ņŗØļ¼╝ņ▓┤ ņĀä ņāØņ£ĪĻĖ░ņŚÉ Ļ▒Ėņ│É Ļ│ĀņČö Ļ│╝ņŗżņŚÉņä£ Ļ░ĢĒĢ£ ļ│æņøÉņä▒ņØ┤ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż(Han ļō▒, 2009).
ĒāäņĀĆļ│æ ļ░®ņĀ£ļź╝ ņ£äĒĢ┤ ņé¼ņÜ®ĒĢśļŖö ĒÖöĒĢÖļåŹņĢĮņØĆ dithianon, carbendazium, chlorothalonill, azoxystrobin, mancozeb ļō▒ņØ┤ ņ׳ ņ¦Ćļ¦ī, ņāØĒā£Ļ│ä ĒīīĻ┤┤ņÖĆ Ļ░ÖņØĆ ļ¼ĖņĀ£ņĀÉĻ│╝ C. acutatumņØś ņĢĮņĀ£ ļé┤ņä▒ ļō▒ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ļ░®ņĀ£ņŚÉ ņ¢┤ļĀżņøĆņØ┤ ņ׳ļŗż(Kwak ļō▒, 2012). ņØ┤ņŚÉ ņĀĆ ļÅģņä▒ņØ┤ļ®┤ņä£ ĒÖśĻ▓ĮņŚÉ ĒĢ┤Ļ░Ć ņŚåļŖö ņāØļ¼╝ņĀü ļ░®ņĀ£ņŚÉ ņ׳ņ¢┤ņä£ ĒŖ╣Ē׳ ļ│æņøÉ ĻĘĀņŚÉ ĒĢŁĻĘĀļĀźņØä ļ│┤ņØ┤ļŖö ļ»ĖņāØļ¼╝ņØä ņØ┤ņÜ®ĒĢ£ ņāØļ¼╝ĒĢÖņĀü ļ░®ņĀ£Ļ░Ć Ļ┤Ćņŗ¼ ņØä ļüīĻ│Ā ņ׳ņ£╝ļ®░, ĒåĀņ¢æņŚÉņä£ Bacillus sp., Psedomonas sp., Strepto- myces sp. ļō▒Ļ│╝ Ļ░ÖņØĆ ļ»ĖņāØļ¼╝ņØä ļČäļ”¼ĒĢśņŚ¼ ĒĢŁņāØļ¼╝ņ¦łĻ│╝ ļ»ĖņāØļ¼╝ņĀ£ ņØś Ļ░£ļ░£ņØä ņ£äĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŗż(KimĻ│╝ Yun, 2011; Lee, 2010; Paik ļō▒, 1996; Park ļō▒, 2006). ĻĘĖ ņżæņŚÉņä£ļÅä ņŗØļ¼╝ņāØņ£Īņ┤ēņ¦ä ĻĘ╝ĻČīņäĖĻĘĀņ£╝ļĪ£ ļé┤ņāØĒżņ×É(endospores)ļź╝ ĒśĢņä▒ĒĢś ņŚ¼ ņןĻĖ░Ļ░ä ļ│┤ņĪ┤ņØ┤ Ļ░ĆļŖźĒĢ£ BacillusņóģņŚÉ ļīĆĒĢ£ Ļ░£ļ░£ņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ ļŗż(Borriss, 2011; Qiao ļō▒, 2014).
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö Ļ│ĀņČöĒāäņĀĆļ│æņØä ņØ╝ņ£╝ĒéżļŖö C. acutatumņŚÉ ļīĆĒĢ£ ņāØļ¼╝ĒĢÖņĀü ļ░®ņĀ£ĒÜ©Ļ│╝Ļ░Ć ņÜ░ņłśĒĢ£ BacillusņóģņØä ņäĀļ░£ĒĢśĻ│Ā ĒāäņĀĆļ│æņØś ļ░£ļ│æ ņ¢ĄņĀ£ ĒÜ©Ļ│╝ ļ░Å ņŗØļ¼╝ņāØņןņ┤ēņ¦äļŖźņØä Ļ▓ĆņĀĢĒĢśņśĆņ£╝ļ®░, ņŗżņĀ£ ļåŹĻ░Ć ņŚÉņä£ ĻĖ░ņĪ┤ ĒÖöĒĢÖļåŹņĢĮĻ│╝ņØś Ēś╝ņÜ®ņØ┤ Ļ░ĆļŖźĒĢ£ ņ¦Ć ņŚ¼ļČĆņŚÉ ļīĆĒĢśņŚ¼ Ļ▓ĆĒåĀ ĒĢśĻ│Ā ņØ┤ļź╝ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ņØĖņé╝ņ×¼ļ░░ņ¦Ć ĒåĀņ¢æņ£╝ļĪ£ļČĆĒä░ ņ£ĀņÜ®ļ»ĖņāØļ¼╝ņØä ļČäļ”¼ĒĢśņśĆļŗż. ņØĖņé╝ ĻĘ╝ĻČīņØś ĒåĀņ¢æņØä ņ▒äņĘ©ĒĢśņŚ¼ ļ®ĖĻĘĀņłśņŚÉ ĒśäĒāüĒĢśņŚ¼ ĒؼņäØ Ēøä brain heart infusion (BHI) ļ░░ņ¦ĆņŚÉ ļÅäļ¦ÉĒĢśĻ│Ā ļŗ©ņØ╝ ņĮ£ļĪ£ļŗłņØś ļ»ĖņāØļ¼╝ļōżņØä ļČäļ”¼ĒĢśņśĆļŗż(Park ļō▒, 2013). ĻĖĖĒĢŁļĀźņØ┤ ņÜ░ņłśĒĢ£ ļ»ĖņāØļ¼╝ ņäĀļ░£ņØä ņ£äĒĢ┤, ņØĖņé╝ļ┐īļ”¼ņŹ®ņØīļ│æņøÉĻĘĀ Cylindrocarpon destructans Ēżņ×É ĒśäĒāØņĢĪņØä 105 conidia/mlņØś ļåŹļÅäļĪ£ ņĀ£ņĪ░ĒĢśņŚ¼ potato dextrose agar (PDA) ļ░░ņ¦ĆņŚÉ ļÅäļ¦ÉĒĢ£ Ēøä ņāüĻĖ░ņŚÉņä£ ļČäļ”¼ĒĢ£ ļŗ©ņØ╝ ņĮ£ļĪ£ļŗłņØś ļ»ĖņāØļ¼╝ļōżņØä Ļ░üĻ░ü ņé┤ĻĘĀļÉ£ ņØ┤ņæżņŗ£Ļ░£ļĪ£ ļ¼╗ĒśĆ ņĀæņóģĒĢśĻ│Ā 21┬░CņŚÉņä£ 5ņØ╝Ļ░ä ļ░░ņ¢æĒĢśņŚ¼ inhibition zoneņØ┤ ĒśĢņä▒ļÉ£ ņĮ£ļĪ£ļŗłļź╝ ņäĀļ░£ĒĢśņśĆļŗż.
Ļ│ĀņČö ĒāäņĀĆļ│æĻĘĀņØĆ ĒĢ£ĻĄŁļåŹņŚģļ»ĖņāØļ¼╝ņ×ÉņøÉņä╝Ēä░ļĪ£ļČĆĒä░(Korean Agricultural Culture Collection, KACC) ļČäņ¢æļ░øņĢä ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░(Collectotrichum acutatum KACC40847, Collectotrichum acutatum KACC42509, Collectotrichum acutatum KACC42403 ļ░Å Collectotrichum gloeosporioides KACC42690), ņØ┤ļōż ĻĘĀņŻ╝ņØś ļ░░ņ¢æļ░░ņ¦ĆņŚÉ 6-mm cork borerļĪ£ Ļ│ĀņČöĒāäņĀĆļ│æ ļĖöļ¤ŁņØä ņלļØ╝ ņāłļĪ£ņÜ┤ PDA ļ░░ņ¦Ć ņżæņĢÖņŚÉ ņ╣śņāüĒĢśĻ▒░ļéś, Ēżņ×ÉĒśäĒāüņĢĪ (105 conidia/ml) 100 ┬ĄlņØä ņĀ£ņĪ░ĒĢśņŚ¼ PDA ļ░░ņ¦ĆņŚÉ Ļ░üĻ░ü ļÅäļ¦ÉĒĢ£ Ēøä, 6-mm paper discļź╝ ņ╣śņāüĒĢśĻ│Ā ĻĘĖ ņ£äņŚÉ ņäĀļ░£ļÉ£ ĻĘĀņŻ╝ ļ░░ņ¢æņĢĪ 10 ┬ĄlņØä ņĀæņóģĒĢśņŚ¼ inhibition zone ĒśĢņä▒ ņŚ¼ļČĆļź╝ Ļ┤Ćņ░░ĒĢśņśĆļŗż.
YGB36ņØś 16S ribosomal RNA ņ£ĀņĀäņ×É ņä£ņŚ┤ņØś PCR ņ”ØĒÅŁņØä ņ£äĒĢ┤, 27F (5ŌĆ▓-AGAGTTTGATCMTG- GCTCAG-3ŌĆ▓)ņÖĆ 1492R (5ŌĆ▓-GGYTACCTTGTTACG ACTT-3ŌĆ▓) ĒöäļØ╝ņØ┤ļ©Ėļź╝ ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ņ”ØĒÅŁļÉ£ PCR ņé░ļ¼╝ņØś sequencingņØä ņłśĒ¢ē ĒĢ£ Ēøä NCBI (National Center for Biotechnology Information) ņØś BLASTļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż. Phylogenetic ļČäņäØņŚÉļŖö MEGA-XĻ░Ć ņé¼ņÜ®ļÉśņŚłļŗż(Kumar ļō▒, 2016; Weisburg ļō▒, 1991).
ņäĀļ░£ļÉ£ ĻĘĀņŻ╝ņØś ĒāäņåīņøÉ ņØ┤ņÜ®ļÅäļź╝ ņØ┤ņÜ®ĒĢ£ ļÅÖņĀĢņØä ņ£äĒĢ┤ Biolog GEN III microplate system (Biolog, Hayward, CA, USA)ņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ņ¦Ćņ╣©ņŚÉ ļö░ļØ╝, ĻĘĀņŻ╝ ņĮ£ļĪ£ļŗłļź╝ fluid A (Biolog)ņŚÉ ĒśäĒāü Ēøä Ļ░ü 100 ┬Ąlļź╝ GEN III microplateņØś ļ¬©ļōĀ wellņŚÉ ņĀæņóģĒĢśņŚ¼, 28┬░CņŚÉņä£ 42ņŗ£Ļ░ä ļ░░ņ¢æĒĢśņśĆņ£╝ļ®░, Biolog MicroStation automated readerļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢ Ēøä MicroLog 3 software (Biolog)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż. ĒĢ£ĒÄĖ, ĒĢ┤ļŗ╣ ĻĘĀņŻ╝ņØś ļÅÖņĀĢņØä ņ£äĒĢ┤ Vitek systemņØ┤ ņé¼ņÜ®ļÉśņŚłļŗż. Vitek 2 Compact system (bioM├®rieux, France)ņŚÉņä£ BCLņ╣┤ļō£ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņĀ£ņĪ░ņé¼ņØś ņ¦Ćņ╣©ņŚÉ ļö░ļØ╝ ņ¦äĒ¢ēļÉśņŚłņ£╝ļ®░, 28┬░CņŚÉņä£ 14ņŗ£Ļ░ä ļ░░ņ¢æ Ēøä VITEK 2 Compact software version 07.01ņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż.
ļ░░ņ¢æ ĒŖ╣ņä▒ņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢśņŚ¼, YGB36ņØä BHI ņĢĪņ▓┤ ļ░░ņ¦ĆņŚÉ ņĀæņóģĒĢ£ Ēøä 28┬░CņŚÉņä£ 7ņØ╝Ļ░ä ļ░░ņ¢æĒĢśļ®┤ņä£, UV 600 nmņŚÉņä£ņØś ODĻ░ÆņØä ļ¦żņØ╝ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░, ņĄ£ņ┤ł 24ņŗ£Ļ░äĻ╣īņ¦ĆļŖö 6ņŗ£Ļ░ä Ļ░äĻ▓®ņ£╝ļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż. ļÅÖņŗ£ņŚÉ ņāØĻĘĀņłś ņĖĪņĀĢņØä ņ£äĒĢ┤, ODĻ░Æ ņĖĪņĀĢļĢī ļ¦łļŗż ļ░░ņ¢æņĢĪņØś ņØ╝ļČĆļź╝ ņĘ©ĒĢśņŚ¼ BHI Ļ│Āņ▓┤ļ░░ņ¦ĆņŚÉ 10-fold dilution platingĒĢśņŚ¼ ļ░░ņ¢æĒĢ£ Ēøä ļ░£ņāØĒĢ£ ņĮ£ļĪ£ļŗł ņłśļź╝ ņĖĪņĀĢĒĢśņśĆļŗż.
Cellulase ņāØņé░ ņŚ¼ļČĆļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ CMC agar ļ░░ņ¦Ć(carboxyl methyl cellulose 5 g, MgSO4 2 g, CaCl2 0.5 g, KCl 1 g, FeSO4 0.001 g, agar 20 g)ļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż(Sazci ļō▒, 1986). ļ®ĖĻĘĀļÉ£ 6-mm filter paperļź╝ ļ░░ņ¦Ć ņ£ä 3Ļ││ņŚÉ ņś¼ļ”░ Ēøä 2Ļ││ ņŚÉļ¦ī YGB36 ļ░░ņ¢æņĢĪņØä 10 ┬Ąlņö® ņĀæņóģĒĢ£ Ēøä 28┬░CņŚÉņä£ 5ņØ╝Ļ░ä ļ░░ņ¢æĒĢśņśĆļŗż. 0.1% Congo red ņÜ®ņĢĪņ£╝ļĪ£ ļ░░ņ¦Ćļź╝ ņŚ╝ņāēĒĢ£ Ēøä inhibition zone ĒśĢņä▒ņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ļ│Ė ņŗżĒŚśņØĆ 3ļ░śļ│Ąņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśņśĆļŗż.
Protease ĒÖ£ņä▒ņØĆ gelatinņØä ņ▓©Ļ░ĆĒĢśņŚ¼ ļ¦īļōĀ ĒÅēĒīÉļ░░ņ¦Ć(gelatin 5 g, beef extract 3 g, proteose peptone 5 g, agar 15 g)ņŚÉ YGB36 ļ░░ņ¢æņĢĪņØä ņĀæņóģĒĢśĻ│Ā 5ņØ╝Ļ░ä ļ░░ņ¢æĒĢ£ Ēøä, 1% tannic acid ņÜ®ņĢĪņ£╝ļĪ£ ņŚ╝ņāēĒĢśņŚ¼ inhibition zone ĒśĢņä▒ņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ļ│Ė ņŗżĒŚśņØĆ 3ļ░śļ│Ąņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśņśĆļŗż.
Amylase ĒÖ£ņä▒ņØĆ Ļ░ĆņÜ®ņä▒ ņĀäļČä(soluble starch)ņØä ņ▓©Ļ░ĆĒĢśņŚ¼ ļ¦īļōĀ ĒÅēĒīÉļ░░ņ¦Ć(beef extract 3 g, proteose peptone 5 g, soluble starch 2 g, agar 15 g)ņŚÉ YGB36 ļ░░ņ¢æņĢĪņØä ņĀæņóģĒĢśĻ│Ā 5ņØ╝Ļ░ä ļ░░ņ¢æ ĒĢ£ Ēøä, GramŌĆÖs iodine ņÜ®ņĢĪ(3.3 g iodine crystal, 2.8 g potassium iodine, 1,000 ml distilled water)ņ£╝ļĪ£ ņŚ╝ņāēĒĢśņŚ¼ inhibition zone ĒśĢņä▒ņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ļ│Ė ņŗżĒŚśņØĆ 3ļ░śļ│Ąņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśņśĆļŗż.
Siderophore ņāØņé░ ņŚ¼ļČĆļŖö ļ│ĆĒśĢļÉ£ Chrome azurol S (CAS) agar assayļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż(Han ļō▒, 2015). CAS (Sigma, St. Louis, MO, USA) ņŚ╝ļŻī ņÜ®ņĢĪņØĆ ņ”Øļźśņłś 50 mlņŚÉ CAS 60.5 mg ņØä ļģ╣ņØ┤Ļ│Ā, 72.9 mgņØś hexadecyltrimethylammonium bro- mideļź╝ ņ”Øļźśņłś 40 mlņŚÉ ļģ╣ņØ┤Ļ│Ā, Luria-Bertani agar 35 gņØä ņ”Øļźśņłś 900 mlņŚÉ ļģ╣ņØĖ Ēøä ņäĖ Ļ░Ćņ¦Ć ņÜ®ņĢĪņØä Ēś╝ĒĢ®ĒĢśĻ│Ā Ļ│ĀņĢĢ ļ®ĖĻĘĀĒĢśņśĆļŗż. HCl ņÜ®ņĢĪ(10 mM) 10 mlņŚÉ 1 mM FeCl3ŌĆó6H2Oļź╝ ļģ╣ņŚ¼ ļö░ļĪ£ Ļ│ĀņĢĢļ®ĖĻĘĀĒĢśņśĆļŗż. Ļ│ĀņĢĢ ļ®ĖĻĘĀļÉ£ ļæÉ ņÜ®ņĢĪņØä 50┬░CļĪ£ ņŗØĒ×ī Ēøä ņä×ņ¢┤ņŻ╝Ļ│Ā Petri dishņŚÉ ļČäņŻ╝ĒĢśņŚ¼ CAS ĒÅēĒīÉļ░░ņ¦Ćļź╝ ļ¦īļōżņŚłļŗż. ņØ┤Ēøä ņ£äņÖĆ Ļ░ÖņØĆ ļ░®ļ▓Ģņ£╝ļĪ£ ņäĖĻĘĀņØä ņĀæņóģĒĢśĻ│Ā 28┬░CņŚÉņä£ 5ņØ╝Ļ░ä ļ░░ņ¢æĒĢ£ Ēøä, orange halo zone ĒśĢņä▒ņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ļ│Ė ņŗżĒŚśņØĆ 3ļ░śļ│Ąņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśņśĆļŗż.
ņØĖņé░ ļČäĒĢ┤ļŖź(phosphate solubilization)ņØĆ tricalcium phosphateĻ░Ć ĒżĒĢ©ļÉ£ ļ░░ņ¦Ć(glucose 10 g, tricalcium phosphate 5 g, MgCl2ŌĆó6H2O 5 g, MgSO4ŌĆó7H2O 0.25 g, KCl 0.2 g, (NH4)2SO4 0.1 g, agar 20 g)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼, ņāüĻĖ░ņÖĆ Ļ░ÖņØĆ ļ░®ļ▓Ģņ£╝ļĪ£ ņäĖĻĘĀ ļ░░ņ¢æņĢĪņØä ņĀæņóģĒĢśĻ│Ā 15ņØ╝Ļ░ä ļ░░ņ¢æĒĢ£ Ēøä halo zone ĒśĢņä▒ņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ļ│Ė ņŗżĒŚśņØĆ 3ļ░śļ│Ąņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśņśĆļŗż.
YGB36 ļ░░ņ¢æņĢĪ ļ░Å ļ░░ņ¢æņŚ¼ņĢĪņØä ņØ┤ņÜ®ĒĢśņŚ¼ C. acutatum KACC42403ņØś Ēżņ×Éļ░£ņĢä ņ¢ĄņĀ£ ĒÜ©Ļ│╝ļź╝ ņĪ░ņé¼ĒĢśņśĆļŗż. C. acutatumņØĆ PDA ļ░░ņ¦ĆņŚÉņä£ 5ņØ╝Ļ░ä ļ░░ņ¢æĒĢśņŚ¼ Ēżņ×É ĒśäĒāüņĢĪņØä 105 conidia/ml ļåŹļÅäļĪ£ ņżĆļ╣äĒĢśņśĆĻ│Ā, YGB36ņØĆ BHI ņĢĪņ▓┤ļ░░ņ¦ĆņŚÉņä£ 3ņØ╝Ļ░ä ļ░░ņ¢æĒĢ£ ļ░░ņ¢æņĢĪ ļ░Å ņØ┤ļź╝ MF-Millipore membrane filter (pore size, 0.22 ┬Ąm)ļĪ£ ņŚ¼Ļ│╝ĒĢśņŚ¼ ļ░░ņ¢æņŚ¼ņĢĪņ£╝ļĪ£ ņżĆļ╣äĒĢśņśĆļŗż. ņŖ¼ļØ╝ņØ┤ļō£ ĻĖĆļØ╝ņŖż ņ£äņŚÉ Ēżņ×ÉĒśäĒāüņĢĪ 10 ┬ĄlņØä ļČäņŻ╝ĒĢśĻ│Ā ņØ┤ņŚÉ ļ░░ņ¢æņĢĪ ļśÉļŖö ļ░░ņ¢æņŚ¼ņĢĪ 10 ┬Ąlļź╝ Ļ░üĻ░ü ļČäņŻ╝ĒĢśņśĆļŗż. ņŖĄļÅäļź╝ ņ£Āņ¦ĆĒĢśļ®░ 25┬░CņŚÉņä£ ļ░░ņ¢æĒĢśļ®┤ņä£ 8ņŗ£Ļ░ä Ļ░äĻ▓®ņ£╝ļĪ£ 48ņŗ£Ļ░ä ļÅÖņĢł ļ░£ņĢä(germination) ņ£Āļ¼┤ņÖĆ ļČĆņ░®ĻĖ░(appressorium) ĒśĢņä▒ņØä ņĪ░ņé¼ĒĢśņśĆļŗż. Ēżņ×ÉņØś ļ░£ņĢäļŖö ļ░£ņĢäĻ┤Ć(germ tube)ņØś ĻĖĖņØ┤Ļ░Ć Ēżņ×É Ēü¼ĻĖ░ņØś 1/2 ņØ┤ņāü ļÉśņŚłņØä ļĢīļĪ£ ņĀĢņØśĒĢśņśĆņ£╝ļ®░, ļīĆņĪ░ĻĄ¼ļĪ£ļŖö ļ®ĖĻĘĀņłśļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņ£äņÖĆ Ļ░ÖņØĆ ļ░®ļ▓Ģņ£╝ļĪ£ ņĪ░ņé¼ĒĢśņśĆļŗż. Ēżņ×É ļ░£ņĢäņ£©ņØĆ (1-ļ░£ ņĢäņ£©/ļīĆņĪ░ĻĄ¼ļ░£ņĢäņ£©)├Ś100ņ£╝ļĪ£ Ļ│äņé░ĒĢśņśĆņ£╝ļ®░, ļ¬©ļōĀ ņŗżĒŚśņØĆ 3ļ░śļ│Ąņ£╝ļĪ£ ņŗżņŗ£ĒĢśņśĆļŗż.
ņŗ£ņżæņŚÉņä£ ĒīÉļ¦żļÉśļŖö ĒÆŗĻ│ĀņČöļź╝ 70% ethanolĻ│╝ 2% NaOCl ņØä ņØ┤ņÜ®ĒĢ£ Ēæ£ļ®┤ ņé┤ĻĘĀ Ēøä ņé¼ņÜ®ĒĢśņśĆļŗż. ļ®ĖĻĘĀļÉ£ ĒĢĆņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ│ĀņČö Ļ│╝ņŗż Ēæ£ļ®┤ 6Ļ││ņŚÉ ņāüņ▓śļź╝ ļéĖ ļÆż C. acutatum KACC42403 Ēżņ×ÉĒśäĒāüņĢĪ(105 conidia/ml) 10 ┬Ąlļź╝ ņĀæņóģĒĢ£ Ēøä ņŗżņś©ņŚÉņä£ Ļ▒┤ņĪ░ĒĢśņśĆļŗż. YGB36ņØĆ BHI ņĢĪņ▓┤ļ░░ņ¦ĆņŚÉ 3ņØ╝Ļ░ä ļ░░ņ¢æ ĒĢ£ Ēøä 20ļ░░ļĪ£ ĒؼņäØĒĢśņŚ¼ ļČäļ¼┤ĒĢśņśĆĻ│Ā ļīĆņĪ░ĻĄ¼ļŖö BHI ņĢĪņ▓┤ļ░░ņ¦Ćļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäļ¼┤ĒĢśņśĆļŗż Ļ│ĀņČö Ļ│╝ņŗżņØĆ ņŖĄņŗżņ▓śļ”¼ĒĢśņŚ¼ 10ņØ╝Ļ░ä 25┬░C ļĪ£ ļ░░ņ¢æĒĢśļ®┤ņä£ ļ│æ ļ░£ņāØņØä ļ╣äĻĄÉĒĢśņśĆļŗż. ļ¬©ļōĀ ņŗ£ĒŚśņØĆ 3ļ░śļ│Ąņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśņśĆļŗż. ļ░£ļ│æļÅä(%)ļŖö ļ│æļ░ś Ēü¼ĻĖ░ņŚÉ ļö░ļØ╝ ļ░£ļ│æņ¦Ćņłśļź╝ 0, 0% ļ│æņ¦ĢņŚåņØī; 1, <2 mm; 2, 2-4 mm; 3, 5-7 mm; 4, 8-10 mm; 5, 10mm ņ┤łĻ│╝ļĪ£ ļéśļłäņ¢┤ ĒÅēĻ░ĆĒĢśņśĆĻ│Ā, ļ░£ļ│æļÅäļŖö {Ōłæ(ļ░£ņāØņ¦Ćņłś├Śļ░£ļ│æņłś)/5(ņĄ£Ļ│Āļ░£ļ│æņ¦Ćņłś)├Ś6(ņĪ░ņé¼ņłś)}├Ś100ļĪ£ ņé░ņČ£ĒĢśņśĆļŗż. ļ░®ņĀ£Ļ░ĆļŖö (ļīĆņĪ░ĻĄ¼ļ░£ļ│æļÅä-ņ▓śļ”¼ĻĄ¼ļ░£ļ│æļÅä/ļīĆņĪ░ĻĄ¼ļ░£ļ│æ)├Ś100ņ£╝ļĪ£ ņé░ņČ£ ĒĢśņśĆļŗż.
YGB36ņØś Ļ│ĀņČö ņāØņ£Ī ņ┤ēņ¦ä ĒÜ©Ļ│╝ ņŗżĒŚśņØĆ ņĢłļÅÖļīĆĒĢÖĻĄÉ ļČĆņåŹļåŹņן ņŗżĒŚśņŗżņŖĄĒż ņ£Āļ”¼ņś©ņŗżņŚÉņä£ ņ¦äĒ¢ēĒĢśņśĆļŗż. 36ĻĄ¼ ĒżĒŖĖ(27.5 cm├Ś27.5 cm├Ś3.5 cm)ņŚÉ ņāüĒåĀļź╝ ņ▒äņÜ┤ ļÆż Ļ│ĀņČöņóģņ×É(Dogyacheongcheong, Syngenta Korea, Seoul, Korea)ļź╝ ĒīīņóģĒĢśņśĆĻ│Ā, YGB36ņØĆ BHIļ░░ņ¦ĆņŚÉņä£ 3ņØ╝Ļ░ä ļ░░ņ¢æ Ēøä ļ®ĖĻĘĀņłśļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ 10ļ░░ ĒؼņäØĒĢśņŚ¼ 7ņØ╝ Ļ░äĻ▓®ņ£╝ļĪ£ Ļ┤ĆņŻ╝ĒĢśņśĆļŗż. ļīĆņĪ░ĻĄ¼ļĪ£ļŖö BHI ņĢĪņ▓┤ļ░░ņ¦Ćļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ļ░£ņĢäņ£© Ļ┤Ćņ░░ņØĆ Ēīīņóģ Ēøä 9ņØ╝ļČĆĒä░ 14ņØ╝Ļ╣īņ¦Ć, ļ┐īļ”¼ ņāØņ£Ī ņĖĪņĀĢņØĆ 15ņØ╝ ņ░©ņŚÉ, ņ¦ĆņāüļČĆ ĻĖĖņØ┤ ņĖĪņĀĢņØĆ 58ņØ╝ ņ░©ņŚÉ ņ¦äĒ¢ēĒĢśņśĆļŗż. ļ¬©ļōĀ ņ▓śļ”¼ĻĄ¼ļŖö 36ĻĄ¼ ĒżĒŖĖņØś 3ļ░śļ│Ąņ£╝ļĪ£ ņŗżņŗ£ĒĢśņśĆļŗż.
ņŗżĒŚśņØä ņ£äĒĢ┤ Ēśäņ×¼ ņ▓ŁņåĪņ¦ĆņŚŁ Ļ│ĀņČöņ×¼ļ░░ ļåŹĻ░ĆņŚÉņä£ ņĄ£ĻĘ╝ 3ļģäĻ░ä ņé¼ņÜ®ļÉ£ ņé┤ĻĘĀņĀ£ 21ņóģĻ│╝ ņé┤ņČ®ņĀ£ 14ņóģņØä ņØ┤ņÜ®ĒĢśņśĆļŗż(Table 1). 3ņØ╝Ļ░ä ņĢĪņ▓┤ ļ░░ņ¢æĒĢ£ YGB36ņØś ļ░░ ņ¢æņĢĪ 100 ┬Ąlļź╝ BHI ļ░░ņ¦ĆņŚÉ ļÅäļ¦ÉĒĢ£ Ēøä ņĀüņĀłĒĢ£ Ļ░äĻ▓®ņ£╝ļĪ£ 4Ļ░£ņØś 6 mm paper discļź╝ ņś¼ļ”¼Ļ│Ā, ĒÖöĒĢÖļåŹņĢĮņØĆ ņĀ£ņĪ░ņé¼ņØś ņ¦Ćņ╣©ņŚÉņä£ ņĀ£ņŗ£ĒĢśļŖö ļåŹļÅä(├Ś1)ļź╝ ņżæņŗ¼ņ£╝ļĪ£ ļ░śļ¤ē(├Ś0.5) ļ░Å ļ░░ļ¤ē(├Ś2)ņ£╝ļĪ£ ņĀ£ņĪ░ĒĢśņŚ¼ Ļ░ü 10 ┬Ąlņö® ļČäņŻ╝ĒĢśņśĆļŗż. 3ņØ╝Ļ░ä ļ░░ņ¢æ Ēøä inhibition zoneņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ļ¬©ļōĀ ņŗżĒŚśņØĆ 3ļ░śļ│Ąņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśņśĆļŗż.
Ļ░ü ņ▓śļ”¼ļ│ä ĒÅēĻĘĀ Ļ░ä ņ░©ņØ┤ņŚÉ ļīĆĒĢ£ ĒåĄĻ│äļŖö ļČäņé░ļČäņäØ ņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśņśĆĻ│Ā, Ļ░ü ņ▓śļ”¼ Ļ░äņØś ņ░©ņØ┤ļŖö ņĄ£ņåīņ£ĀņØśņ░© Ļ▓ĆņĀĢ(least significant difference [LSD] test)ņ£╝ļĪ£ ļŗżņżæ ļ╣äĻĄÉĒĢśņśĆņ£╝ļ®░, RĒåĄĻ│ä ņåīĒöäĒŖĖņø©ņ¢┤(R Foundation for Statistical Computing, Vienna, Austria)ļź╝ ņé¼ņÜ®ņśĆĒĢśļŗż.
ņØĖņé╝ĒżņןņØś ĒåĀņ¢æņ£╝ļĪ£ļČĆĒä░ ņØĖņé╝ņŹ®ņØīļ│æĻĘĀņØĖ C. destructansņŚÉ ļīĆĒĢśņŚ¼ Ļ░ĢĒĢ£ ĒĢŁĻĘĀļĀźņØä ļ│┤ņØ┤ļŖö ĻĘĀņŻ╝ļź╝ ņäĀļ░£ĒĢśņśĆ Ļ│Ā(Fig 1A), ņØ┤ļź╝ YGB36ņ£╝ļĪ£ ļ¬ģļ¬ģĒĢśņśĆļŗż. YGB36 ĻĘĀņŻ╝ļŖö ņØ┤ņÖĖ ņŚÉļÅä ĒāäņĀĆļ│æĻĘĀņØĖ Colletotrichum acutatum 3ņóģ(KACC40847, KACC42403, KACC42509) ļ░Å Colletotrichum gloeosporioides 1 ņóģ(KACC42690)ņŚÉ ļīĆĒĢśņŚ¼ ĒĢŁĻĘĀĒÖ£ņä▒ņØä ļéśĒāĆļé┤ņŚłļŗż(Fig. 1B-F).
YGB36ĻĘĀņŻ╝ņØś Ļ▓īļåłDNAļź╝ ņČöņČ£ĒĢśņŚ¼ 16S ribosomal RNA ņ£ĀņĀäņ×Éļź╝ PCRļĪ£ ņ”ØĒÅŁĒĢśņŚ¼ ņĢĮ 1.2 kbņØś DNAņä£ņŚ┤ņØä ņ¢╗ņŚłņ£╝ļ®░, ņØ┤ņØś ņŚ╝ĻĖ░ņä£ņŚ┤ļČäņäØņØä ĒåĄĒĢ┤ Ļ│äĒåĄļČäļźśļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż(Fig. 2). ļČäņäØļÉ£ phylogenetic treeņŚÉņä£ ĒĢ┤ļŗ╣ ĻĘĀņŻ╝ļŖö Bacillus subtilis, Bacillus amyloliquefaciens ļ░Å Bacillus velezensisņÖĆ ļÅÖņØ╝ĒĢ£ ĻĘĖļŻ╣ņŚÉ ĒżĒĢ©ļÉśņŚłĻ│Ā, ņØ┤ļōżĻ│╝ļŖö ļ¬©ļæÉ 96.83%ņØś ņāüļÅÖņä▒ņØä ļéśĒāĆļé┤ņŚłļŗż. Biolog ļČäņäØņŚÉņä£, YGB36 ĻĘĀņŻ╝ļŖö Bacillus subtilisļĪ£ ļÅÖņĀĢļÉśņŚł ņ£╝ļ®░ ņØ┤ ļĢī probabilityļŖö 86.1%ņśĆĻ│Ā, Vitek 2 system ļČäņäØņŚÉņä£ļŖö, B. subtilis/B. amyloliquefaciens/B. atrophaeusļĪ£ ļÅÖņĀĢļÉśņŚłņ£╝ļ®░, probabilityļŖö 93%ņśĆļŗż. ĻĄ¼ņ▓┤ņĀüņ£╝ļĪ£, YGB36 ĻĘĀņŻ╝ļŖö GEN III microplateņāüņŚÉ ņ׳ļŖö substrates ņżæņŚÉņä£ 3-methyl glucose, D-serine, glucuronamide, ╬▒-keto-glutaric acid, ļ░Å D-malic acid ļō▒ņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ░śņØæņØ┤ ļéśĒāĆļéśņ¦Ć ņĢŖņØĆ ļ░śļ®┤ņŚÉ myo-inositolĻ│╝ formic acid ļō▒ņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ░śņØæņä▒ņØ┤ ļéśĒāĆļé¼ļŗż(Table 2). ņØ┤ļ¤¼ ĒĢ£ ļ░śņØæņä▒ņØĆ Bacillus amyloliquefaciensņÖĆļŖö ĻĄ¼ļ│äļÉśļŖö Bacillus subtilisņØś ĒŖ╣ņ¦ĢņØ┤ļŗż(VITEK 2 Compact software version 07.01). ĒĢ£ĒÄĖ, Vitek 2 system ļÅÖņĀĢņŚÉņä£ ĒĢ©Ļ╗ś ļČäļźśļÉ£ Bacillus velezensisļŖö Bacillus amyloliquefaciensņÖĆ ņāüĒśĖ ļ¦żņÜ░ ņ£Āņé¼ĒĢ┤ņä£, ļ¦ÄņØĆ Bacillus velezensisĻ░Ć ņØ┤ņĀäņŚÉļŖö Bacillus amyloliquefaciensļĪ£ ļČäļźśļÉśņŚłļŗżĻ░Ć ņĄ£ĻĘ╝ņŚÉņĢ╝ Bacillus velezensisļĪ£ ņ×¼ļČäļźśļÉśņ¢┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż(Dunlap ļō▒, 2016; Wang ļō▒, 2008). ņóģĒĢ®ĒĢśļ®┤, 16S rRNA ņŚ╝ĻĖ░ņä£ņŚ┤ļČäņäØ, Biolog ļ░Å VitekļČäņäØņŚÉņä£ Ļ│ĄĒåĄņĀüņ£╝ļĪ£ B. subtilisĻ░Ć ļÅÖņĀĢļÉśņŚłĻ│Ā, ĒŖ╣ Ē׳ Biolog ļČäņäØņŚÉņä£ B. subtilis ĒŖ╣ņØ┤ņĀüņØĖ ĒŖ╣ņ¦ĢņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ»ĆļĪ£ YGB36 ĻĘĀņŻ╝ļŖö Bacillus subtilisļĪ£ ņĄ£ņóģ ļÅÖņĀĢļÉśņŚłļŗż.
ņĢĪņ▓┤ļ░░ņ¦ĆņŚÉņä£ YGB36ņØä 7ņØ╝Ļ░ä ļ░░ņ¢æ ĒĢśļ®┤ņä£ ņāśĒöīļ¦üĒĢ£ Ēøä ļÅÖņØ╝ ņāśĒöīņŚÉ ļīĆĒĢśņŚ¼ ODĻ░Æ ņĖĪņĀĢ ļ░Å ņāØĻĘĀņłś Ļ│äņé░ņØä ĒåĄĒĢ┤ ņäĖĻĘĀņłśņØś ņ”ØņŗØņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢśĻ│Ā ĻĘĖļלĒöäļź╝ ņ¢╗ņŚłļŗż. ļæÉ ļ░®ļ▓Ģ ļ¬©ļæÉņŚÉņä£ ļ╣äņŖĘĒĢ£ Ļ▓░Ļ│╝ņØä ņ¢╗ņŚłņ£╝ļ®░, YGB36ņØä ņĀæņóģĒĢ£ņ¦Ć 24ņŗ£Ļ░ä ļ¦īņŚÉ stationary phaseņŚÉ ņ¦äņ×ģĒĢ£ Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā(Fig. 3A). YGB36ņØä ņĀæņóģĒĢ£ņ¦Ć ņĀüņ¢┤ļÅä 6ņŗ£Ļ░äĻ╣īņ¦ĆļŖö lag phaseĻ░Ć ņ¦ĆņåŹļÉ£ ĒøäņŚÉ exponential stageņŚÉ ņ¦äņ×ģĒĢśņśĆļŗż(Fig. 3B).
YGB36ņØś ĒĢŁĻĘĀĒÖ£ņä▒Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ļŗżņ¢æĒĢ£ ĒÜ©ņåīĒÖ£ņä▒ņØä Ļ▓ĆņĀĢĒĢśņśĆļŗż(Fig. 3C). Cellulase ņāØņé░ ņŚ¼ļČĆ ņŗżĒŚśņØä ņ£äĒĢ┤ carboxymethyl celluloseļź╝ ņØ┤ņÜ®ĒĢśņśĆĻ│Ā, proteaseņŚÉ ļīĆĒĢ┤ņä£ļŖö gellatinņØä ņØ┤ņÜ® ĒĢśņśĆņ£╝ļ®░, amylase ņāØņé░ņØĆ soluble starchļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż. Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ YGB36ņØĆ cellulase, protease ļ░Å amylase ĒÖ£ņä▒ņØ┤ ļ¦żņÜ░ Ļ░ĢĒĢ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. Bacillus ņóģņŚÉņä£ ņØ┤ļ¤¼ĒĢ£ ĒÜ©ņåī ĒÖ£ņä▒ņØĆ ņØ┤ļ»Ė ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ņ£╝ļ®░, ļ│Ė ĻĘĀņŻ╝ņŚÉņä£ļÅä Ļ░ĢĒĢ£ ĒÖ£ņä▒ņØ┤ ĒÖĢņØĖļÉśņŚłļŗż(Bhaskar ļō▒, 2007; Nakamura ļō▒, 1987; Thippeswamy ļō▒, 2014).
ļŗżņØīņ£╝ļĪ£, ņŗØļ¼╝ņāØņןņ┤ēņ¦äņäĖĻĘĀņ£╝ļĪ£ņä£ņØś YGB36ĻĘĀņŻ╝ņØś ĒŖ╣ņä▒ņØä ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢśņŚ¼ siderophore ņāØņé░ ļ░Å ļé£ņÜ®ņä▒ņØĖņé░ņŚÉ ļīĆĒĢ£ ļČäĒĢ┤ļĀźņØä ņŗżĒŚśĒĢśņśĆļŗż. YGB36ņØĆ CAS agar ļ░░ņ¦ĆņŚÉņä£ halo zoneņØä ĒśĢņä▒ĒĢ©ņ£╝ļĪ£ņŹ© ļ╣äĻĄÉņĀü ļåÆņØĆ siderophoreļź╝ ņāØņé░ĒĢśĻ│Ā ņ׳ņŚłņ£╝ļ®░, tricalcium phosphateĻ░Ć ĒżĒĢ©ļÉ£ ļ░░ņ¦ĆņŚÉņä£ ļŗżņåīĻ░äņØś haloļź╝ ļ│┤ņŚ¼ ļČłņÜ®ņä▒ ņØĖņé░ņŚÉ ļīĆĒĢ£ ļČäĒĢ┤ļŖźļĀźņØ┤ ņ׳ņØīņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. Plant growth-promoting rhizobacteria (PGPR)ņØĆ ņŗØļ¼╝ ĻĘ╝ĻČīņŚÉ ņĪ┤ņ×¼ĒĢśļ®┤ņä£ ņ▓Ā(Fe3+) ņä▒ļČä Ļ▓░ĒĢ®ļ¼╝ņ¦łņØĖ siderophoreļź╝ ņāØņé░ĒĢś ņŚ¼ ņ▓Ā ĒØĪņłśņ£©ņØä ļåÆņ×äņ£╝ļĪ£ņŹ© ĒåĀņ¢æņŚÉ ņ׳ļŹś ņ£ĀĒĢ┤ ļ»ĖņāØļ¼╝Ļ│╝ Ļ▓Įņ¤üņĀü ĻĖĖĒĢŁņ×æņÜ®ņØä ĒåĄĒĢ┤ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŗż(BaggņÖĆ Neilands, 1987; Kloepper ļō▒, 1980). SiderophoreļŖö ņŗØļ¼╝ņØś ņ£ĀļÅäņĀäņŗĀņĀĆĒĢŁņä▒ (induced systemic resistance)ņŚÉļÅä Ļ┤ĆņŚ¼ĒĢśņŚ¼ ņŗØļ¼╝ņØś ļ│æņĀĆĒĢŁņä▒ņØä ļåÆņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż(Annapurna ļō▒, 2013; Beneduziļō▒, 2012). ļśÉĒĢ£ ļé£ņÜ®ņä▒ ņØĖņé░ņŚ╝ņØä ļČäĒĢ┤ĒĢśņŚ¼ ņŗØļ¼╝ņØ┤ ņ¦üņĀæ ņé¼ņÜ® ĒĢĀ ņłś ņ׳ļŖö ĒśĢĒā£ņØś ņśüņ¢æņøÉņ£╝ļĪ£ Ļ│ĄĻĖēĒĢ┤ņżīņ£╝ļĪ£ņŹ© ņŗØļ¼╝ņØś ņāØņןņ┤ēņ¦ä ĒÜ©Ļ│╝ļź╝ ļ│╝ ņłśļÅä ņ׳ļŗż(Rodr─▒guezņÖĆ Fraga, 1999). ņØ┤ņÖĆ Ļ░ÖņØ┤ YGB36ņØĆ ĒĢŁĻĘĀĒÖ£ņä▒Ļ│╝ ļŹöļČłņ¢┤ ņŗØļ¼╝ņāØņןņŚÉļÅä ļÅäņøĆņØä ņżä ņłś ņ׳ļŖö ņ£ĀņÜ®ĒĢ£ PGPRļĪ£ ņŚ¼Ļ▓©ņ¦äļŗż.
Ļ│ĀņČö ĒāäņĀĆļ│æĻĘĀņŚÉ ļīĆĒĢ£ YGB36ņØś ĒĢŁĻĘĀĒÖ£ņä▒ņØä ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢśņŚ¼ Ēżņ×Éļ░£ņĢäņ¢ĄņĀ£ĒÜ©Ļ│╝ļź╝ Ļ▓ĆņĀĢĒĢśņśĆļŗż(Fig. 4). ļ®ĖĻĘĀņłśņŚÉņä£ ļ░░ņ¢æĒĢ£ ļīĆņĪ░ĻĄ¼ņØś C. acutatum KACC42403 Ēżņ×ÉļŖö ļ░£ņĢäļź╝ ņŗ£ņ×æĒĢśņŚ¼ 24ņŗ£Ļ░äņŚÉ 80.5%, 48ņŗ£Ļ░äņŚÉ 95%Ļ░Ć ļ░£ņĢäĒĢśņśĆļŗż. ļ░śļ®┤ YGB36 ļ░░ņ¢æņĢĪņŚÉņä£ļŖö 48ņŗ£Ļ░äĻ╣īņ¦Ć ņĀäĒśĆ ļ░£ņĢäĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż. YGB36ņØś ņāØĻĘĀņØ┤ ņĀ£Ļ▒░ļÉ£ ļ░░ņ¢æņŚ¼ņĢĪņŚÉ ņä£ļÅä Ēżņ×Éļ░£ņĢä ņ¢ĄņĀ£ĒÜ©Ļ│╝ļŖö ļ¦żņÜ░ ļåÆĻ▓ī ļéśĒāĆļé¼ļŖöļŹ░, 24ņŗ£Ļ░äĻ╣īņ¦Ć ņĀäĒśĆ ļ░£ņĢäĒĢśņ¦Ć ļ¬╗ĒĢśņśĆĻ│Ā 32ņŗ£Ļ░äņŚÉ 12.4%, 48ņŗ£Ļ░äņŚÉļÅä 25.2%Ļ░Ć ļ░£ņĢäĒĢśļŖöļŹ░ ĻĘĖņ│żļŗż. Ēśäļ»ĖĻ▓Įņ£╝ļĪ£ Ļ┤Ćņ░░ĒĢ┤ ļ│┤ļ®┤, ļīĆņĪ░ĻĄ¼ņŚÉņä£ļŖö ņĄ£ņ┤ł Ļ┤Ćņ░░ņŗ£ļČĆĒä░ ļ░£ņĢäĻ┤ĆņØ┤ ļéśĒāĆļé¼Ļ│Ā, 32ņŗ£Ļ░äņŚÉ ļČĆņ░®ĻĖ░Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, 48ņŗ£Ļ░äņŚÉļŖö ļŗżņłśņØś ļČĆņ░®ĻĖ░Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż. ļ░śļ®┤, ļ░░ņ¢æņŚ¼ņĢĪ ņ▓śļ”¼ĻĄ¼ņŚÉņä£ļŖö 32ņŗ£Ļ░äļČĆĒä░ ļ░£ņĢäĻ░Ć ņĪ░ĻĖłņö® ņŗ£ņ×æĒĢśņśĆņ£╝ļéś, Ļ┤Ćņ░░ņØä ņóģļŻīĒĢ£ 48ņŗ£Ļ░äĻ╣īņ¦Ć ņ¢┤ļ¢ż ļČĆņ░®ĻĖ░ļÅä Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ļ░░ņ¢æņĢĪ ņ▓śļ”¼ĻĄ¼ņŚÉņä£ļŖö Ļ┤Ćņ░░ņØä ņóģļŻīĒĢ£ 48ņŗ£Ļ░äĻ╣īņ¦Ć ņ¢┤ļ¢ĀĒĢ£ ļ│ĆĒÖöļÅä Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. B. subtilisĻ░Ć C. acutatumņØś Ēżņ×Éļ░£ņĢäļź╝ ņ¢ĄņĀ£ĒĢ£ļŗżļŖö ņé¼ņŗżņØ┤ ņØ┤ļ»Ė ņŚ¼ļ¤¼ ļģ╝ļ¼ĖņŚÉņä£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░, YGB36 ņŚÉņä£ļÅä C. acutatumņŚÉ ļīĆĒĢśņŚ¼ Ļ░ĢĒĢ£ ĒÖ£ņä▒ņØ┤ ļéśĒāĆļé¼ļŗż(Lamsal ļō▒, 2012; ┼Įivkovic ļō▒, 2010). ļśÉĒĢ£ B. subtilis CMB32ņØś ļ░░ņ¢æņŚ¼ņĢĪ ņŚÉļŖö iturin A, fengycin, surfactin A ļō▒ņØś lipopetideļōżņØ┤ ĒżĒĢ© ļÉśņ¢┤ ņ׳Ļ│Ā, ņØ┤ļōżņŚÉ ņØśĒĢ£ ĒāäņĀĆļ│æĻĘĀņŚÉņØś ĒĢŁĻĘĀĒÖ£ņä▒ņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż(Kim ļō▒, 2010; OngenaņÖĆ Jacques, 2008).
Ļ│ĀņČö Ļ│╝ņŗżņŚÉ ņāüņ▓śļź╝ ļé┤ņ¢┤ ĒāäņĀĆļ│æĻĘĀņØä ņĀæņóģĒĢ£ Ēøä YGB36 ļ░░ņ¢æņĢĪņØä ĒؼņäØĒĢśņŚ¼ ļČäļ¼┤ĒĢ©ņ£╝ļĪ£ņŹ©, ļ│æ ļ░£ņāØ ņ¢ĄņĀ£ ņĀĢļÅäļź╝ ņĪ░ņé¼ĒĢśņśĆļŗż. ļ░£ļ│æņØ┤ ņ¦äĒ¢ēļÉ£ ļČĆņ£äņŚÉ ņä£ļŖö ņĀäĒśĢņĀüņØĖ ĒāäņĀĆļ│æĻĘĀņØś ļ│æņ¦ĢņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░ ļ░£ņāØ ļ│æļ░śņØś Ļ░£ņłśņÖĆ Ēü¼ĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢ£ Ļ▓░Ļ│╝, ļīĆņĪ░ĻĄ¼ņØś ļ░£ļ│æļÅäļŖö 97.2%ņ×äņŚÉ ļ░śĒĢ┤ YGB36 ņ▓śļ”¼ĻĄ¼ņŚÉņä£ļŖö ļ░£ļ│æļÅäĻ░Ć 33.3%ļĪ£ ļéśĒāĆļé¼ļŗż(Fig. 5). ļ░®ņĀ£Ļ░ĆļŖö 65.7%ļĪ£ ĒÖśņé░ļÉśņŚłļŗż. ņØ┤ļŖö YGB ļ░░ņ¢æņĢĪ ņØ┤ ĒāäņĀĆļ│æĻĘĀņØś Ēżņ×Éļ░£ņĢä ļ░Å ĻĘĀņé¼ņāØņןņØä ņ¢ĄņĀ£Ē¢łļŹś ņāüĻĖ░ in vitro Ēżņ×Éļ░£ņĢäņ¢ĄņĀ£Ļ▓ĆņĀĢ Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢśņśĆļŗż.
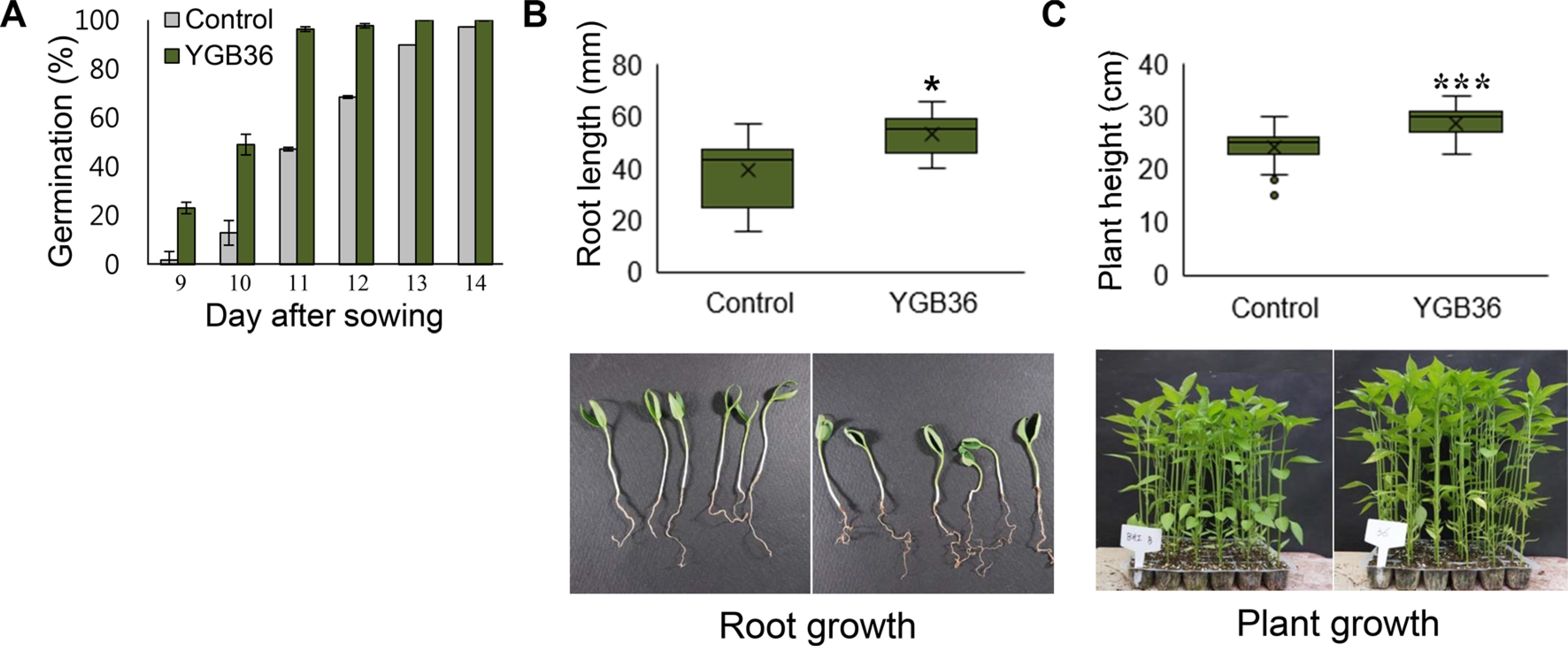
YGB36ņØś PGPRĒÜ©Ļ│╝ Ļ▓ĆņĀĢņØä ņ£äĒĢśņŚ¼, ļ░£ņĢäņ£©ņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ļ░£ņĢäņ£©ņØĆ Ļ┤Ćņ░░ņØä ņŗ£ņ×æĒĢ£ 9ņØ╝ ņ░©ļČĆĒä░ ņ░©ņØ┤Ļ░Ć ļ░£ņāØĒĢśĻĖ░ ņŗ£ņ×æĒĢśņŚ¼ 10ņØ╝ņ░©ņŚÉ Ļ░Ćņן ļÜ£ļĀĘĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż(Fig. 6A). Ļ┤Ćņ░░ņØä ņóģļŻīĒĢ£ 14ņØ╝ņ░©ņŚÉ ļīĆņĪ░ĻĄ¼ņŚÉņä£ 97.2%, YGB36 ņ▓śļ”¼ĻĄ¼ņŚÉņä£ļŖö 100%ņØś ļ░£ņĢäņ£©ņØä ļ│┤ņśĆļŗż. ļīĆņĪ░ĻĄ¼ ļ░£ņĢäņ£©ņØĆ 9ņØ╝ņ░©ļČĆĒä░ 11ņØ╝ņ░©Ļ╣īņ¦Ć 1.9%, 13.0%, 47.2%ņØĖ ļ░śļ®┤, ņ▓śļ”¼ĻĄ¼ņØś ļ░£ņĢäņ£©ņØĆ 23.1%, 49.1%, 96.3%ļĪ£ ļéśĒāĆļé¼ļŗż. YGB36ļź╝ Ļ│ĀņČö ņóģņ×ÉņŚÉ ņ▓śļ”¼ĒĢśņśĆņØä ļĢī, ļīĆņĪ░ĻĄ¼ņŚÉ ļ╣äĒĢśņŚ¼ ļ│┤ļŗż ļ╣©ļ”¼ ļ░£ņĢäĒĢśĻĖ░ ņŗ£ņ×æņśĆĻ│Ā, 2ņŻ╝ ĒøäņŚÉļŖö YGB36ņ▓śļ”¼ĻĄ¼ņÖĆ ļīĆņĪ░ĻĄ¼ ļ¬©ļæÉņŚÉņä£ ļīĆļČĆļČä ļ░£ņĢäĒĢśņśĆļŗż. Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ļīĆņĪ░ĻĄ¼ņÖĆ YGB36 ņ▓śļ”¼ĻĄ¼ņŚÉņä£ņØś ņĄ£ņóģ ļ░£ņĢäņ£©ņØĆ ļŗżņåī ļ╣äņŖĘĒĢśļéś, YGB36 ņ▓śļ”¼ĻĄ¼ņŚÉņä£ņØś ļ░£ņĢä ņåŹļÅäļŖö ĒśäņĀĆĒ׳ ļ░£ļØ╝ņ¦ä Ļ▓āņØä ņĢī ņłś ņ׳ņŚłļŗż. ļīĆļČĆļČäņØś PGPRņØ┤ ņŚ¼ļ¤¼Ļ░Ćņ¦Ć ĻĖ░ņ×æņ£╝ļĪ£ ļ░£ņĢä ņ┤ēņ¦äĻ│╝ Ļ░ÖņØĆ ņŗØļ¼╝ ņāØņ£ĪņŚÉ ņ£ĀņÜ®ĒĢ£ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖöļŹ░, ņØ╝ļĪĆļĪ£ B. subtilisļŖö indole-3-acetic acid (IAA)ņÖĆ Ļ░ÖņØĆ ņŗØļ¼╝ĒśĖļź┤ļ¬¼ņØä ņāØņé░ĒĢśņŚ¼ ņŗØļ¼╝Ļ│╝ņØś ņāüĒśĖņ×æņÜ®ņØä ĒĢ£ļŗż(Swain ļō▒, 2007). ņäĖĻĘĀņØś IAAļŖö ņŗØļ¼╝ņäĖĒżņØś ļČäņŚ┤Ļ│╝ ĒÖĢņן(expansion)ņØä ņ┤ēņ¦äĒĢśņŚ¼ ļ┐īļ”¼Ļ░Ć ņČ£ĒśäĒĢĀ ņłś ņ׳Ļ▓ī ĒĢ©ņ£╝ļĪ£ņŹ© ņóģņ×É Ē£┤ļ®┤ņØä ĒāĆĒīīĒĢśļŖöļŹ░ ļÅäņøĆņØä ņżä ņłś ņ׳ļŗżļŖö ņé¼ņŗżņØ┤ ņל ņĢīļĀżņĀĖ ņ׳ļŗż(Spaepen ļō▒, 2007). YGB36ņØä ņ▓śļ”¼ĒĢśņŚ¼ ļéśĒāĆļé£ Ļ│ĀņČöņóģņ×ÉņØś ļ░£ņĢäņ┤ēņ¦äļÅä ņØ┤ņÖĆ Ļ░ÖņØĆ ĻĖ░ņ×æņØ┤ Ļ┤ĆļĀ©ņØ┤ ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
ņóģņ×É ļ░£ņĢä ņØ┤ĒøäņØś ņ┤łĻĖ░ ņāØņ£ĪĒÜ©Ļ│╝ Ļ▓ĆņĀĢņØä ņ£äĒĢ┤ Ēīīņóģ Ēøä 15ņØ╝ ņ░©ņŚÉ ļ┐īļ”¼ ĻĖĖņØ┤ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ļīĆņĪ░ĻĄ¼ļŖö ĒÅēĻĘĀ 39.1 mmņØĖ ļ░śļ®┤ ņ▓śļ”¼ĻĄ¼ņŚÉņä£ļŖö ĒÅēĻĘĀ 53.6 mmļĪ£, LSD test Ļ▓░Ļ│╝, P=0.019ļĪ£ ļīĆņĪ░ ĻĄ¼ņÖĆ ņ▓śļ”¼ĻĄ¼ ņé¼ņØ┤ņŚÉļŖö ņ£ĀņØśņä▒ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(Fig. 6B). ļö░ļØ╝ņä£, YGB36ņØĆ Ļ│ĀņČö ņóģņ×É ļ░£ņĢä ņØ┤ĒøäņØś ņ┤łĻĖ░ ņāØņ£ĪņØä ņ┤ēņ¦äĒĢśļŖö Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśņŚłļŗż.
Ēīīņóģ Ēøä 58ņØ╝ņØ┤ ņ¦Ćļéś ņ¦ĆņāüļČĆ ĻĖĖņØ┤ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ļīĆņĪ░ĻĄ¼ņÖĆ ņ▓śļ”¼ĻĄ¼Ļ░äņØś ņ¦ĆņāüļČĆ ņāØņ£ĪņØĆ ņ£ĪņĢłņ£╝ļĪ£ļÅä ĻĄ¼ļ│äļÉĀ ļ¦īĒü╝ ņ░©ņØ┤Ļ░Ć ņ╗Ėņ£╝ļ®░ ņĖĪņĀĢĻ▓░Ļ│╝, ļīĆņĪ░ĻĄ¼ņØś ņ¦ĆņāüļČĆ ĻĖĖņØ┤ļŖö ĒÅēĻĘĀ 25.0 cmņØĖ ļ░śļ®┤, ņ▓śļ”¼ĻĄ¼ņØś ĒÅēĻĘĀ ĻĖĖņØ┤ļŖö 28.8 cmņśĆļŗż. LSD test Ļ▓░Ļ│╝, P<0.001ļĪ£ ļīĆņĪ░ĻĄ¼ņÖĆ ņ▓śļ”¼ĻĄ¼ ņé¼ņØ┤ņŚÉļŖö ņ£ĀņØśņä▒ņØ┤ ļ¦żņÜ░ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż (Fig. 6C). ļö░ļØ╝ņä£, YGB36ņØś Ļ│ĀņČö ņāØņ£Īņ┤ēņ¦ä ĒÜ©Ļ│╝Ļ░Ć ļ¦żņÜ░ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśņŚłļŗż.
ņāØļ¼╝ĒĢÖņĀü ļ░®ņĀ£ņĀ£ļź╝ ĒÖöĒĢÖļåŹ ņĢĮĻ│╝ Ēś╝ņÜ® Ēś╣ņØĆ ĻĄÉĒśĖ ņé┤ĒżĒĢśņśĆņØä ļĢī ņä£ļĪ£ ņāüņČ®ņ×æņÜ®ņØä ĒĢśļŖöņ¦Ć ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ņŗżĒŚśņØä ņłśĒ¢ēĒĢśņśĆļŗż. ņāüņÜ®ĒÖöļÉśņ¢┤ ņ׳ļŖö ņé┤ĻĘĀņĀ£ 21ņóģ ļ░Å ņé┤ņČ®ņĀ£ 14ņóģņØä ņĀ£ņĪ░ņé¼ņØś ņ¦Ćņ╣©ņØä ĻĖ░ņżĆņ£╝ļĪ£ ļ░śļ¤ē, ņĀĢļ¤ē ļ░Å ļ░░ļ¤ēņ£╝ļĪ£ ņĀ£ņĪ░ĒĢśņŚ¼ ņØ┤ņŚÉ ļīĆĒĢ£ YGB36ņØś ņāØņ£ĪņŚÉ ņØś ņśüĒ¢źņØä ĒÖĢņØĖĒĢśņśĆļŗż(Table 1). ņ┤Ø 21ņóģņØś ņé┤ĻĘĀņĀ£ ņżæņŚÉņä£ pyraclostrobin ļ░Å tebuconazole ļō▒ņØś ņøÉņĀ£ļź╝ ĒżĒĢ©ĒĢ£ ņé┤ĻĘĀņĀ£ 11ņóģņØĆ YGB36ņØś ņāØņ£ĪņŚÉ ņĀäĒśĆ ņ¦ĆņןņØä ņŻ╝ņ¦Ć ņĢŖņĢśņ£╝ļ®░, streptomycin Ļ│╝ validamycin-AņØś ĒĢ®ņĀ£ņØś Ļ▓ĮņÜ░ ņĀĢļ¤ē ņØ┤ņāüņŚÉņä£ļ¦ī ņāØņ£Ī ņĀĆĒĢ┤Ļ░Ć ļéśĒāĆļé¼ļŗż. ĒĢ£ĒÄĖ, ņŗżĒŚśņŚÉ ņé¼ņÜ®ĒĢ£ ņé┤ņČ®ņĀ£ 14ņóģņØĆ YGB36ņØś ņāØņ£Ī ņŚÉ ņĀäĒśĆ ņśüĒ¢źņØä ņŻ╝ņ¦Ć ņĢŖņĢśļŗż. ļö░ļØ╝ņä£, YGB36Ļ│╝ ņé┤ĻĘĀņĀ£ņØś Ēś╝ņÜ® ņŚ¼ļČĆļŖö ņé┤ĻĘĀņĀ£ ņóģļźśņŚÉ ļö░ļØ╝ ļŗżļź┤ļ»ĆļĪ£, Ēś╝ņÜ® ņŗ£ ņŻ╝ņØśĒĢśļŖö Ļ▓āņØ┤ ļ░öļ×īņ¦üĒĢśļ®░, ņé┤ņČ®ņĀ£ņÖĆņØś Ēś╝ņÜ®ņŚÉņä£ļŖö ņØ┤ļź╝ Ļ│ĀļĀżĒĢśņ¦Ć ņĢŖņĢäļÅä ļÉĀ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. ļŗżļ¦ī, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņé¼ņÜ®ĒĢ£ ņé┤ĻĘĀņĀ£ ļ░Å ņé┤ņČ®ņĀ£Ļ░Ć Ēśäņ×¼ ņāüņÜ®ĒÖöļÉ£ ļ¬©ļōĀ ĒÖöĒĢÖļåŹņĢĮņØä ļŗżļŻ©ņ¦ĆļŖö ļ¬╗Ē¢łņ£╝ļ»ĆļĪ£ ņāØļ¼╝ĒĢÖņĀü ņĀ£ņĀ£ Ļ░£ļ░£ ņŗ£ ļŗżņ¢æĒĢ£ ĒÖöĒĢÖļåŹņĢĮ ļ░Å ļŗżļźĖ ļ»ĖņāØļ¼╝ņĀ£ņÖĆņØś Ēś╝ņÜ® ņŚ¼ļČĆņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
ņ×ÉņŚ░Ļ│äņŚÉļŖö ņĢäņ¦ü ĒāÉņāēļÉśņ¦Ć ņĢŖņØĆ ņ£ĀņÜ®ņ×ÉņøÉņØ┤ ļ¦ÄņØ┤ ņĪ┤ņ×¼ĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ņ╣£ĒÖśĻ▓Į ņāØļ¼╝ļåŹņĢĮņ£╝ļĪ£ņØś Ļ░£ļ░£Ļ░ĆļŖźņä▒ņØ┤ ļ¦żņÜ░ ļåÆņØĆ ļ»ĖņāØļ¼╝ņØä ĒāÉņāēĒĢśņŚ¼ ņ£ĀņÜ®ņ×ÉņøÉņ£╝ļĪ£ņä£ ĒÖ£ņÜ®ĒĢśļŖö ņŗ£ļÅäļŖö ņśżļלņĀäļČĆĒä░ ņØ┤ļŻ©ņ¢┤ņĀĖ ņśżĻ│Ā ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ĒāÉņāēļÉ£ YGB36ņØĆ Ļ░ĢĒĢ£ ĒĢŁĻĘĀĒÖ£ ņä▒Ļ│╝ ļŹöļČłņ¢┤ ņØĖņé╝ļ┐īļ”¼ņŹ®ņØīļ│æĻĘĀ(C. destructans)Ļ│╝ ĒāäņĀĆļ│æĻĘĀ(C. acutatum, C. gloeosporioides)Ļ│╝ Ļ░ÖņØ┤ ļäōņØĆ ĒĢŁĻĘĀņŖżĒÄÖĒŖĖļ¤╝ņØä ļ│┤ņ£ĀĒĢśĻ│Ā ņ׳ļŗż. Ļ▓īļŗżĻ░Ć siderophore ņāØņé░ ļ░Å ļé£ņÜ®ņä▒ ņØĖņé░ņŚ╝ ļČäĒĢ┤ļŖź ļśÉĒĢ£ ļ│┤ņ£ĀĒĢśĻ│Ā ņ׳ņ¢┤ ņØ┤ļ¤¼ĒĢ£ ĒŖ╣ņ¦ĢļōżņØ┤ ņŗØļ¼╝ņāØņןņŚÉ ņ¦üņĀæņĀüņØĖ ļÅäņøĆņØä ņżä ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆļÉ£ļŗż. ņŗżņĀ£ļĪ£ YGB36ņØ┤ Ļ│ĀņČöņŚÉņä£ Ļ░Ćņן ļ¼ĖņĀ£Ļ░Ć ļÉśĻ│Ā ņ׳ļŖö ĒāäņĀĆļ│æĻĘĀņØä ņ¢ĄņĀ£ĒĢśĻ│Ā, Ļ│ĀņČö ņóģņ×É ļ░£ņĢä ļ░Å ņāØņ£Īņ┤ēņ¦äĻ╣īņ¦Ć ĻĖŹņĀĢņĀüņØĖ ĒÜ©Ļ│╝ļź╝ ļ│┤ņ£ĀĒĢśĻ│Ā ņ׳ņØīņØ┤ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ĒÖĢņØĖļÉśņŚłļŗż. ņĢäņÜĖļ¤¼ ņŗżņĀ£ ļåŹĻ░ĆņŚÉņä£ ņŻ╝ļĪ£ ņé¼ņÜ®ĒĢśĻ│Ā ņ׳ļŖö ļŗżņ¢æĒĢ£ ĒÖöĒĢÖņĢĮņĀ£ņÖĆņØś Ēś╝ņÜ® Ļ░ĆļŖźņä▒ļÅä ņĀ£ņŗ£ĒĢśņśĆļŗż. ĒĢ£ĒÄĖ YGB36ņØĆ B. subtilisņóģņ£╝ļĪ£ņä£, ĒĢ┤ļŗ╣ ņóģņØĆ ņĢłņĀäņä▒ņØ┤ ņ×ģņ”ØļÉśņ¢┤ ņØ┤ļ»Ė ņśżļ×£ ĻĖ░Ļ░ä ņé¼ņÜ®ļÉśņ¢┤ ņś© ĻĘĀņŻ╝ņØ┤ļ»ĆļĪ£ ņāØļ¼╝ļåŹņĢĮņ£╝ļĪ£ņä£ņØś Ļ░£ļ░£ņŚÉ ĒĢ£ņĖĄ ņÜ®ņØ┤ĒĢśļŗż. ņØ┤ļĪ£ņŹ© YGB36ņØĆ Ļ│ĀņČöĒāäņĀĆļ│æ ņ¢ĄņĀ£ ļ░Å ņŗØļ¼╝ņāØņ£Īņ┤ēņ¦äņØä ņ£äĒĢ£ ņ╣£ĒÖśĻ▓ĮņĀ£ņĀ£ļĪ£ņä£ņØś ļåÆņØĆ ĒÖ£ņÜ®Ļ░ĆļŖźņä▒ņØä ļ│┤ņ£ĀĒĢśĻ│Ā ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
Acknowledgments
The research was supported by a grant from 2017 Subsidy for overseas dispatch research of Andong National University.
Fig.┬Ā1
In vitro screening of antagonistic activity of rhizosphere soil bacteria. (A) Antagonistic activity of rhizosphere bacteria against Cylin- drocarpon destructans causes ginseng root rot. Red arrow shows antifungal activity of strain YGB36. (B-F) Antifungal activities of YGB36 against Collectotrichum acutatum KACC42403 (B, E), Collectotrichum gloeosporioides KACC42690 (C), C. acutatum KACC40847 (D), and C. acutatum KACC42509 (F). Small photographs in panels D, E, and F show that only fungi grow
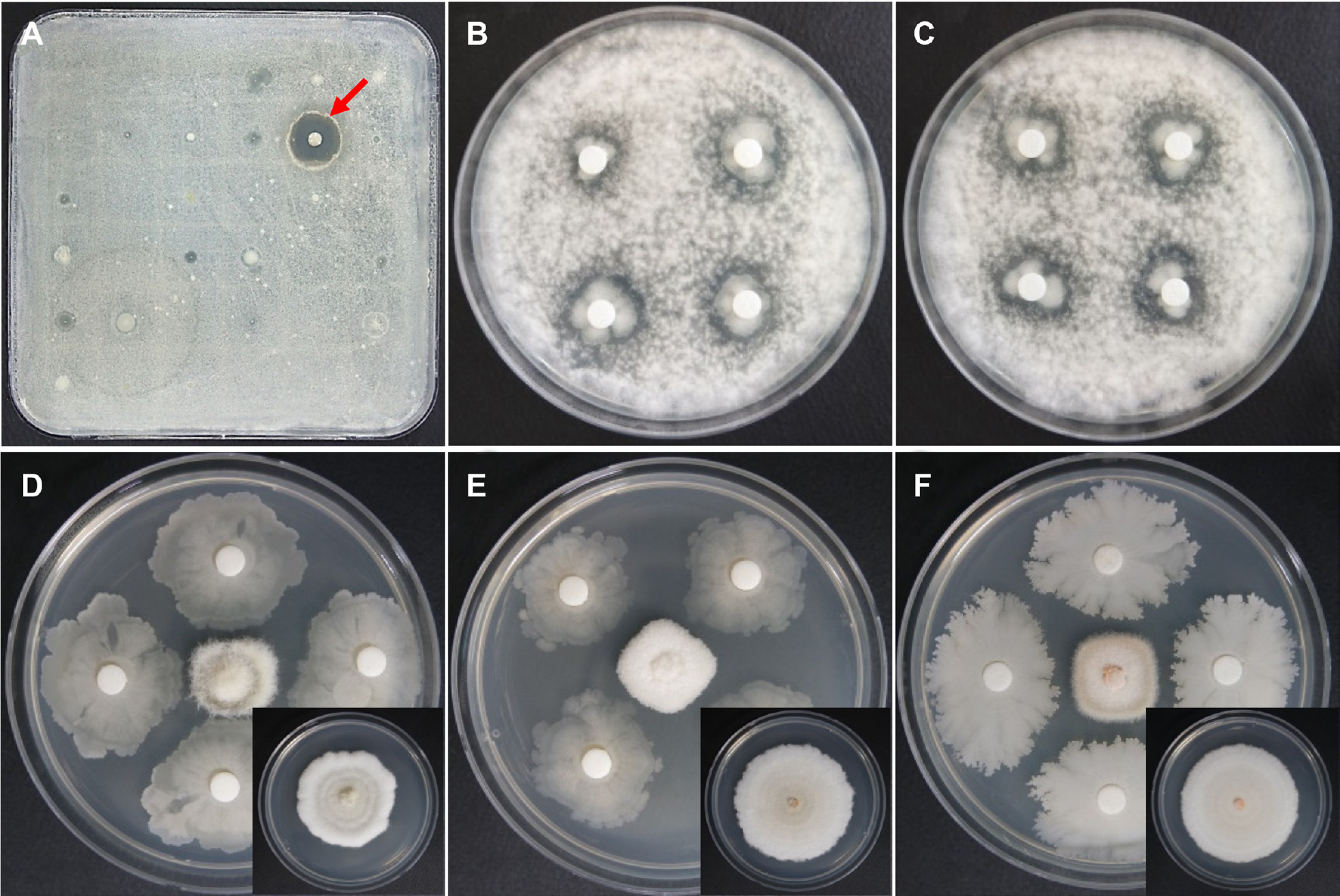
Fig.┬Ā2
Neighbor-joining phylogenetic tree based on 16S rRNA gene sequences of strain YGB36 and the closely related species. Bootstrap values (expressed as percentages of 1,000 replications) greater than 50% are shown at branch points and the species names followed by the GenBank accession numbers. Scale bar=1.0 substitutions per 100 nucleotide position.
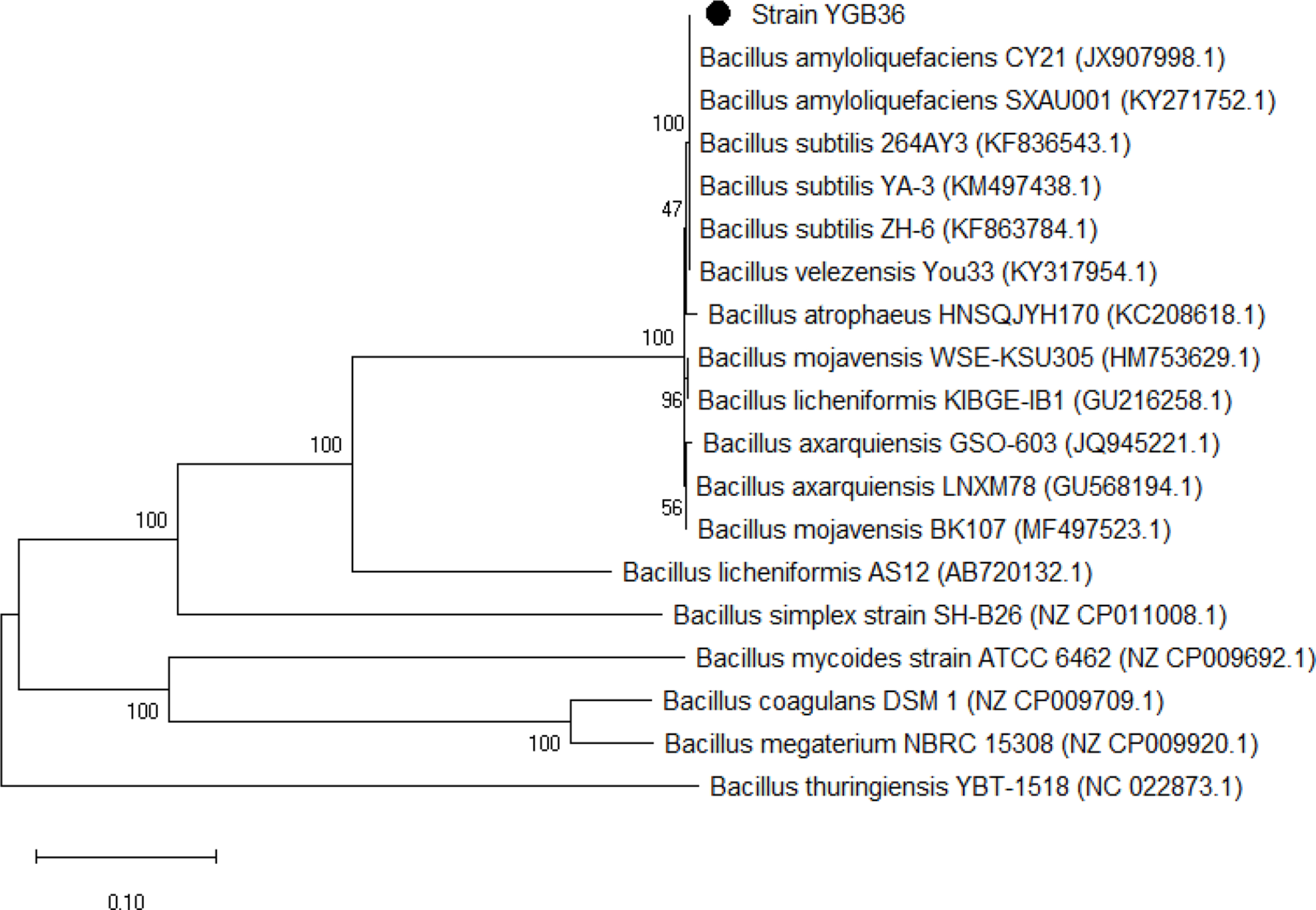
Fig.┬Ā3
Characterization of growth and antagonistic substances in Bacillus subtilis YGB36. (A, B) Growth curve of YGB36 at various incubation periods (1-7 days). (C) The ability of YGB36 on production of cellulose, protease, amylase, siderophore, and phosphate solubilization using in vitro assays. The disk at the bottom of each plates is control (brain heart infusion).
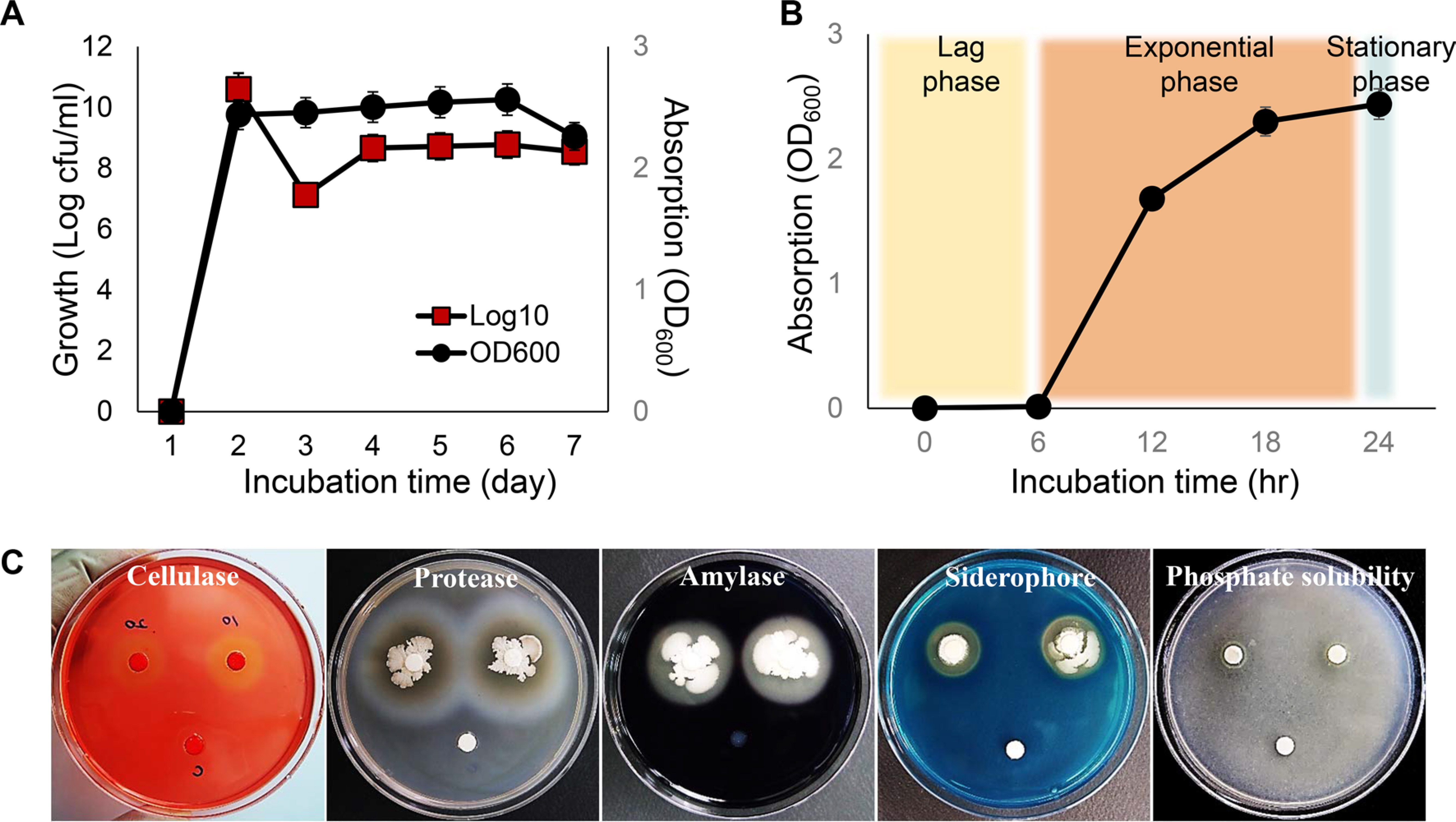
Fig.┬Ā4
Effect of YGB36 cell suspensions or culture filtrate on conidial germination of Colletotrichum acutatum. (A) Greater suppression of conidia was observed when treated with YGB36 cell suspensions in comparison with culture filtrate, while conidia germination occurred in non-treated control 48 hr after incubation at 28┬░C. (B) Light microscopic observations revealed that germ tube formation was observed at 40 hr by treatment with culture filtrate, and no germ tube was observed by treatment with cell suspensions, while germ tube, appressorium, and hyphae were observed at 8 hr, 32 hr, and 48 hr, respectively, in non-treated control. The experiment was carried out at least two times with three replicates per treatment. Gt, germ tube; Ap, appressorium; Hy, hyphae. Scale bars=10 ┬Ąm.
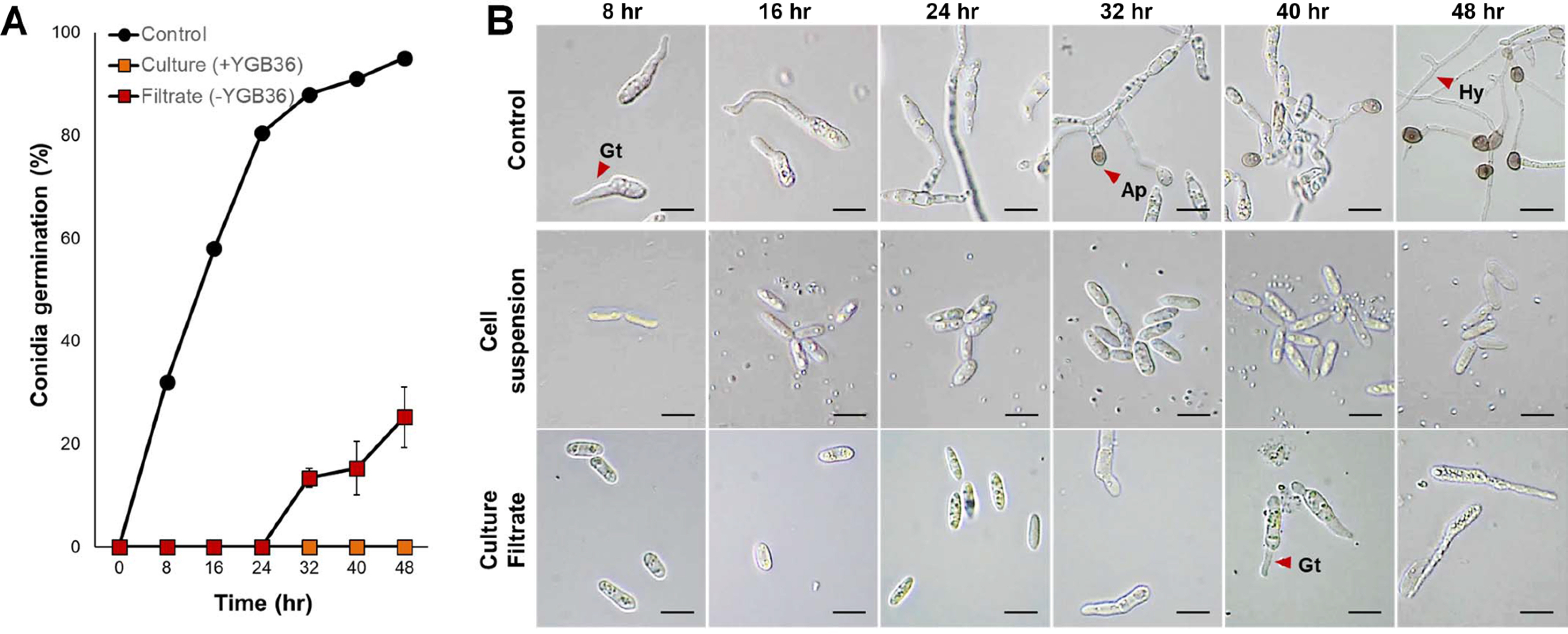
Fig.┬Ā5
Suppression of disease development of anthracnose infec- tion on detached green pepper fruits by Bacillus subtilis YGB36 sus- pensions. (A) The detached fruits after wiping with alcohol were inoculated with the conidial spores of Colletotrichum acutatum, and after drying for 1 hr, the fruits were treated with bacterial suspensions under laboratory condition in square plates. Brain heart infusion was used as a control. The disease severity was was rcorded 10 days after the incubation at room temperature. Treat- ment with YGB36 suspensions showing smaller lesions in compari- son with the control. (B) The disease severity data is expressed in bar diagram.

Fig.┬Ā6
Effect of YGB36 cell suspensions on growth promotion of red pepper in comparison with the non-treated control under greenhouse conditions. (A) The red-pepper seeds after soaking in the bacterial suspensions of YGB36 were sown in the plastic trays containing garden soil for germination. The germinated seedlings were counted from 9 to 14 days and the germination percentage was calculated. Brain heart infusion was used as a control. (B) The root length of germinated seedlings were recorded and analyzed in comparison with the control. (C) Plant growth promoting effect was checked by soil drench of the seedlings with bacterial suspensions of YGB36 cell suspensions and com- pared with the control (brain heart infusion). *P<0.1, ***P<0.001.
Table┬Ā1
Screening of commercial fungicide and insecticide sensitivity test against YGB36
Table┬Ā2
Metabolic activities of Bacillus subtilis YGB36 in the Biolog GEN III microplate assay and biochemical activity in the Vitek 2 assay
| Biolog (GEN III microplate) | Vitek | ||
|---|---|---|---|
|
|
|
||
| Substrates | Responses a | Substrates | Responses a |
| Dextrin | + | Beta-xyloxidase | + |
| D-Maltose | + | L-Lysine-arylamidase | - |
| D-Trehalose | + | L-Aspartate arylamidase | + |
| N-Acetyl-D-galactosamine | - | Leucine arylamidase | + |
| N-Acetyl neuraminic acid | - | Phenylalanine arylamidase | + |
| 1% NaCl | + | L-Proline arylamidase | - |
| D-Fructose | + | Beta-galactosidase | - |
| 3-Methyl glucose | - | L-Pyrrolydonyl-arylamidase | + |
| D-Serine | - | Alpha-galactosidase | + |
| Myo-inositol | + | Alanine arylamidase | + |
| Glycerol | + | Tyrosine arylamidase | + |
| D-Fructose-6-PO4 | + | Ala-Phe-Pro arylamidase | + |
| Gelatin | + | Cyclodextrine | - |
| Glycyl-L-proline | + | D-Galactose | - |
| L-Alanine | + | Glycogene | - |
| D-Gluconic acid | + | Myo-inositol | + |
| D-Glucuronic acid | + | Alpha-mannosidase | - |
| Glucuronamide | - | Maltotriose | - |
| Citric acid | + | Glycine arylamidase | - |
| ╬▒-Keto-glutaric acid | - | D-Mannitol | - |
| D-Malic acid | - | D-Mannose | + |
| Acetic acid | + | D-Melezitose | + |
| Formic acid | + | N-Acetyl-D-glucosamine | - |
| Aztreonam | - | Palatinose | + |
| Minocycline | - | L-Rhamnose | - |
| Niaproof 4 | - | Beta-glucosidase | + |
| Tetrazolium blue | - | Beta-mannosidase | + |
| Potassium tellurite | + | Phosphoryl chloline | - |
| Sodium bromate | + | Pyruvate | + |
| ╬▒-Hydroxy-butyric acid | - | Alpha-glucosidase | + |
References
Annapurna, K., Kumar, A., Kumar, L. V., Govindasamy, V., Bose, P. and Ramadoss, D. ed. by D. K. Maheshwari, 2013. PGPR-induced systemic resistance (ISR) in plant disease management. In: Bacteria in Agrobiology: Disease Management, Springer, Berlin, Germany. pp. 405-425.

Bagg, A. and Neilands, J. B. 1987. Molecular mechanism of regulation of siderophore-mediated iron assimilation. Microbiol. Rev 51: 509-518.



Beneduzi, A., Ambrosini, A. and Passaglia, L. M. P. 2012. Plant growth-promoting rhizobacteria (PGPR): their potential as antagonists and biocontrol agents. Genet. Mol. Biol 35(4 Suppl): 1044-1051.

Bhaskar, N., Sudeepa, E. S., Rashmi, H. N. and Selvi, A. T. 2007. Partial purification and characterization of protease of Bacillus proteolyticusCFR3001 isolated from fish processing waste and its antibacterial activities. Bioresour. Technol 98: 2758-2764.


Borriss, R. ed. by D. K. Maheshwari, 2011. Use of plant-associated Bacillusstrains as biofertilizers and biocontrol agents in agriculture. In: Bacteria in Agrobiology: Plant Growth Responses, Springer-Verlag, Germany. pp. 41-76.

Dunlap, C. A., Kim, S.-J., Kwon, S.-W. and Rooney, A. P. 2016.
Bacillus velezensisis not a later heterotypic synonym of Bacillus amyloliquefaciens; Bacillus methylotrophicus, Bacillus amyloliquefacienssubsp. plantarumand 'Bacillus oryzicola' are later heterotypic synonyms of Bacillus velezensisbased on phylogenomics. Int. J. Syst. Evol. Microbiol 66: 1212-1217.


Han, J.-H., Park, G.-C., Kim, J.-O. and Kim, K. S. 2015. Biological control of Fusarium stalk rot of maize using Bacillusspp. Res. Plant Dis 21: 280-289. (In Korean)

Han, K.-S., Park, J.-H., Han, Y.-K. and Hwang, J.-H. 2009. Pathogenicity and occurrence of pepper seedling anthracnose caused by Collectotrichum acutatum
. Res. Plant Dis 15: 88-93. (In Korean)

Kim, J. T., Park, S.-Y., Choi, W., Lee, Y.-H. and Kim, H. T. 2008. Characterization of Collectotrichumisolates causing anthracnose of pepper in Korea. Plant Pathol. J 24: 17-23.

Kim, P. I., Ryu, J., Kim, Y. H. and Chi, Y.-T. 2010. Production of biosurfactant lipopeptides Iturin A, fengycin, and surfactin A from Bacillus subtilisCMB32 for control of Colletotrichum gloeosporioides
. J. Microbiol. Biotechnol 20: 138-145.


Kim, S.-T. and Yun, S.-C. 2011. Biocontrol with Myxococcussp. KYC 1126 against anthracnose in hot pepper. Plant Pathol. J 27: 156-163.

Kloepper, J. W., Leong, J., Teintze, M. and Schroth, M. N. 1980. Enhanced plant growth by siderophores produced by plant growth-promoting rhizobacteria. Nature 286: 885-886.

Kumar, S., Stecher, G. and Tamura, K. 2016. MEGA7: molecular evolutionary genetics analysis version 7. Mol. Biol. Evol 337: 1870-1874.
Kwak, Y.-K., Kim, I.-S., Cho, M.-C., Lee, S.-C. and Kim, S. 2012. Growth inhibition effect of environment-friendly farm materials in Collectotrichum acutatum in vitro
. J. Bio-Environ. Control 21: 127-133.
Lamsal, K., Kim, S. W., Kim, Y. S. and Lee, Y. S. 2012. Application of rhizobacteria for plant growth promotion effect and biocontrol of anthracnose caused by Colletotrichum acutatumon Pepper. Mycobiology 40: 244-251.



Lee, S. Y. 2010. Biological control of anthracnose (Collectotrichum gloeosporioides) in pepper by Streptomyces cavourensis SY224. Graduate School, Chonnam National University; Gwangju, Korea: 41.M.S. thesis
Nakamura, A., Uozumi, T. and Beppu, T. 1987. Nucleotide sequence of a cellulase gene of Bacillus subtilis
. Eur. J. Biochem 164: 317-320.


Ongena, M. and Jacques, P. 2008.
Bacilluslipopeptides: versatile weapons for plant disease biocontrol. Trends Microbiol 16: 115-125.


Paik, S. B., Kim, D. W. and Oh, Y. S. 1996. Biocontrol for red pepper anthracnose (Collectotrichum dematium) with phyllospheral microorganisms. B.S. thesis. Konkuk University; Seoul, Korea.
Park, J.-W., Balaraju, K., Kim, J.-W., Lee, S.-W. and Park, K. 2013. Systemic resistance and growth promotion of chili pepper induced by an antibiotic producing Bacillus vallismortis strain BS07. Biol. Control 65: 246-257.

Park, S.-J., Kim, G.-H., Kim, A. H., Lee, H., Gwon, H.-W., Kim, J. et al. 2012. Controlling effect of agricultural organic materials on phytophthora blight and anthracnose in red pepper. Res. Plant Dis 18: 1-9. (In Korean)

Park, S. M., Jung, H. J. and Yu, T. S. 2006. Screening of an antagonistic bacterium for control of red-pepper anthracnose,. Collectotrichum gloeosporioides. J. Life Sci 16: 420-426.
Qiao, J.-Q., Wu, H.-J., Huo, R., Gao, X.-W. and Borriss, R. 2014. Stimulation of plant growth and biocontrol by Bacillus amyloliquefacienssubsp. plantarumFZB42 engineered for improved action. Chem. Biol. Technol. Agric 1: 12


Rodr├Łguez, H. and Fraga, R. 1999. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnol. Adv 17: 319-339.


Sazci, A., Erenler, K. and Radford, A. 1986. Detection of cellulolytic fungi by using Congo red as an indicator: a comparative study with the dinitrosalicyclic acid reagent method. J. Appl. Bacteriol 61: 559-562.

Seo, J., Yi, Y., Kim, B.-S., Hwang, J. M. and Choi, S. W. 2011. Disease occurrence on red-pepper plants surveyed in northern Kyungbuk province, 2007-2008. Res. Plant Dis 17: 205-210. (In Korean)

Spaepen, S., Vanderleyden, J. and Remans, R. 2007. Indole-3-acetic acid in microbial and microorganism-plant signaling. FEMS Microbiol. Rev 31: 425-448.


Swain, M. R., Naskar, S. K. and Ray, R. C. 2007. Indole-3-acetic acid production and effect on sprouting of yam (Dioscorea rotundataL.) minisetts by Bacillus subtilisisolated from culturable cowdung microflora. Pol. J. Microbiol 56: 103-110.

The Korean Society of Plant Pathology. 2009. List of Plant Disease in Korea. 5th ed. The Korean Society of Plant Pathology, Suwon, Korea. pp. 859 pp.
Thippeswamy, S., Girigowda, K. and Mulimani, V. H. 2014. Isolation and identification of ╬▒-amylase producing Bacillussp. from dhal industry waste. Indian J. Biochem. Biophys 43: 295-298.
Wang, L.-T., Lee, F.-L. and Tai, C.-J. 2008.
Bacillus velezensisis a later heterotypic synonym of Bacillus amyloliquefaciens
. Int. J. Syst. Evol. Microbiol 58: 671-675.


Weisburg, W. G., Barns, S. M., Pelletier, D. A. and Lane, D. J. 1991. 16S ribosomal DNA amplification for phylogenetic study. J. Bacteriol 173: 697-703.



┼Įivkovic, S., Stojanovic, S., Ivanovic, ┼Į., Gavrilovi─ć, V., Popovi─ć, T. and Bala┼Š, J. 2010. Screening of antagonistic activity of microorganisms against Colletotrichum acutatumand Colletotrichum gloeosporioides
. Arch. Biol. Sci. Belgrade 63: 611-623.
- TOOLS



 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




