Plasmodiophora brassicae 에 의한 콜라비 뿌리혹병 발생
Ocurrence of Clubroot Caused by Plasmodiophora brassicae on Kohlrabi in Korea
Article information
Abstract
From 2016 to 2018, approximately 15% of kohlrabi were observed displaying significant clubroot symptoms in farmer’s fields in Jeju, Korea. The initial infection appeared as hypertrophy of root hairs, and as the disease progressed, galls formation occurred on the main roots, finally disease progress resulted in yellowing and wilting of leaves. Pathogenicity was proven by artificial inoculation of plants with resting spore suspension, fulfilling Koch’s postulates. The resting spore is one-celled, spherical and subspherical, colorless, and 3–5 mm in diameter. On the basis of the morphological characteristics and phylogenetic analyses of internal transcribed spacer rDNA, the causal agent was identified as Plasmodiophora brassicae. To our knowledge, this is the first report on the occurrence of P. brassicae on kohlrabi in Korea.
콜라비(Brassica oleracea var. gongylodes L.)는 십자화과(Brassicaceae) 배추속(Brassica)에 속한다. ‘순무양배추’ 또는 ‘구경양배추’라고도 하며, 양배추와 순무를 교배시킨 채소이다. 열량이 낮고 섬유질이 풍부해서 다이어트와 변비 개선에 좋으며, 수분과 비타민 C 함유량이 높아 피로 해소, 노화 방지, 당뇨 예방에 효과적이다. 비대한 줄기는 샐러드나 생식용, 채로 썰어서 피클이나 물김치로, 잎은 쌈채소나 녹즙 등으로 이용된다(Lee 등, 2010). 우리나라에서는 제주도를 중심으로 120 ha 정도가 재배되고 있으며, 지구온난화에 따른 기후변화 대응작목으로 전북을 비롯한 일부 내륙에서 재배가 확대되고 있다(Choi 등, 2015).
Plasmodiophora brassicae는 토양전염성 절대기생균으로 십자화과 작물에 뿌리혹병을 일으킨다. 이 병은 감염된 뿌리에 혹을 형성하므로 영양분의 이동을 억제하여 작물이 시들거나 수량 감소를 가져온다. 유묘기에 감염되면 작물이 짧은 기간 내에 시들어 죽게 되지만, 성숙기에 감염되면 작물이 생존은 지속하나 상품성에 영향을 미치게 된다(Lee 등, 2008; Suwabe 등, 2003). 또한, 병이 진전되면 잎 색깔이 변하거나(become reddened), 백화(chlorotic), 괴저(necrotic), 잎이 떨어져 분리(abscise) 되는 경우도 있으며, 유지 식물에서는 종자 생산량과 품질의 하락을 가져오고, 순무에서는 뿌리혹 형성으로 품질, 수량, 저장성, 기호성 등이 떨어진다(Kageyama와 Asano, 2009).
P. brassicae의 기주식물은 뿌리털과 피질층(cortical stage)을 가지고 있는 십자화과가 대부분으로 그 중에 꽃양배추(Brassica oleracea)의 여러 품종, 서양 채소류(방울다다기양배추, 양배추, 브로콜리, 콜리플라워, 케일, 콜라비), 순무류(순무, 순무평지), 동양 엽채류(배추), 그리고 유채, 머스터드, 겨자, 갓, 무, 꽃무, 애기장대 등이다(Dixon, 2009).
P. brassicae의 생활사는 토양내 생존, 뿌리털감염(root hair infection), 피질감염(cortical infection) 등 세 단계로 구분된다. 휴면포자는 토양 내에서 오랫동안 살아남을 수 있도록 내구성이 갖추어져 있다. 이들 휴면포자는 1차 유주포자(primary zoospore)를 방출한다. 1차 유주포자가 식물체 뿌리털 표면에 접근하여 세포벽을 관통한다. 이 단계를 뿌리털감염 단계라고 한다. 뿌리털 안에서는 병원균이 1차 변형체(primary plasmodia)를 형성한다. 변형체 안에서는 핵분열이 동시에 일어나고, 이어서 유주포자낭(zoosporangia)으로 분열한다. 각각의 유주포자낭 안쪽에 4–16개의 2차 유주포자(secondary zoospore)가 형성되어 토양에 방출하게 된다. 2차 유주포자는 뿌리의 피질층에 침투하는데 이를 피질감염(cortical infection)이라고 한다. 침입한 뿌리 세포 내에서 병원균은 세포 비대와 관련된 2차 변형체(secondary plasmodia)로 진행되고 그 다음은 조직 내에서 혹이 형성된다. 변형체는 마침내 휴면포자의 새로운 세대로 발전하여 토양 내에서 살아간다(Devos 등, 2005; Kageyama와 Asano, 2009).
P. brassicae는 온화하고 습한 전 세계 온대지역에 널리 분포하고 있으며, 십자화과 작물의 재배가 증가함에 따라 병원균의 피해도 커지고 있다. 병원균은 유럽에서 최초 발병되어 미국이나 호주, 다른 나라로 이주민들에 의해 옮겨졌으며, 보고된 자료는 아니지만 인도네시아, 자바, 잠비아까지 발생하는 것으로 추정된다(Kageyama와 Asano, 2009).
토양병균인 P. brassicae는 휴면포자로 토양 내에서 15–20년간 휴면상태를 유지할 수 있으며, 수명 반감기(half-life)는 3.7년으로 십자화과 식물의 짧은 재배 기간을 감안할 때 중요한 병해가 아닐 수 없다. 따라서 방제 대책으로는 저항성 품종을 육종하는 방법이 있으나 병원균의 유전적 변이로 인해 효과가 떨어지는 경우가 많다. 또한 작물을 돌려짓기 하거나 토양개량법이 있다. 토양내 높은 pH와 칼슘 함량은 뿌리혹병의 발병률을 줄이는 것으로 알려져 있지만 정확한 기작은 밝혀지지 않고 있다. 석회와 같은 토양개량제는 사용 시기가 중요하며, 정식 3–4일 후가 가장 좋다(McGrann 등, 2016).
2016부터 2018년도에 제주도 농가포장에서 재배되고 있는 콜라비(품종 콜리브리)에서 시듦 증상이 나타났다. 시듦 증상을 보이는 개체는 뿌리에 혹을 형성하였다. 이병주에서 발생한 뿌리혹병의 균학적 특성 및 rDNA 염기서열 분석을 기초로 ‘Plasmodiophora brassicae’로 동정하였고, 콜라비 유묘에 인공접종하여 병원성을 확인하였다. 따라서 본 연구는 콜라비 뿌리 혹병의 발병 및 병징, 병원성 검정, 균학적 특징 및 염기서열 분석결과에 대하여 보고한다.
발병 및 병징.
2016년부터 2018까지 제주도내 농가포장에서 재배되고 있는 콜라비에 뿌리혹병이 지속적으로 발생하였다. 콜라비 재배농가는 뿌리혹병을 매년 발생하는 것으로 인식하고 있었다. 뿌리혹병은 정식 후 30일부터 발생하기 시작하였으며, 재배기간 중 수분이 많고 토양 온도가 상승하는 3월에 최고발병률(27.2%)을 보였다. 농가포장에서 재배되는 품종간의 발병률 차이는 없었으며, ‘콜리브리’와 ‘아삭콜’에서 모두 발병하였다(Fig. 1A). 감염 초기에는 뿌리털 부분이 정상주 뿌리털에 비해 약간 비대했으며, 병이 진전되면서 뿌리털은 적어지고, 뿌리 중심부가 비대해져 혹이 형성되었으며, 잎이 시들고 끝이 누렇게 변했다(Fig. 1B, C). 생육초기에 감염된 개체는 수확기에 잔뿌리가 거의 없었으며, 뿌리 대부분이 큰 혹으로 이루어졌고 시듦 증상이 심했다. 또한, 식용으로 하는 줄기 부분의 발달이 빈약하여 상품성이 없었다. 그러나 생육 후기에 감염된 개체는 뿌리털 부분에만 감염되어 정상적인 개체와 차이가 없었으며, 시듦 증상이 덜했다. 콜라비 뿌리혹병에 감염된 시료는 고려대학교 진균표본실에 기탁하였다(KUS-F30866).

Typical clubroot symptoms naturally infected kohlrabi caused by Plasmodiophora brassicae. (A) The infected crop showing wilt symptoms and plants loss. (B) Galls produced on the roots. (C) Close-up of clubroot symptoms. Clubroot for 50 days after inoculation with resting spores suspension for pathogenicity test.
병원성 검정.
병원성 검정을 위한 휴면포자의 현탁액은 콜라비에 형성된 뿌리혹에서 Cho 등 (2003), Williams (1966)의 방법을 변형하여 추출한 후 사용하였다. 4°C에서 2개월간 보관된 콜라비 뿌리혹에 휴면포자가 들어있는지를 현미경으로 확인한 후, 뿌리혹 40 g에 멸균수 50 ml을 넣고 유발과 유봉을 사용하여 마쇄하였다. 마쇄된 현탁액은 3장의 거즈로 찌꺼기를 걸렀으며, 추출된 현탁액은 2,500 rpm에서 5분동안 원심 분리하였다. 원심 분리된 상징액을 제거한 후, 침전된 휴면포자를 세척하고자 30 ml 멸균수를 첨가하고 다시 원심 분리를 반복하였다. 접종원으로 사용된 휴면포자 현탁액의 농도는 8.2×108 spores/ml이었다. 병원성 검정을 위한 콜라비(품종 아삭콜)는 72구 모종트레이에 종자를 파종하여 포트에서 10일간 생육된 15개체를 사용하였다. 접종 방법은 포트에서 생육 중인 10개체의 뿌리 부분에 5–10 cm 정도 구멍을 내고 접종원 20 ml를 부었으며, 대조구는 5개체에 멸균수를 동일한 방법으로 부었다. 접종한 모든 식물체를 18–25°C로 유지되는 유리온실에서 관리하였으며, 식물체가 마르지 않도록 정기적으로 관수를 하였다. 휴면포자가 접종된 콜라비는 50일 이후부터 시들기 시작하였으며, 뿌리부분에는 포장에서 관찰된 모습과 동일한 혹이 형성되었고, 다량의 휴면포자가 관찰되었다. 그러나 대조구는 시들지 않았으며, 뿌리혹이 형성되지 않았다. 따라서 콜라비에 뿌리혹을 일으키는 병원균은 병원성이 있는 것으로 판단되었다.
병원균의 균학적 특징 및 rDNA의 ITS 염기서열 분석.
병원균의 형태적 특징은 뿌리혹이 형성된 콜라비 뿌리를 직접 절단하여 주사전자현미경(JSM-5410LV, JEOL, Tokyo, Japan)과 광학현미경으로 관찰하였다. Differential interference contrast (DIC) 모듈이 장착된 광학현미경(AXIO, Zeiss, Oberkochen, Germany)의 관찰을 위해 –20°C로 설정된 cryomicrotome (Leica cryostat CM3050S, Leica Microsystems, Wetzlar, Germany)을 이용하여 20 μm 두께로 절편을 제작한 후, 슬라이드 글라스에 올려놓고 400에서 1,000배로 관찰하였다. 휴면포자의 형태와 크기(n=50) 등은 AxioVision LE Module Interactive Measurement (Zeiss) 프로그램을 이용하여 측정하였다.
주사전자현미경으로 관찰된 병원균은 뿌리 세포조직 내에 마치 마대 자루에 콩을 담아 놓은 것처럼 구형의 성숙되거나 미성숙된 휴면포자를 무수히 형성하였다(Fig. 2A–D). 미성숙된 휴면포자들 사이는 실타래로 서로 엉켜있는 것처럼 보였다. 광학현미경에서도 휴면포자가 세포조직 안에 빈 곳이 없을 정도로 무수히 관찰되었다. 휴면포자는 단세포로 무색, 원형 또는 타원형, 크기는 직경 3–5 μm이었다(Fig. 2E, F).

Scanning electron and light micrographs of immature and mature resting spores in clubroot of kohlrabi. (A–E) Resting spores inside cell tissues in clubroot galls. (F) Resting spores released from cell tissues.
또한 형태적 특징을 기초로 한 병원균의 동정을 보완하기 위하여 염기서열 분석을 하였다. 뿌리혹이 형성된 콜라비 뿌리 1 g을 액체질소를 넣고 마쇄한 후, DNeasy Plant Mini kit(QIAGEN, Valencia, CA, USA)를 이용하여 genomic DNA를 추출하였다. Ribosomal DNA (rDNA)의 internal transcribed spacer (ITS) 영역을 분석하기 위해 ITS1/ITS4 primer를 사용하여 PCR로 증폭했으며(White 등, 1990), 증폭된 산물은 정제를 위해 1.5% agarose gel에서 분리한 후 PCR purification kit (Core-one, Core-bio, Korea)를 사용하였다. ABI 3130 auto sequencer를 이용하여 ITS1과 ITS4의 염기서열을 분석하였으며, ITS rDNA 염기서열은 GenBank database (National Centre for Biotechnology Information [NCBI], US National Institute of Health Bethesda, http://blast.ncbi.nlm.nih.gov/Blast.cgi)에서 확인하였다. 계통학적 분석은 MEGA 6.06 program을 이용하여 neighbor-joining 방법으로 작성하였으며, 염기서열의 유전자 거리는 Tamura-Nei parameter model로 계산하였고, bootstrap analysis은 1,000반복으로 수행하였다(Tamura 등, 2013).
콜라비에 뿌리혹병을 일으키는 P. brassicae의 ITS 영역의 길이는 547 bp로 NCBI의 GenBank 등록번호는 MH762161이다. NCBI에서 Blastn search한 결과 캐나다의 카놀라(Canola)와 스위스의 백겨자(Sinapis alba)에서 P. brassicae로 등록된 GenBank accession number KY628944, KY628950, KY628953, EF195335와 100% 상동성을 보였다. 또한 우리나라의 지역별(강릉, 연천, 대전, 해남, 서산, 평창, 횡성)로 수집되어 P. brassicae로 등록된 GenBank accession number KX430457–KX430462, KX430464–KX430465와 99% 상동성을 보였다. 또한 계통수 작성 결과 콜라비 뿌리혹병의 ITS 염기서열(MH7621691)은 캐나다와 스위스, 그리고 우리나라 각 지역에서 수집된 P. brassicae와 같은 계통으로 분류되었다(Fig. 3).
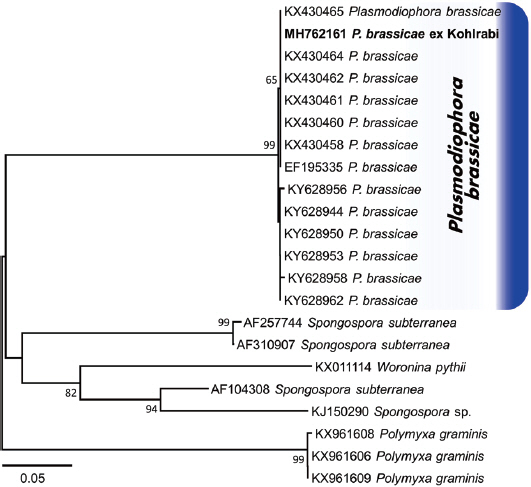
Phylogenetic tree obtained through the neighbor-joining method using the MEGA 6.06 program based on the internal transcribed spacer ribosomal DNA (rDNA) sequence of our isolate of Plasmodiophora brassicae, and that of other fungi retrieved from GenBank. The numbers above the nodes are the bootstrap values obtained from 1,000 replicates. The isolates obtained in this study are shown in boldface.
이상과 같이 콜라비 뿌리혹병을 일으키는 병원균의 형태적 특징과 염기서열 분석, 병원성 검정을 기초로 Plasmodiophora brassicae으로 동정하였다(Buczacki, 1979; Kim 등, 2009). 전 세계적으로 콜라비에 기록된 주요 병원균으로는 Plasmodiophora brassicae (clubroot, 뿌리혹병), Peronospora brassicae (downy mildew, 노균병), Rhizoctonia solani (damping-off, 모잘록병), Alternaria brassicae (black spot, gray spot, 검은무늬병), Fusarium oxysporum (wilt, 시들음병) 등이다(Farr와 Rossman, 2019). 특히, P. brassicae에 의한 병해는 남아프리카공화국, 뉴질랜드, 미국, 베네수엘라, 브라질, 중국, 칠레, 캐나다, 호주 등에 보고되어 있다(Farr와 Rossma, 2019). 우리나라에는 Fusarium oxysporum에 의한 시들음병만 보고되어 있어 기주 미기록 종이다(Choi 등, 2015; The Korean Society of Plant Pathology, 2009). 따라서 발병 및 병징, 병원성 검정, 균학적 특징 및 염기서열 분석 등의 결과를 바탕으로 이 병은 우리나라에서 지금까지 보고되지 않은 ‘Plasmodiophora brassicae에 의한 콜라비 뿌리혹병’으로 명명하고자 한다.
요 약
2016년부터 2018년까지 제주도내 농가포장에서 재배되고 있는 콜라비에 뿌리혹병 지속적으로 발생(최고발병률 27.2%)했다. 초기 감염은 뿌리털 부분이 정상주 뿌리털에 비해 비대했으며, 병이 진전되면서 뿌리 중심부에 혹이 형성되고, 잎이 시들고 끝이 누렇게 변했다. P. brassicae 휴면포자 현탁액을 이용한 병원성 검정결과 접종 50일 후에 병원성을 나타냈다. 병원균은 콜라비 세포조직 안에 빈 곳 없이 무수히 많은 휴면포자를 형성하며, 휴면포자는 단세포로 무색, 원형 또는 타원형, 크기는 직경 3–5 μm이다. 콜라비 뿌리혹병원균의 ITS rDNA 염기서열 분석, 계통수 작성 결과 P. brassicae로 동정했다. 따라서 균학적 특징, 병원성 검정, ITS rDNA 염기서열 비교분석 등의 결과를 바탕으로 이 병은 우리나라에서 지금까지 보고되지 않은 ‘Plasmodiophora brassicae에 의한 콜라비 뿌리혹병’으로 명명하고자 한다.
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This study was carried out with the support of “Cooperative Research Program for Agricultural Science & Technology Development (Project No. PJ012826102018)” Rural Development Administration, Republic of Korea.
