Bancroft, J. B, Rouleau, M, Johnston, R, Prins, L and Mackie, G. A 1991. The entire nucleotide sequence of foxtail mosaic virus RNA.
J. Gen. Virol 72: 2173-2181.


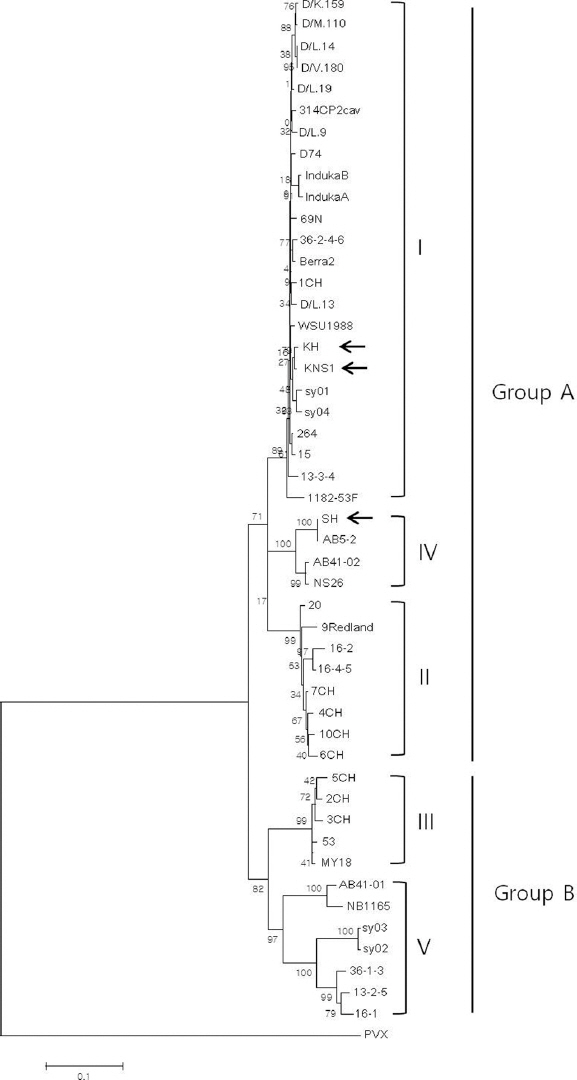
Bhagwat, B, Dickison, V, Su, L, Bernardy, M, Wiersma, P. A, Nie, X et al. 2015. Molecular characterization of divergent strawberry mild yellow edge virus isolates from Eastern Canada.
J. Phytopathol 164: 691-696.

Cho, J. D, Choi, G. S, Chung, B. N, Kim, J. S and Choi, H. S 2011. Strawberry mild yellow edge potexvirus from strawberry in Korea.
Plant Pathol. J 27: 187-190.

Choi, G. S, Lee, J. A, Cho, J. D, Chung, B. N, Cho, I. S and Kim, J. S 2009. Strawberry virus diseases occurring in Korea, 2007-2008.
Res. Plant Dis 15: 8-12.

Garcia-Arenal, F, Fraile, A and Malpica, J. M 2001. Variability and genetic structure of plant virus populations.
Annu. Rev. Phytopathol 39: 157-186.


Horne, W. T 1922. Strawberry troubles. Calif. Agric. Exp. Stn. Rep 1921-22: 122-123.
Jelkmann, W, Martin, R. R, Lesemann, D. E, Vetten, H. J and Skelton, F 1990. A new potexvirus associated with strawberry mild yellow edge disease.
J. Gen. Virol 71: 1251-1258.


King, A. M. Q, Adams, M. J, Carstens, E. B and Lefkowitz, E. J 2012. Virus taxonomy:ninth report of the international committee on taxonomy of viruses. 9th ed Elsevier, Cambridge, MA, USA. pp. 1327 pp.
Lamprecht, S and Jelkmann, W 1997. Infectious cDNA clone used to identify strawberry mild yellow edge-associated potexvirus as causal agent of the disease.
J. Gen. Virol 78: 2347-2353.


Librado, P and Rozas, J 2009. DnaSP v5:a software for comprehensive analysis of DNA polymorphism data.
Bioinformatics 25: 1451-1452.


Ma, X, Cui, H, Bernardy, M, Tian, L, Abbasi, P and Wang, A 2015. Molecular characterization of a strawberry mild yellow edge virus isolates from Canada.
Can. J. Plant Pathol 37: 369-375.

Martin, R. R and Tzanetakis, I. E 2006. Characterization and recent advances in detection of strawberry viruses.
Plant Dis 90: 384-396.


Plakidas, A. G 1927. Strawberry xanthosis (yellows) a new insectborne disease. J. Agric. Res 35: 1057-1090.
Robinson, M. D and Murray, T. D 2013. Genetic variation of wheat streak mosaic virus in the United States Pacific Northwest.
Phytopathology 103: 98-104.


Rogers, S. M, Payton, M, Allen, R. W, Melcher, U, Carver, J and Fletcher, J 2012. Method:a single nucleotide polymorphism genetyping method for wheat streak mosaic virus.
Investig. Genet 3: 10



Thompson, J. R and Jelkmann, W 2004. Strain diversity and conserved genome elements in Strawberry mild yellow edge virus.
Arch. Virol 149: 1897-1909.


Torrico, A. K, Celli, M. G, Cafrune, E. E, Kirschbaum, D. S and Conci, V. C 2016. Genetic variability and recombination analysis of the coat protein gene of strawberry mild yellow edge virus.
Aust. Plant Pathol 45: 401-409.

Tzanetakis, I. E and Martin, R. R 2013. Expanding field of strawberry viruses which are important in North America.
Int. J. Fruit Sci 13: 184-195.





 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






