참다래 신품종 ‘골드원’, ‘레드비타’, ‘감록’의 주요 병해충 발생
Occurrences of Major Diseases and Pests on ‘Goldone’, ‘Redvita’, ‘Garmrok’, New Cultivars of Kiwifruit
Article information
Abstract
Kiwifruit has been cultivated in southern coastal regions of Korea since late 1970s. New cultivars have been successively released in recent years. In this study, we investigated major disease and pest incidences in new kiwifruit cultivars ‘Goldone’, ‘Redvita’ and ‘Garmrok’ at open field in Sacheon for 3 years and rain-proof field in Jeju for 2 years. For the bacterial canker, the 3 new cultivars showed more disease occurrence in Sacheon but rare in Jeju. For leaf spot disease, compared to disease incidence of 20% on ‘Hayward’ in Sacheon, cv. ‘Garmrok’ had high incidence about 60% but cv. ‘Goldone’ and cv. ‘Redvita’ had low incidence less than 20%. However, in Jeju, diseases incidences of all the new cultivars were lesser than 20%. In the case of Hemiptera, many Halyomorpha halys and Nezara antennata appeared in Sacheon but in Jeju Plautia stali was dominated. Isolated bacterial canker pathogen was identified as Pseudomonas syringae pv. actinidiae biovar 3. Leaf spots pathogens were Phomopsis sp., Phoma sp., Fusarium tricinctum and Alternaria alternata. This study shows the disease information on new kiwifruit cultivars and the adequate disease managements will be required.
서론
참다래(Kiwifruit, Actinidia spp.)는 중국 원산의 야생 유전자원이 뉴질랜드로 도입되어 재배되기 시작하였고, 국내에서는 1970년대부터 재배되기 시작한 역사가 비교적 짧은 과수이다. 참다래는 주로 온대 해양성 기후에서 생산되고 있으며 최근까지 소비량이 꾸준히 증가하여 국내 재배 면적은 약 1,300 ha, 생산량은 약 25,000톤에 달했으며, 전라남도(45%), 경상남도(31%), 제주도(24%) 순으로 넓은 재배면적을 가지고 있다(Kim 등, 2017). 과실이 후숙되면 녹색, 노란색, 붉은색 등의 과육을 가지게 되는데 녹색 계통의 과육은 A. deliciosa (A. Chev) Liang, 황색 계통의 과육은 A. chinensis (Planch) var. chinensis로 구분된다(Montefiori 등, 2005). 전 세계적으로 가장 많이 재배되는 품종으로 A. deliciosa는 ‘Hayward’, A. chinensis는 ‘Hort16A’ 품종이 일반적으로 상용화되어 왔고, 뉴질랜드, 중국 등 참다래 주요 생산 국가에서는 품질 개발을 위한 신품종 육성 또한 꾸준히 연구되어 왔다(Ferguson, 1999; Wang 등, 2002). 또한, 국내에서 1995년부터 참다래 산업의 경쟁력을 높이기 위한 신품종 육성 연구가 활발히 진행되고 있다. 국립원예특작과학원은 소비자의 기호를 충족시키고 건강 기능 성분을 강화한 약 140점의 참다래 유전자원을 확보하였다. 최근 개발 보급 계획인, ‘감록’ 품종은 과실의 당도가 14°Brix 이상이고, ‘골드원’ 품종은 과실의 무게를 40% 이상까지 증가시켰으며, ‘레드비타’ 품종은 비타민 C의 함량을 2-4배 이상 증가시켰다(Kwack 등, 2017a, 2017b). 이에 대한 과실의 형질 특성 평가가 이루어지고 있다(Kang 등, 2017). 하지만 신육성 품종은 과실 특성뿐만 아니라, 재배 중 발생하는 병해충에 대한 기초 자료가 축적되어야 한다.
Hawthorne 등(1982)에 따르면 참다래는 뉴질랜드에서 재배된 초기에는 병해가 없는 작물로 인식되었으나, 수출 산업이 확장됨에 따라 저온 저장량이 증가하면서 저장병이 심각한 문제로 대두되었다. 이후, Diaporthe actinidiae에 의한 줄기마름병, Colletotrichum fructigenum과 Phoma spp.에 의한 점무늬병 등이 진균병으로 발표되었고 Pseudomonas syringae pv. actinidiae에 의한 궤양병, Pseudomonas syringae pv. syringae에 의한 꽃썩음병 등이 세균병으로써 발표되었다. 국내에 보고된 병해로는 꽃썩음병(P. syringae pv. syringae), 궤양병(P. syringae pv. actinidiae), 잿빛곰팡이병(Botrytis cinerea), 저장병(Botryosphaeria dothidea 등), 잎마름병(Pestalotiopsis menezesiana 등) 등 11가지가 있다(The Korean Society of Plant Pathology, 2009). 점무늬병의 경우, 기온이 올라가는 6월부터 병이 발생하여 8월에 급증하며 수확기까지 지속된다. 잎에 발생하는 병반 유형에 따라 갈색잎마름(Brown leaf blight), 회갈색둥근무늬(Grayish brown ring spot), 은회색잎마름(Silvering gray leaf blight), 암갈색둥근무늬(Dark brown ring spot)이 일반적인 병징이며, Phomopsis sp., Glomerella cingulata, Alternaria alternata, Pestalotiopsis sp. 등의 병원균이 보고되어 있다 (Jeong 등, 2008). 또한, 궤양병은 1984년 일본에서 최초 보고된 이래로 최근 참다래 산업에서 가장 치명적인 병으로 알려져 있다(Butler 등, 2013). 궤양병은 참다래 조직 내부를 침투하여 잎에서는 노란색 달무리(halo)의 갈색 점을 형성하고, 가지, 주간 또는 잎, 꽃봉오리에서 세균 유출액을 형성하며 줄기에 전형적인 궤양 증상을 보인다. 궤양병의 biovar는 5가지로 분류되며 biovar 1은 phaeseolotoxin, biovar 2는 coronatine 독소를 분비하고, biovar 3와 biovar 5는 독소는 분비하지 않으며, biovar 6는 phaeseolotoxin과 coranatine을 모두 분비하는 것으로 알려져 있다(Sawada 등, 2016). Biovar 3가 경제적으로 가장 큰 손실을 일으키며, biovar 1과 biovar 3는 가장 널리 분포하는 반면, biovar 2는 대한민국, biovar 5와 biovar 6는 일본에서만 지역적으로 발생한 것으로 보고되었다. 또한 기존에는 biovar 4도 비교적 낮은 병원성을 가진 것으로 분류되었으나, 최근에는 P. syringae pv. actinidifoliorum (Psaf)로 새로 분류되었다(Fujikawa와 Sawada, 2016). 기존에 보고된 Psa의 생장 적온은 10-20°C로써, 늦겨울에서 이른 봄 또는 가을에서 초겨울에 발병하는 것으로 알려져 있었다. 하지만 최근 발표된 Psa의 생태 연구 결과에서는 25°C 이상의 고온에서도 생존이 가능하며 뿌리에서도 월동이 가능한 것으로 알려져 Psa에 의한 손실이 증가할 것으로 전망되고 있다(Renzi 등, 2012).
또한, 참다래를 가해하는 해충으로는 열매꼭지나방, 뽕나무깍지벌레, 노린재류(갈색날개노린재, 썩덩나무노린재, 풀색노린재 등) 등이 있다. 열매꼭지나방은 연 2회 발생하며 최성기는 6월 상중순과 8월 하순에 이른다(Park 등, 1994). 뽕나무깍지벌레는 참다래에서 발견되는 가장 흔한 해충으로 연 2회 발생하고 줄기나 잎을 흡즙하여 나무의 수세를 약하게 만든다(Blank 등, 1996). 노린재류의 경우, 방제가 매우 어려운 해충으로 알려져 있다. 갈색날개노린재(Plautia stali)와 썩덩나무노린재(Halyomorpha halys)는 연 1회, 풀색노린재(Nezara antennata)는 연 2회 발생하며 주로 성충이 과실을 흡즙하여 낙과 피해를 일으킨다(Lee 등, 2009). 국내 참다래 농가에 발생한 해충으로는 열매꼭지나방, 뽕나무깍지벌레, 노린재류 등이 있으며, 열매꼭지나방과 뽕나무깍지벌레에 대한 발생 조사나 방제 기술에 대한 정보는 일반화되어 있는 반면에 노린재류에 대한 자료는 부족한 실정이다.
본 연구에서는 국립원예특작과학원의 신육성 품종 가운데 A. deliciosa의 ‘감록’과 A. chinensis의 ‘골드원’과 ‘레드비타’ 품종을 대상으로 병해로는 궤양병과 점무늬병, 해충으로는 노린재류에 대한 조사를 사천은 3년간, 제주는 2년간 실시하여 기존 재배 품종 ‘헤이워드’와 비교한 신육성 품종의 병해충 발생 자료를 마련하고자 수행되었다.
재료 및 방법
재배지 기상 자료
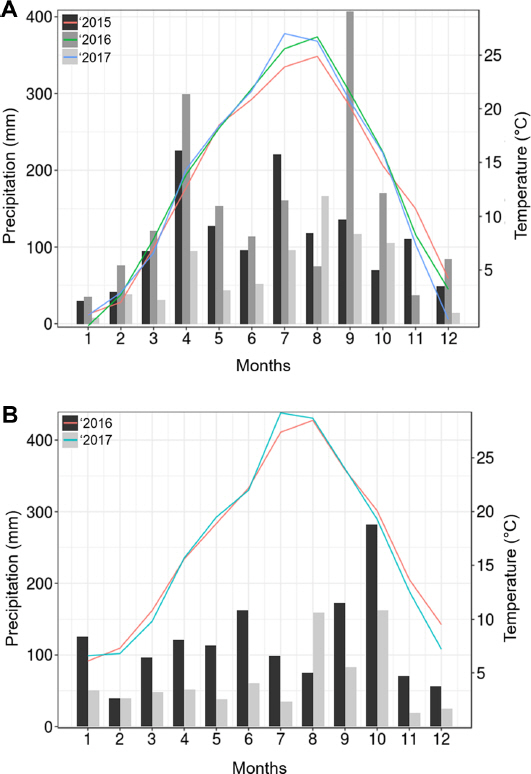
2015년부터 2017년까지 조사한 경남 사천시(34°57’00.4”N, 128°03’24.1”E)와 제주시(33°27’01.5”N, 126°26’24.0”E)에 위치한 참다래 농가의 기상 자료는 기상청(www.kma.go.kr)에서 발표된 자료에 의거하여 마련하였다. 사천과 제주 참다래 포장의 매월 평균 온도와 강수량을 조사하였고, 3년차 데이터, 제주는 2년차 데이터를 하나의 그래프로 나타내 비교하였다.
병해충 발생조사
참다래 신육성 품종 ‘골드원’, ‘레드비타’, ‘감록’에 대해 사천은 2015년부터 2017년까지 3년, 제주는 2016, 2017년 2년동안 병해충 발생 양상을 조사하였다. 경남 사천시(가로 90 m × 세로 110 m, 경상남도 사천시 실안면 247)에 위치한 노지 재배 포장 1곳과 제주시(가로 65 m × 세로 85.5 m, 제주특별자치도 제주시 애월읍 광령리 945)에 위치한 비가림 재배 포장 1곳을 대상으로 하였고, 병해 조사는 사천 지역의 경우 월 1회, 제주 지역은 연 3-4회로 하였으며, 해충 조사는 두 지역 모두 월 1회로 진행하였다. 병해 조사는 각 품종 당 5그루를 대상으로 궤양병, 점무늬병을 조사하였고, 해충 조사는 2016년에는 각 포장의 내 · 외부에, 2017년에는 포장의 외부에만 노린재 페로몬 트랩(GreenAgroTech, Gyeongsan, Korea)을 설치하여 한 달 간격으로 페로몬을 교체해주며 채집된 노린재류의 발생을 조사하였다. 궤양병은 가장 두드러지는 병징으로 잎의 노란색 달무리의 갈색점과 가지의 우윳빛 또는 붉은색의 세균 유출액 증상을 기준으로 조사하였고, 점무늬병은 잎의 전체 개수 당 갈색, 회갈색, 은회색, 암갈색 등의 병반이 보이는 잎의 개수로 조사하였다. 발병된 식물체 시료는 채집하여 실험실 내에서 병원균을 분리하고 동정하였다. 또한, 노린재류의 발생 조사는 설치된 페로몬 트랩의 노린재를 모두 수거하여 실험실 내에서 동정하였다.
병원균 분리 및 동정
채집된 시료는 건전부와 병반 부위를 5 × 5 mm 크기로 잘라 70% 에탄올에 1분, 1% 차아염소산나트륨(NaOCl)에 30초간 표면소독을 하였고 멸균수에 3번 세척하였다. 거름종이를 이용해 수분을 제거시킨 후 표면 소독된 병반은 물한천배지(WA)에 치상하여 27°C 항온기에서 3일간 배양하였다. 궤양병 병반에서 분리된 세균은 대두카제인소화한천배지(TSA, BD DifcoTM, Franklin Lakes, NJ, USA)에 스트리킹(streaking)하였고, 점무늬병 병반에서 분리된 진균은 균사의 선단부위를 잘라 감자한천배지(PDA, BD DifcoTM)에 계대 배양하여 27°C 항온기에서 세균은 3일간, 진균은 7일간 배양하였다.
자라난 병원균은 형태학적 동정과 분자생물학적 동정을 진행하였다. 궤양병균은 Balestra 등(2013)의 Psa 검출 프라이머와 Koh 등(2014)의 Psa biovar 3 검출 프라이머를 사용하여 Psa의 여부와 biovar를 확인하였다. 또한, 16s rRNA 영역 동정을 위해 27F (5’-GAGTTTGATCMTGGCTCAG-3’)과 1492R (5’-TACGGTTACCTTGTTACGACTT-3’) 프라이머를 사용하였고, 반응 조건은 94°C에서 5분간 initial denaturation하였고, 94°C에서 30초간 denaturation, 55°C에서 30초간 annealing, 72°C에서 1분간 extension 과정을 35회 반복하였고, 마지막 신장 반응은 72°C에서 10분간 실시하였다(Dymock 등, 1996). 점무늬병균은 1차적으로 광학현미경(HBO 50, ZEISS Microscopy, NW, USA)으로 포자 모양을 관찰하여 형태학적 동정을 하였다. 또한, Zhang 등(2010)의 변형된 CTAB (cetyl trimethylammonium bromide) DNA 추출법으로 DNA를 추출하였고, Chen 등(2011)의 ITS1 (5’-TCCGTAGGTGAACCTGCGG-3’)과 ITS4 (5-TCCTCCGCTTATTGATATGC-3) 프라이머를 이용하였다. 반응 조건은 95°C에서 5분간 initial denaturation하였고, 95°C에서 30초간 denaturation, 50°C에서 30초간 annealing, 72°C에서 30초간 extension 과정을 35회 반복하였고, 마지막 신장 반응은 72°C에서 10분간 실시하였다. PCR 산물은 ExpinTM Gel SV kit (Gene-all, Seoul, Korea)를 사용하여 DNA를 정제(purification)하였고 ABI 3730XL DNA Analyzer (SolGent, Daejeon, Korea)를 이용해 염기서열이 분석되었다. 분석된 염기서열은 NCBI (https://www.ncbi.nlm.nih.gov/)의 BLAST 프로그램을 이용하여 병원균의 동정에 사용하였다.
해충 동정
조사 대상 노린재류의 두드러지는 형태적 특징으로 갈색날개노린재는 머리와 가슴이 진한 녹색을 띄고 등판 양 옆으로 갈색의 날개가 있고, 썩덩나무노린재는 전체적으로 흑갈색이며 날개 가장자리에 두 쌍의 흑색 띠를 가지고 있으며, 풀색노린재는 전체적으로 광택이 없는 짙은 녹색을 띈다(Basnet 등, 2014). 따라서 형태적 특징에 따라 갈색날개노린재, 썩덩나무노린재, 풀색노린재로 분류하여 채집된 개체수를 조사하였다.
결과
참다래 재배지 기상 환경
사천과 제주 포장의 온도와 강수량에 대한 자료는 Fig. 1과 같다. 사천 포장의 2015년도 평균 기온은 약 25°C 이하로 8월에 가장 높은 기온을 보였고, 2016년과 2017년에는 25°C 이상까지 기온이 올라갔으며, 2016년에는 8월, 2017년에는 7월에 가장 높은 기온을 보였다. 점무늬병의 발생시기인 5-10월 사이의 강수량은 2016년에 최고 강수량이 약 400 mm까지 달하면서 가장 높았고, 2015년에 약 200 mm, 2017년에는 약 150 mm 안팎으로 최고 강수량을 보였다. 제주 포장은 사천에 비해 높은 평균 기온을 보였으며, 2016년은 8월, 2017년에는 7월에 가장 높은 기온을 보였다. 또한 점무늬병 발생 시기의 강수량은 사천에 비해 확연히 낮은 빈도를 보였다.
주요 병해 발생 현황
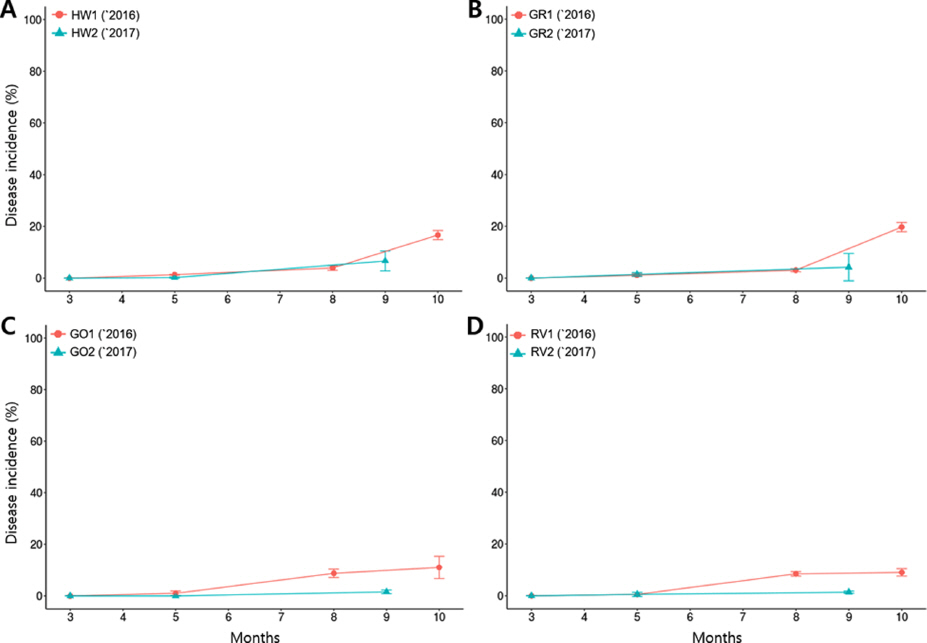
2015년과 2016년의 사천 노지 재배 포장의 궤양병 발생빈도는 대조구인 ‘헤이워드’ 품종에서는 발생하지 않은 반면에, 신품종 참다래에서는 모두 발생하였다(Table 1). 2017년에는 ‘헤이워드’ 품종에서 5주 모두 궤양병징이 확인되었다.신품종 참다래의 궤양병징은 주로 2-3월경 가지에서 우윳빛 또는 붉은색의 세균 유출액에 관찰되었다(Fig. 2A-D). 하지만 ‘헤이워드’ 품종의 궤양병징은 온도가 높아진 6월경 잎에서 노란색 달무리의 갈색 점무늬 증상만이 관찰되었다(Fig. 2C, 2D). 반면, 제주 비가림 재배 포장에서는 대체로 궤양병이 발생하지 않았으며, 2017년도에 ’레드비타’ 품종에서 1그루에서만 감염된 잎이 되었다.

Diseased symptoms of bacterial canker (A-D) and leaf spot diseases by Phomopsis sp. (E-H), Alternaria alternata (I-L) on kiwifruits. (A) ‘Hayward’, (B, E, I) ‘Garmrok’, (C, F, J) ‘Goldone’, (D, G, K) ‘Redvita’. Bar indicates 10 μm.
점무늬병(Fig. 2E-G, I-K)의 경우, 연차별로 병 발생빈도를 비교했을 때, 사천 포장에서는 2015년에 비해 2016년에 4품종 모두 병 발생이 증가하였고 ‘헤이워드’와 ’골드원’ 품종은 2017년도에 병 발생빈도가 감소한 반면에 ’감록’과 ’레드비타’ 품종은 증가하였다. 하지만 대조구인 ‘헤이워드’ 품종이 전체적으로 20% 내외의 병 발생 빈도를 보인 것과 비교했을 때, ’감록’ 품종은 약 60%까지 증가한 것으로 점무늬병에 매우 감수성이었고, ’골드원’과 ’레드비타’ 품종은 20% 미만으로 비교적 병 발생빈도가 낮았다(Fig. 3). 제주 포장에서는 사천 포장에 비해 점무늬병 발생 빈도가 네 품종 모두 20% 미만으로 현저히 낮게 나타났다. 마찬가지로 2016년에 비해 2017년에 병 발생빈도가 떨어졌으며, ‘헤이워드’ 품종과 비교했을 때는 신품종 모두 낮은 발생빈도를 보였다 (Fig. 4). 또한 기상 자료와 비교했을 때, 사천 포장과 제주 포장은 각 연도의 최고 기온을 보였을 때 병 발생이 다소 감소하였고, 강수량이 높은 해에 사천과 제주 모두 병 발생이 증가한 것으로 조사되었다.
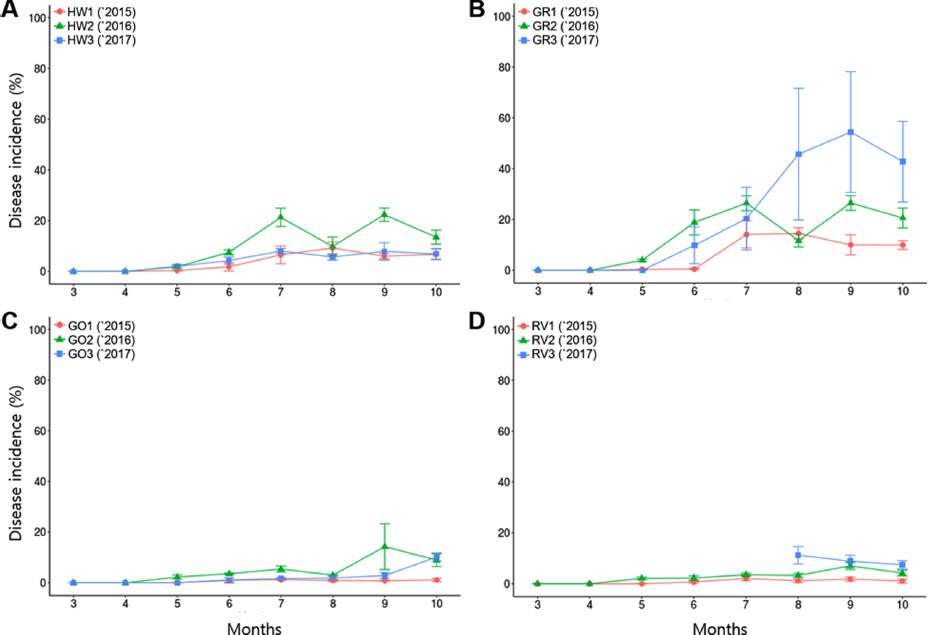
Disease incidences of leaf spot diseases for 3 years in open field of Sacheon. (A) ‘Hayward (HW)’, (B) ‘Garmrok (GR)’, (C) ‘Goldone (GO)’, (D) ‘Redvita (RV)’.
병원균 분리 및 동정
궤양병균 Psa 검출 프라이머를 이용해 동정한 결과, 모두 Pseudomonas syringae pv. actindiae biovar 3로 동정되었다. 점무늬병균은 포자를 관찰한 형태학적 동정과 염기서열을 이용해 분자생물학적 동정을 진행한 결과, 대부분 Phomopsis sp.와 Alternaria alternata였으며, 이 외에 Phoma sp., Fusarium tricinctum, Pestalotiopsis sp., Colletotrichum gloeosporioides 등도 분리되었다. 점무늬병으로부터 분리된 병원균 포자의 형태와 크기는 Fig. 2H, 2L과 같고 분자생물학적 동정의 결과는 Table 2와 같다. F. tricinctum은 참다래 점무늬병에 대하여 최초 발생하였고(Kim 등, 2017), Phoma sp.는 국내에서 재배되는 참다래로부터 분리되어 보고 되었다(Kwon 등, 2016). 또한, 분리된 각각의 병원균 염기서열은 NCBI에 등록되었다.
주요 해충 발생 조사
포장 외부에 설치한 페로몬 트랩으로 부터 갈색날개노린재, 썩덩나무노린재, 풀색노린재를 수거할 수 있었다(Fig. 5A, 5B, 5C). 과실을 흡즙하여 가해하는 성충의 우화시기는 갈색날개노린재와 썩덩나무노린재는 6-7월경, 풀색노린재는 9월경으로 기온이 25°C 이상으로 증가하는 때로 알려져 있으며, 지리적 특성상 제주의 기온이 사천보다 따뜻하기 때문에 제주 포장은 일반적인 성충 우화 시기에 개체수가 증가하였으나, 사천 포장은 보다 늦은 8월경부터 개체수가 증가하는 양상을 보였다(Fig. 6). 또한, 포장 내부에 트랩을 설치했을 때 노린재가 트랩에 바로 포획되지 않고 주변의 과실을 흡즙하여 낙과하는 직접적인 피해가 심하게 나타났다. 따라서 사천 포장의 경우 전체 과실의 20%, 제주 포장의 경우 80%가 낙과하는 피해를 입었고 노린재가 흡즙한 과실 내부에는 흰색의 스폰지 형태의 병징이 생겼다(Fig. 5D, 5E). 따라서 2017년에는 포장의 외부에만 트랩을 설치하여 포장 내부의 노린재 발생이 확연히 감소하였고 과실 피해 또한 감소하였다. 또한, 지역 간의 노린재 발생 양상은 사천에서는 썩덩나무노린재와 풀색노린재가 우점하여 발생하였으며, 제주에서는 갈색날개노린재가 가장 높은 밀도로 발생하였다. 이러한 결과는 지역간 또는 재배형태의 차이에서 비롯된 것으로 사료된다.

Damage of Hemiptera in orchards. (A) Plautia stali, (B) Halyomorpha halys, (C) Nezara antennata, (D) Fruit drop in Jeju orchard, (E) Damage by Hemiptera. Bar indicates 1 cm.
고찰
주요 병해의 지역별 차이
본 연구에서 조사한 주요 병해로 궤양병과 점무늬병은 모두 습한 환경에서 발생이 용이하며, 병원균은 주로 상처를 통해 전염이 더 쉬운 것으로 알려져 있다. 또한, 궤양병은 전염성이 매우 강하여 참다래 농가에 매우 심각한 병원균으로 인식되고 있으나, 점무늬병은 6월부터 생육 후기에는 거의 예외없이 발생하는 일반적인 병으로 노지 재배의 최대 발병율은 70%, 비가림 재배는 20%로 알려져 있다(Kim과 Koh, 2018). 본 연구의 궤양병 조사에서는 신품종 모두 노지 재배에서 대조구 ‘헤이워드’보다 강수량이 높은 2016년에 노지 재배지(사천)에서 병 발생빈도가 더 높았으나, 비가림 재배지(제주)에서는 궤양병 발생 자체가 없었다. 점무늬병 조사에서는 대조구 ‘헤이워드’를 비롯한 신품종 참다래 모두 사천 노지 재배 포장에서 최대 60%, 제주 비가림 재배 포장에서 최대 20%로 기준에 보고된 수치보다는 낮은 발생빈도를 보였다. 하지만 대조구 ‘헤이워드’가 사천과 제주에서 모두 20% 정도의 발생빈도를 보인 것과 비교했을 때, ‘골드원’과 ‘레드비타는’ 20% 미만으로 재배 환경과 상관없이 점무늬병 발생이 적었으나, ‘감록’은 노지 재배에서 60%까지 증가하며 다른 품종에 비해 점무늬병에 감수성인 것으로 사료된다. 하지만 ‘감록’의 점무늬병 발생은 비가림 재배시 20% 내외로 병 발생을 낮출 수 있을 것으로 기대된다. 궤양병과 점무늬병에 대한 병 발생빈도는 사천 노지 재배 포장에서 제주 비가림 재배 포장보다 더 높은 것으로 나타났다. 지역별 기상 자료를 토대로 병 발생빈도를 비교시 사천의 기온이 0-27°C 내외, 강수량이 400 mm에 달하며 병원균의 생장 환경이 제주보다 더 최적화 되었다. 또한, 비가림 재배와 노지 재배 환경조건에서, 노지 재배지가 기상재해와 같은 환경적 요인에 의해 참다래 나무에 상처가 생기기 더 쉬우므로 외부 환경으로부터 보호되는 비가림 재배지 보다 병원균이 전염되고 생장하기에 더 좋은 환경을 만들었을 것으로 사료된다. 이를 토대로 참다래의 재배 환경은 노지 재배보다 비가림 재배가 병 발생을 억제할 수 있을 것으로 생각된다.
주요 병해의 연차별 차이
사천 노지 재배 포장의 경우, 궤양병과 점무늬병에 대해 4 품종 모두 2년차(2016년)에 병 발생빈도가 가장 높게 나타났다. 이는 노지 재배인 것을 감안했을 때, 강수량이 병 발생과 밀접한 영향이 있는 것으로 판단된다. 평균 기온이 25°C 이하, 월간 최고 강수량은 200 mm 이상으로 나타난 2015년도에는 궤양병은 세균 유출액이 나타났으나, 점무늬병은 3년차 중 가장 낮은 발생빈도를 보였다. 반면, 평균 기온이 27°C까지 증가하였고 강수량은 가장 낮았던 2017년에는 궤양병은 잎 병반만 발생한 반면, 점무늬병 발생빈도는 다시 증가하였다. 이는 강수량과 궤양병, 평균 기온과 점무늬병 사이의 밀접한 연관성이 있는 것으로 보인다. 제주 비가림 재배 포장의 경우에는 궤양병과 점무늬병 모두 2년간의 병 발생빈도가 낮았기 때문에 기상 조건과의 연관성은 떨어졌지만, 비가림 재배인 것을 고려할 때 온도나 강수량의 영향을 상대적으로 덜 받기 때문에 병 발생 또한 적은 것으로 사료된다. 따라서 기온이나 강수량에 따른 병 발생은 점무늬병이 20-27°C 내외의 온도가 높을수록, 궤양병은 비교적 저온에서 강수량이 더 많을수록 발병율에 더 많은 영향을 받는다는 것을 확인 하였다. 하지만 이는 노지 재배에서는 적용이 되나, 비가림 재배의 경우 강수량의 영향을 거의 받지 않기 때문에 상관 관계가 낮게 나타난다.
주요 해충의 발생 양상
노린재류의 적정 우화시기는 25°C로 온도 영향을 많이 받는 것으로 알려져 있다(Park 등, 2013). 따라서 사천과 제주의 연차별 기상 자료에 따르면 사천보다 제주의 평균 기온이 보다 이른 시기에 증가함으로써 노린재 성충이 비교적 일찍 관찰되었다. 기존에 보고된 우화시기에 맞게 갈색날개노린재와 썩덩나무노린재는 6-7월, 풀색노린재는 8-9월에 관찰되었으며, 사천에서는 썩덩나무노린재와 풀색노린재, 제주에서는 갈색노린재가 더 높은 개체수로 조사되었다. 아직까지 국내 참다래 농가의 노린재류에 대한 조사는 미비한 편이다. 하지만 다른 과수의 노린재의 연구에 따르면 점차 증가하는 기온과 함께 노린재류의 우화시기는 단축되어 낙과 피해가 증가하고 있고, 평지 과원에 비해 산지 과원의 피해과율이 더 높게 나타난 것으로 보고되어 있다(Lee 등, 2009). 따라서 비가림 재배에 비해 노지 재배에서 보다 철저한 방제가 필요하며, 지역적인 발생 양상의 차이 또는 참다래 과실 피해의 참다래 종간의 차이 등은 추가적인 연구가 필요하다고 생각된다.
요약
전세계뿐만 아니라 국내에서도 참다래의 품질을 높이기 위한 신품종 육성이 꾸준히 이루어지고 있다. 새롭게 육성된 품종은 과실 특성뿐만 아니라 병해충 발생 양상에 대한 자료가 전무하기 때문에 연속된 조사를 통해 기존 재배 품종인 ‘헤이워드’와 비교한 기초 자료가 제시되어야 한다. 따라서 참다래의 주요 병해충으로 알려진 점무늬병과 궤양병 그리고 노린재류에 대한 발생 조사를 3년간 실시하였다. 지역과 재배 환경에 따르면 기온이 높을수록 점무늬병이, 강수량이 많을수록 궤양병의 발생빈도가 높았고, 노지 재배보다는 비가림 재배에서 병 발생을 낮출 수 있는 것으로 보였다. 또한, 신품종 간에 ‘감록’은 노지 재배 환경에서 다른 품종들에 비해 병에 매우 감수성인 것으로 보였으나, 비가림 재배 환경에서 이를 극복할 수 있는 것으로 보였다. 노린재류 발생 조사에서는 페로몬 트랩을 포장 내부에 설치했을 때 과실 피해가 증가하는 것으로 보여 농가 외부에 트랩을 설치하는 것이 바람직할 것으로 보인다.
Acknowledgement
This research was supported by the “Cooperative Research Program for Agriculture & Technology Development (PJ010904)” from the RDA.
References
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.