딸기 수경재배에서 시들음병 발생에 배양액 pH와 EC 효과
Effect of Nutrition Solution pH and Electrical Conductivity on Fusarium Wilt on Strawberry Plants in Hydroponic Culture
Article information
Abstract
Fusarium wilt on strawberry plants caused by Fusarium oxysporum f. sp. fragariae (Fof) is a major disease in Korea. The prevalence of this disease is increasing, especially in hydroponic cultivation in strawberry field. This study assessed the effect of nutrition solution pH and electrical conductivity (EC) on Fusarium wilt in vitro and in field trials. pH levels of 5.0, 5.5, 6.0, 6.5, 7.0, and 7.5 were assayed in vitro and in field trials. EC levels at 0, 0.5, 0.8, 1.0, and 1.5 dS?m-1 were assayed in field trials. Mycelial growth of Fof increased with increasing pH and was highest at 25°C pH 7 and lowest at 20°C, pH 5.0 in vitro. The incidence of Fusarium wilt was lowest in the pH 6.5 treatment and highest in the pH 5 treatment in field trials. At higher pH levels, the EC decreased in the drain solution and the potassium content of strawberry leaves increased. In the EC assay, the severity of Fusarium wilt and nitrogen content of leaves increased as the EC increased. These results indicate that Fusarium wilt is related to pH and EC in hydroponic culture of strawberry plants.
서론
Fusarium oxysporum f. sp. fragariae (Fof)에 의한 딸기 시들음병은 신엽이 1-2엽이 작아지는 기형잎(짝잎)과 생육저하로 결국은 묘가 고사되는 피해로 인해 딸기 재배포장에서 큰 문제가 되고 있는 병해이다(Kim 등, 1982). 특히 국내 딸기의 주요 품종인 ‘설향’은 2006년부터 꾸준히 증가하여 2016년 전국의 83.4%를 차지하고 있으며(Korea Rural Economic Institute, 2017), 이 품종은 시들음병에도 감수성으로 매년 병 발생이 증가하고 있다(Nam 등, 2011). 또한 국내 딸기 수경재배 면적도 매년 증가 추세를 보이며 2016년에는 1,148 ha로 재배면적의 19.2%를 차지한다. 이처럼 딸기 재배에서 단일품종의 우점적 재배와 수경재배 면적 증가로 인한 상토 소독 미흡 및 작은뿌리파리와 복합피해(Nam 등, 2017), 기후변화에 따른 온도 상승(Fang 등, 2011) 등은 토양병해인 시들음병 발생 증가에 주요한 원인으로 보여진다.
딸기 시들음병은 1962년 호주에서 최초 보고(Winks와 Williams, 1965)된 이후 국내에도 1982년에 발생이 보고되었다(Kim 등, 1982). 딸기 시들음병은 토양전염성 병해로 이병토양(Burgess, 1981)과 묘에 감염된 이병 식물체(Nam 등, 2011)가 주요 전염원이다. 딸기 시들음병 방제로는 저항성 품종, 정식 전토양 소독, 생물적 방제, 윤작, 무병묘, 위생, 장비 소독 등이 있다(Gordon 등, 2016; Koike와 Gordon, 2015). 시들음병은 발생이 된 상태에서는 방제가 어렵기 때문에 토양이나 상토 소독외 재배적 방제가 중요한 역할을 한다.
Fusarium spp.에 의한 작물의 시들음병 발생은 산성토양(Fang 등, 2012), 낮은 electrical conductivity (EC)와 미생물 활성(Santos와 Bettiol, 2003), 높은 질소시비(Duffy와 Défago, 1999) 등에서 병 발생이 증가한다. 딸기 시들음병은 산성토양에서 발생이 증가하며(Nam 등, 2005), asparagus에 발생하는 시들음병의 경우 토양의 pH를 중성 pH (6.0)으로 유지함으로써 병 발생을 억제할 수 있었다(Elmer, 2015). 반면, 토양의 높은 EC는 Sclerotium rolfsii에 의한 bean 식물의 잘록병을 감소시키지만(Santos와 Bettiol, 2003), F. oxysporum f. sp. lactucae에 의한 lettuce의 시들음병 발생에는 영향이 없었다(Chitarra 등, 2013). 특히 딸기재배에서 수경재배가 증가하면서 시들음병 발생도 증가하고 있어, 이에 따른 수경재배 배양액의 EC가 시들음병 발생과 어떤 관련이 있는지 검토할 필요가 있다. 또한 시들음병 발생에는 영양원도 중요한 역할을 하는데 그 중 질소가 관련성이 크다(Duffy와 Défago, 1999; Gatch와 du Toit, 2015). F. oxysporum f. sp. dianthi는 토양에서 암모늄태질소보다 질산태질소가 병 발생을 억제하는데 질산태질소는 후막포자의 형성을 억제하고 분해를 증가시키기 때문이라고 한다(Gullino 등, 2015).
따라서 본 연구에서는 딸기 수경재배에서 시들음병 발생을 줄일 수 있는 방법으로 배양액의 pH와 EC 수준에 따른 시들음병 억제효과를 검토하였다.
재료 및 방법
In vitro 상에서 pH에 따른 시들음병균의 균사생장
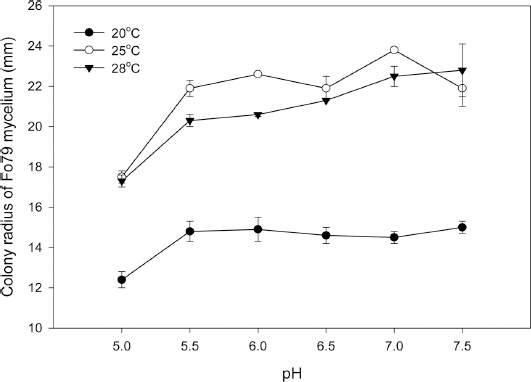
pH에 따른 딸기 시들음병균의 균사생장률은 pH 5.0, 5.5, 6.0, 6.5, 7.0, 7.5 수준으로 20, 25, 28°C의 온도에서 조사하였다. 2003년 논산지역의 ’사마베리’ 품종의 관부에서 분리한 딸기 시들음병균 Fo79 균주를(Nam 등, 2005) 질산과 수산화칼륨으로 pH를 조정한 potato dextrose agar (PDA, Difco, USA) 배지에서 배양하였다. 균사 생장률은 배지에 접종 3일 후 균사 반경을 측정하였다.
식물체와 배양액
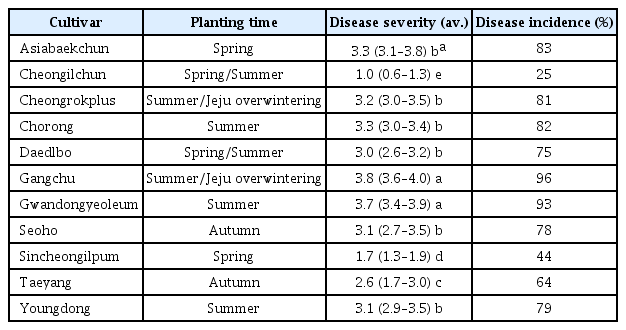
딸기 재배포장에서의 배양액 pH와 EC에 따른 시들음병 이병률 조사는 논산딸기시험장 병 검정 비닐하우스에서 실시하였다. 시험품종은 ‘설향’으로 조직배양묘를 모주로 육묘한 3-4장의 잎을 가진 자묘를 시험에 이용하였다. 자묘는 딸기전용상토(코코피트:피트모스:펄라이트=65:17:10, 푸르미, 서울바이오)가 충진된 플라워 박스(쌍우3호, 57×18 cm)에 박스당 3-5주씩 정식하였다. 시험구 배치는 완전임의배치 3반복으로 처리당 9-15주를 조사하였다. 시험에 사용한 배양액(Table 1)으로 pH 시험에는 추비용 관주비료(N-P-K: 30-10-10, 1000배, EC 0.63, 퍼티케어, ㈜도프(평택, 한국))를 질산과 수산화칼륨으로 pH를 조절하였으며, EC 시험은 일본원시조성액으로 EC를 조정하여 사용하였다. 시험기간 동안 시험포장의 기상환경은 평균온도 20-29°C, 평균 상대습도 40-65%였다.
딸기 재배포장에서 배양액 pH에 따른 시들음병 억제효과
배양액 pH 수준은 5.0, 5.5, 6.0, 6.5, 7.0의 5처리로 1차 시험은 4월 28일부터 6월 6일까지 2분/1회/일, 2차 시험은 6월 24일부터 7월 12일까지 4분/2회/일 동안 배양액을 공급하였다. 딸기 시들 음병균 접종 은 Fo79 균주를 MM배지(Correl l 등, 1987)에서 28°C, 200 rpm으로 진탕배양 7일 후 1×106 conidia/ml의 포자농도로 주당 50 ml씩 1차 시험은 5월 4일 건전 상토에, 2차 시험은 6월 30일 이병 상토에 접종하였다. 처리 후 시기별 이병지수를 조사하였다. 이병지수는 0은 무병징, 1은 1-2엽이 휘어지고 신엽이 황화하며 하엽의 엽병이 적색을 띰, 2는 모든 잎이 휘어지고 짝잎이 발생, 3은 잎이 황화되고 식물체의 반 이상이 시듦 증상, 4는 식물체 전체가 시듦, 5는 식물체 전체가 고사이다(Nam 등, 2005).
딸기 재배포장에서 배양액 EC에 따른 시들음병 억제효과
배양액의 EC 수준은 0, 0.5, 0.8, 1.0, 1.5 dS·m-1로 1차 시험은 7월 15일부터 8월 29일까지 4분/2회/일 공급하였고, 2차 시험은 10월 10일부터 12월 23일과 다음 해 4월 6일부터 5월 16일까지 4분/2회/일 동안 배양액을 공급하였다. 위의 방법과 동일하게 딸기 시들음병균 포자현탁액을 조제 후 주당 50 ml씩 1차 시험은 7월 21일, 2차 시험은 10월 16일에 건전 상토에 접종하였다. 처리 후 시기별 이병지수 조사는 위의 방법과 동일하게 실시하였다.
상토, 배액 및 식물체 분석
상토와 배액의 pH는 pH meter(FieldScout pH400, Spectrum Co., Aurora, IL, USA)로 측정하였고, EC는 EC meter (WT1000B, 미래센서(서울, 한국))로 측정하였다. 배액은 1일 동안 수집된 각 처리별 배양액을 측정하였다.
식물체 잎의 무기함량 분석은 식물체의 3번째 잎을 채취하여 건조 시킨 후 완전히 분쇄하여 농촌진흥청 농업과학기술원의 토양과 식물체 분석법에 준하여 분석하였다(National Institute of Agricultural Science and Technology, 2000). 식물체 무기 성분은 유도결합 플라즈마분광분석기(Inductively coupled Plasma Spectroscopy, GBC Integra, XL, Braeside, VIC, Australia)를 이용하여 분석하였다. 처리간 비교는 CoStat 통계 프로그램(CoHort software, Berkeley, CA, USA)을 이용해 Duncan multiple range test (P<0.05) 분석으로 실시하였다.
결과 및 고찰
In vitro 상에서 pH에 따른 시들음병균의 균사생장률
딸기 시들음병균의 균사생장은 in vitro 상에서 pH가 증가할수록 증가하였으며, 25°C에서 pH 7.0이 가장 높았고, 20°C에서 pH 5.0가 가장 낮았다(Fig. 1). 국내 딸기 시들음병균의 pH에 따른 균사생육은 pH가 낮을수록 감소하였으며 25°C가 20°C나 28°C 처리보다 높은 균사생장률을 보였다.
미국의 딸기 시들음병균은 pH 5-8 범위에서 배양 시 처리간 유의성은 없었으며 균사생육은 pH가 낮을수록 낮아지는 경향을 보였다(Islas, 2012). Soybean에 발생하는 F. oxysporum 균도 15°C, pH 5에서 가장 낮은 균사생장률을 나타내(Cruz 등, 2015)국내 분리균과 비슷한 경향을 보였다. 토마토 시들음병균의 포자는 pH 6.5가 포자형성에 가장 좋은 반면 chlamydospores의 발아는 pH 4.5에서 가장 최대라고 하였다(Tyagi와 Paudel, 2014). 또한 F. soloni f. sp. phaseoli의 chlamydospores는 높은 pH에서 carbon의 손실이 높으며 이런 토양조건은 미생물작용을 증진시키는 효과가 있으므로(Mondal과 Hyakumachi, 1998) 추후 pH와 chlamydospores의 생장에 대한 실험이 실시되어야 할 것으로 사료된다.
배양액 pH에 따른 시들음병 억제효과
재배포장 검정에서 시들음병 발생은 배양액의 pH 6.5가 다른 처리보다 가장 낮았으며 pH 5가 가장 높은 경향을 보였다(Fig. 2). 배양액의 pH가 상승함에 따라 상토의 pH는 떨어지는 경향을 보였으나 EC는 처리간 유의성이 없었다(Table 2). 또한 배양액의 pH가 높아질수록 배액의 EC는 감소하였으나 pH는 증가하는 경향을 보였다. 배양액 pH수준별 처리 후 식물체 분석 결과 배양액 pH증가에 따라 잎의 칼륨농도는 증가하는 경향을 보였으며 다른 무기원소는 처리간 뚜렷한 경향을 보이지 않았다(Table 3).
Disease index [(A) 1st trial, (B) 2nd trial] of Fusarium wilt by pHs of nutrition solution in hydroponic culture of 'Seolhyang' strawberry plants.
Fang 등(2012)은 토양재배에서 pH 6.7인 토양이 다른 pH 토양보다 시들음병 발생이 가장 적다고 하여 본 결과와 비슷한 경향을 보였다. 토양의 pH에 따른 딸기 시들음병균 발생은 병원균의 접종농도를 5×102 cfu/g로 낮게 처리할 경우 pH 6-7 처리가 이병률이 가장 낮았으나 접종 농도가 5×104 cfu/g 이상의 균농도에서는 pH 수준에 따른 시들음병 이병률 차이는 볼 수 없다고 한다(Islas, 2012).
근권부의 pH 변화는 작물의 비료흡수 특성, 관개수의 중탄산농도, 비료의 조성, 상토의 종류에 따르며 정상적인 생장이 이루어지면 pH는 변화하며 근권부의 pH가 5.5-6.5를 유지할 경우 작물의 생장은 우수하다(Nelson, 2003). 딸기 수경재배에서 적정 pH 범위는 5.5-6.2(토양 6.2-6.7)로 딸기는 양이온 흡수량이 높아 근권부의 pH가 낮은 작물이며(Choi 등, 2010; Shin 등, 2013), 토양은 산성화가 될 경우 근권부의 Ca 및 Mg의 불용화에 따른 흡수량 저하가 발생한다고 한다(Nelson, 2003). 특히 ‘설향’ 품종은 NH4나 K 등 1가 양이온 흡수량이 많고 근권부의 pH를 산성 쪽으로 변화시키는 독특한 특성이 있다(Lee 등, 2015). 대부분의 작물은 pH가 낮아지면 사이토카닌이나 옥신의 활성이 떨어져 뿌리 발근이나 신장이 나빠진다고 한다(Yamazaki, 1982). 위의 결과에서 배양액 pH가 높을수록 시들음병 발생은 감소하고 배액의 pH는 증가하는 경향은 배액의 pH가 높은 것은 뿌리의 활성이 양호하나 pH가 낮은 것은 뿌리의 활성이 낮다는 결과(Jun 등, 2011)와 관련이 있을 것으로 사료된다.
본 결과에서는 배양액 pH가 높아질수록 식물체의 칼륨농도는 증가하는 경향을 보였는데 토마토 시들음병의 경우에도 배지의 pH가 산성보다는 알칼리성에서 병 발생이 감소하였고 pH가 증가할수록 식물체의 칼륨 함량이 증가하여(Borrero 등, 2004) 본 결과와 비슷한 경향을 확인할 수 있었다. Table 3에서의 pH수준별 식물체 무기성분 함량을 분석한 시기는 딸기 육묘기(3-8월)이다. 이 시기에 대부분의 딸기재배농가에서는 자묘의 영양번식이 목적이기 때문에 표준화된 양액조성 대신 농축액을 만드는 번거로움을 피하고 생육상태에 따라 비료 조성을 쉽게 바꿀 수 있도록 복합비료를 사용하고 있다(Lee 등, 2015). 복합비료는 생리적으로 산성, 중성, 알칼리성에 따라 작물의 흡비 특성에 차이가 있는데 딸기 생육이 가장 우수한 알칼리성 200비료(Lee 등, 2015) 처리시 식물체 인산과 칼륨 함량은 본 결과의 pH 6-7.0 수준과 비슷한 경향을 보였다.
배양액 EC에 따른 시들음병 억제효과
재배포장에서 배양액 EC가 증가할수록 시들음병 발생은 증가하는 경향을 보였으나 EC 0.0과 1.5 dS·m-1를 제외한 처리간 유의성은 2차 시험에서는 보이지 않았다(Table 4). 상토와 배액의 EC는 배양액 EC가 증가할수록 증가하였다(Table 5). 또한 식물체 분석 결과 질소는 EC 증가에 따라 증가하는 경향을 보였으나 다른 무기원소는 뚜렷한 차이를 볼 수 없었다(Table 6).

Nutrient status of strawberry leaves grown in electrical conductivity (EC) levels of nutrition solution in hydroponic culture of ‘Seolhyang’ strawberry plants
Lettuce (Chitarra 등, 2013)와 토마토(Borrero 등, 2004)의 시들음병은 EC에 따른 영향은 적다고 하여 본 연구와 다른 결과를 보였다. 그러나 본 결과에서는 배양액의 EC가 증가할수록 시들음병 발생은 증가하였고 질소농도도 증가하는 경향을 보여 질소가 시들음병 발생에 중요한 역할을 할 것으로 사료된다. 토마토 시들음병은 암모늄태 질소와 NaHPO4·H2O, Fe-EDDHA, MnSO4, MoO3, ZnSO4·7H2O 농도가 증가할수록 병 발생은 증가하였으나 질산암모늄의 적정농도(N 100 mg/l)에서는 생체중도 증가하였고 시들음병 발생도 감소하는 경향을 보였다(Duffy와 Défago, 1999). 또한 암모니아태질소/질산태질소 비율이 높을수록 토마토 시들음병(Borrero 등, 2012)과 오이 시들음병(Wang 등, 2016)은 증가하는 결과를 보였다. Spinach의 시들음병 발생은 NH4-N과 높은 상관관계를 보였으며(Gatch와 du Toit, 2015), 토마토 시들음병은 질산태질소와 CuSO4·5H2O 처리에서 발생이 감소하였고(Duffy와 Défago, 1999), 셀러리 시들음병은 KNO3가 다른 질소형태보다 병 발생이 감소한다고 하였다(Schneider, 1985). 비록 in vitro 상에서 바나나 시들음병균의 균사생육은 암모늄농도 증가에 따라 생육은 억제되었고(Zhang 등, 2013), 수박의 시들음병 발생도 질소원에 따른 영향이 없다고(Hopkins와 Elmstrom, 1976) 하여 딸기 재배포장에서도 질산태질소와 암모늄태질소 시비에 따른 시들음병 발생경향이 추후 조사되어야 할 것이다.
요약
Fusarium oxysporum f. sp. fragariae (Fof)에 의한 딸기 시들음병은 국내에서 중요한 병해이다. 특히 딸기재배에서 시들음병 발생은 수경재배 면적이 증가하면서 증가하는 경향을 보이고 있다. 따라서 이 연구에서는 딸기 수경재배에서 시들음병 발생에 배양액의 pH와 EC의 영향을 in vitro와 재배포장에서 조사하였다. pH는 5, 5.5, 6, 6.5, 7, 7.5로 in vitro와 재배포장에서 검정하였고 EC는 0, 0.5, 0.8, 1, 1.5 dS·m-1로 재배포장에서 조사하였다. In vitro 상에서 딸기 시들음병균의 균사생육은 pH가 증가하면서 증가하였고 25°C, pH 7에서 최대였으며 20°C, pH 5에서 가장 낮았다. 재배포장에서 딸기 시들음병 발생은 pH 6.5에서 가장 낮았고 pH 5에서 가장 높은 경향을 보였다. 배양액의 pH는 높아질수록 배액의 EC는 감소하였고 딸기 잎의 칼륨함량은 증가되었다. EC 검정에서 배양액 EC가 상승함에 따라 딸기 시들음병 발생과 잎의 질소함량은 증가하였다. 이런 결과로 딸기 시들음병 발생은 수경재배에서 pH와 EC가 관련이 있다는 것을 알 수 있었다.
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgement
This research was supported by a grant (Project No. PJ01188604) from Rural Development Administration, Republic of Korea.