Albertini, C, Gredt, M and Leroux, P 1999. Mutations of the β-tubulin gene associated with different phenotypes of benzimidazole resistance in the cereal eyespot fungi
Tapesia yallundae and Tapesia acuformis.
Pestic. Biochem. Physiol 64: 17-31.

Baraldi, E, Mari, M, Chierici, E, Pondrelli, M, Bertolini, P and Pratella, G. C 2003. Studies on thiabendazole resistance of
Penicillium expansum of pears: pathogenic fitness and genetic characterization.
Plant Pathol 52: 362-370.

Bradley, C. A, Lamey, H. A, Endres, G. J, Henson, R. A, Hanson, B. K, McKay, K. R, Halvorson, M, LeGare, D. G and Porter, P. M 2006. Efficacy of fungicides for control of Sclerotinia stem rot of canola.
Plant Dis 90: 1129-1134.


Chen, S. N, Shang, Y, Wang, Y, Schnabel, G, Lin, Y, Yin, L. F and Luo, C. X 2014. Sensitivity of
Monilinia fructicola from peach farms in China to four fungicides and characterization of isolates resistant to carbendazim and azoxystrobin.
Plant Dis 98: 1555-1560.


Chung, W. H, Chung, W. C, Peng, M. T, Yang, H. R and Huang, J. W 2010. Specific detection of benzimidazole resistance in
Colletotrichum gloeosporioides from fruit crops by PCR-RFLP.
New Biotech 27: 17-24.

Davidse, L. C and Flach, W 1977. Differential binding of methyl benzimidazol-2-yl carbamate to fungal tubulin as a mechanism of resistance to this antimitotic agent in mutant strains of
Aspergillus nidulans.
J. Cell Biol 72: 174-193.



Davidson, R. M, Hanson, L. E, Franc, G. D and Panella, L 2006. Analysis of β-tubulin gene fragments from benzimidazole sensitive and tolerant
Cercospora beticola.
J. Phytopathol 154: 321-328.

Elad, Y, Shabi, E and Katan, T 1988. Negative cross resistance between benzimidazole and N-phenylcarbamate fungicides and control of Botrytis cinerea on grape. Plant Pathol 37: 141-147.
Hartill, W. F. T 1986. Resistance of plant pathogens to fungicides in
New Zealand.
N. Z. J. Exp. Agric 14: 239-245.

Hwang, S. Y, Kim, H. R, Kim, J. H, Park, J. H, Lee, S. B, Cheong, S. R and Kim, H. T 2010. Sensitivity of
Colletotrichum spp. isolated from grapes in Korea to carbendazim and the mixture of carbendazim plus diethofencarb.
Plant Pathol. J 26: 49-56.

Ishii, H and Takeda, H 1989. Differential binding of a N -phenylformamidoxime compound in cell-free extracts of benzimidazole-resistant and-sensitive isolates of Venturia nashicola, Botrytis cinerea and Gibberella fujikuroi. Neth. J. Plant Pathol. 95(Suppl 1). 99-108.
Ishii, H and Yamaguchi, A 1977. Tolerance of
Venturia nashicola to thiophanate-methyl and benomyl in Japan.
Ann. Phytopathol. Soc. Jpn 43: 557-561.

Jones, A. L and Walker, R. J 1976. Tolerance of Venturia inaequalis to dodine and benzimidazole fungicides in Michigan. Plant Dis. Report 60: 40-44.
Jung, M. K, Wilder, I. B and Oakley, B. R 1992. Amino acid alterations in the
benA (β-tubulin) gene of
Aspergillus nidulans that confer benomyl resistance.
Cell Motil. Cytoskeleton 22: 170-174.


Kang, B. K, Min, J. Y, Kim, Y. S, Park, S. W, Van Bach, N and Kim, H. T 2005. Semi-selective medium for monitoring
Colletotrichum acutatum causing pepper anthracnose in the field.
Res. Plant Dis 11: 21-27. (In Korean)

Kim, J. H, Min, J. Y, Bae, Y. S and Kim, H. T 2009. Molecular analysis of
Botrytis cinerea causing ginseng grey mold resistant to carbendazim and the mixture of carbendazin plus diethofencarb.
Plant Pathol. J 25: 322-327.

Koenraadt, H, Somerville, S. C and Jones, A. L 1992. Characterization of mutations in the beta-tubulin gene of benomyl-resistant field strains of
Venturia inaequalis and other plant pathogenic fungi.
Phytopathology 82: 1348-1354.

Kwon, S. M, Yeo, M. I, Choi, S. H, Kim, K. W, Jun, K. J and Uhm, J. Y 2010. Reduced sensitivities of the pear scab fungus (
Venturia nashicola) collected in Ulsan and Naju to five ergosterol-biosynthesis-inhibiting fungicides.
Res. Plant Dis 16: 48-58. (In Korean)

Ma, Z and Michailides, T. J 2005. Advances in understanding molecular mechanisms of fungicide resistance and molecular detection of resistant genotypes in phytopathogenic fungi.
Crop Prot 24: 853-863.

Ma, Z, Yoshimura, M. A and Michailides, T. J 2003. Identification and characterization of benzimidazole resistance in
Monilinia fructicola from stone fruit orchards in California.
Appl. Environ. Microbiol 69: 7145-7152.




Martin, R. J 1997. Modes of action of anthelmintic drugs.
Vet. J 154: 11-34.


McKay, G. J, Egan, D, Morris, E and Brown, A. E 1998. Identification of benzimidazole resistance in
Cladobotryum dendroides using a PCR-based method.
Mycol. Res 102: 671-676.

Pappas, A. C 1997. Evolution of fungicide resistance in
Botrytis cinerea in protected crops in Greece.
Crop Prot 16: 257-263.

Qiu, J, Xu, J, Yu, J, Bi, C, Chen, C and Zhou, M 2011. Localization of the benzimidazole fungicide binding site of
Gibberella zeae β
2-tubulin studied by site-directed mutagenesis.
Pest Manag. Sci 67: 191-198.



Quello, K. L, Chapman, K. S and Beckerman, J. L 2010. In situ detection of benzimidazole resistance in field isolates of
Venturia inaequalis in Indiana.
Plant Dis 94: 744-750.


Ross, R. G and Newberry, R. J 1985. Tolerance to benomyl of
Venturia inaequalis in Nova Scotia.
Can. J. Plant Pathol 7: 435-437.

Sedláková, B and Lebeda, A 2008. Fungicide resistance in Czech populations of cucurbit powdery mildews.
Phytoparasitica 36: 272-289.


Trkulja, N, Ivanović, Ž, Pfaf-Dolovac, E, Dolovac, N, Mitrović, M, Toševski, I and Jović, J 2013. Charateisation of benzimidazole resistance of
Cercospora beticola in Sebia using PCR-based detection of resistance-associated mutations of the β-tubulin gene.
Eur. J. Plant Pathol 135: 889


Yarden, O and Katan, T 1993. Mutations leading to substitutions at amino acids 198 and 200 of beta-tubulin that correlate with benomyl-resistance phenotypes of field strains of
Botrytis cinerea.
Phytopathology 83: 1478-1483.

Yin, Y. N and Xiao, C. L 2013. Molecula characterization and a multiplex allele-specific PCR method for detection of thiabendazole resistance in
Penicillium expansum from apple.
Eur. J. Plant Pathol 136: 703-713.


Zhan, R and Huang, J 2007. Cloning of a carbendazim-resistant gene from Colletotrichum gloeosporioides of mango in South China. Afr. J. Biotech 6: 143-147.
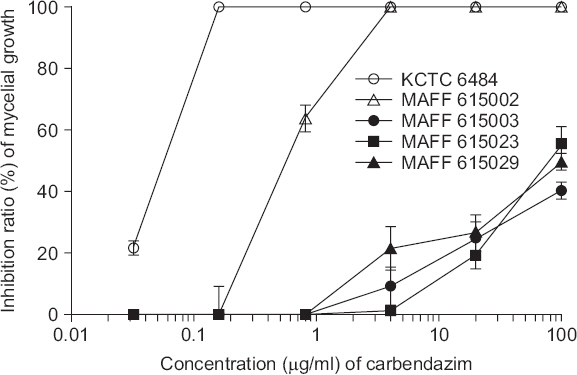

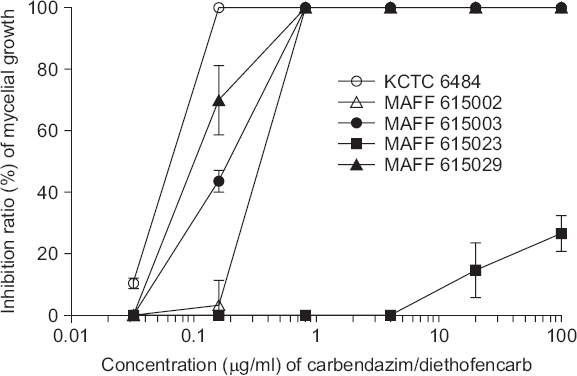





 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






