콩황화모틀모자이크바이러스의 신속검출을 위한 역전사 등온증폭법
Reverse Transcription Loop-Mediated Isothermal Amplification Assay for Rapid Detection of Soybean yellow mottle mosaic virus
Article information
Abstract
Soybean yellow mottle mosaic virus (SYMMV) is a new emerging plant virus detected in soybean (Glycine max) in Korea. Reverse transcription loop-mediated isothermal amplification (RT-LAMP) assay for rapid detection of SYMMV has been developed. In this study, we have designed primers (SYMM-F3/B3/FIP/BIP) specific to sequences from the coat protein gene of SYMMV genome. Sensitivity analysis showed that RT-LAMP was 10 to 100 times more sensitive than reverse transcription polymerase chain reaction (RT-PCR). The optimal reaction condition of RT-LAMP was determined at 65°C for 50 minutes. The result indicates that RT-LAMP assay does not require special equipment and long time for SYMMV detection. Therefore, it can be an alternative detection method of RT-PCR in laboratory.
서론
콩(Glycine max)은 식물성 단백질 공급원으로 경제적으로 중요한 작물 중 하나이다. 전 세계적으로 46종의 바이러스가 콩에 감염되는 것으로 보고되었으며(Tolin과 Lacy, 2004), 국내에서는 Soybean mosaic virus (SMV)를 포함하여 현재까지 11종이 보고되어 있다(Lee 등, 2013, 2015; Lim 등, 2014; Shin 등, 2014). 이 중에서, Kim (2006)에 의해서 최초 보고된 콩황화모틀모자이크바이러스(Soybean yellow mottle mosaic virus, SYMMV)는 Carmovirus속, Tombusviridae과에 속하는 바이러스이다. SYMMV의 게놈은 양성-극성 외가닥 RNA (positive sense single stranded RNA) 바이러스로 여섯 개의 열린 해독틀(open reading frame)과 비번역영역(untranslated region)으로 구성되어 있다(Nam 등, 2009). SYMMV는 콩, 돌콩(Glycine soja), 새팥(Vigna angularis var. nipponensis), 토끼풀(Trifolium repens), 비수리(Lespedeza cuneate) 등 콩과 식물에 국한된 자연기주 범위를 가지며, 돌콩에서 종자전염을 통한 안정된 생활사를 취하는 것으로 알려져 있다(Lee와 Kim, 2013). 최근 콩 재배지의 바이러스병 발생조사결과에 따르면 SYMMV는 SMV, Soybean yellow common mosaic virus (SYCMV)와 함께 국내 콩에서 빈번하게 발생하는 주요 바이러스병이며(Cho 등, 2013; Lee 등, 2013), 2013년 국내 전국 콩 단위조사 결과 발병률이 가장 높은 바이러스로 확인되었다(Seo 등, 2014).
염기서열을 기반으로 하는 진단법이 발달하게 되면서 등온증폭법(loop-mediated isothermal amplification, LAMP)이 고안되었다(Notomi 등, 2000). LAMP 방법은 등온조건에서 6개의 염기서열영역을 인식하는 4개의 프라이머와 strand displacement activity가 높은 Bst 중합효소를 사용하여 간단하고 빠르게 목적 염기서열을 증폭시킨다. LAMP 방법을 기반으로 한 역전사 등온증폭법(reverse transcription loop-mediated isothermal amplification, RT-LAMP)은 Japanese yam mosaic virus, Tomato chlorosis virus, Tomato yellow leaf curl virus, Wheat yellow mosaic virus 등으로 야기된 병의 진단 및 바이러스의 신속검출에도 적용되고 있다(Fukuta 등, 2003a, 2003b; Zhang 등, 2011; Zhao 등, 2015).
본 연구에서는 신속하고 정확하며 비용효율이 높은 검출방법인 RT-LAMP 방법을 이용하여 콩에 문제시되고 있는 SYMMV의 신속검출방법을 제안하고자 하였다.
재료 및 방법
SYMMV 감염주의 수집 및 RT-PCR 진단
2014년, 대구광역시 하빈면에 위치한 농촌진흥청 국립식량과학원 남부작물부 대구시험지 유전자원포에서 모자이크, 얼룩, 황화, 퇴록 등의 전형적인 바이러스 증상을 보이는 콩 잎을 수집하였다. 수집한 시료는 easy-spin RNA extraction kit (iNtRON Biotechnology, Seongnam, Korea)를 이용하여 제조사의 실험 방법에 따라 전체 RNA를 추출하였으며, 이를 국내 콩에 발생 보고된 바이러스 6종(SMV, SYMMV, SYCMV, Peanut stunt virus [PSV], Bean common mosaic virus [BCMV], Peanut mottle virus [PeMoV])에 대하여 특이적 프라이머를 이용하여 reverse transcription polymerase chain reaction (RT-PCR) 진단을 수행하였다(Lee 등, 2013). RT-PCR 진단 결과를 토대로 SYMMV에 단독으로 감염된 시료에 한하여 본 연구의 공시시료로 사용하였다.
RT-LAMP primer 제작
종 특이적 프라이머 선발을 위해 National Center for Biotechnology Information GenBank에 등록되어 있는 SYMMV의 염기서열 정보를 수집하였다. 수집된 염기서열 정보는 DNAMAN software version 7.0 (Lynnon Corporation, Vandreuil, QB, Canada)을 이용하여 비교 분석한 후 외피단백질의 염기서열 정보를 이용하여 LAMP 프라이머를 설계하였다. 프라이머는 PrimerExplorer (http://primerexplorer.jp/elamp4.0.0/index.html)를 사용하여 제작하였다(Table 1).
RT-LAMP 재료 및 조성
RT-LAMP는 Loopamp RNA Amplification Kit (Eiken Chemical Co., Ltd., Tokyo, Japan)를 사용하여 반응을 수행하였다. Total RNA 2 µl와 50 pmol inner primer (FIP, BIP), 5 pmol outer primer (F3, B3), 1 µl Enzyme mix. (Bst DNA polymerase, AMV reverse transcriptase), 12.5 µl Reaction mix. (40 mΜ Tris-HCl, 20 mΜ KCl, 16 mΜ MgSO4, 20 mΜ (NH4)2SO4, 0.2% Tween 20, 1.6 Μ betaine, 2.8 mM deoxynucleoside triphosphate), 5.5 µl distilled water를 혼합하여 최종 25 µl의 반응액을 조성하였다.
최적 조건 확립
반응온도 및 반응시간의 최적조건을 확인하기 위하여 온도조건은 45°C–69.5°C, 시간조건은 10–60분으로 설정하여 반응을 진행하였다. 반응 후에는 80°C에서 5분간 효소를 비활성화시킨 후 반응을 종료하였다.
반응산물의 확인
각 반응이 끝나고 반응산물은 2% agarose gel상에서 전기영동을 실시한 후, ethidium bromide (EtBr)로 염색하여 확인하였다. 또한 SYBR Green I (Lonza, Rockland, ME, USA)을 적용하여 튜브 속 색의 변화 또는 발광유무 통해 반응 여부를 육안으로 확인하였다. 색의 변화는 일반 광, UV transilluminator (Sage Creation Science Co., Ltd., Beijing, China)에서 반응 여부를 확인하였다.
Primer의 특이성 확인
설계된 프라이머의 종 특이성을 확인하기 위해서 주요 콩 바이러스들에 대한 반응 여부를 확인하였다. 6종(SYMMV, SMV, SYCMV, PSV, BCMV, PeMoV) 바이러스의 양성대조구를 이용하여 특이성을 검증하였으며, 실험에 사용된 네 개의 프라이머들(FIP, BIP, F3, B3)에 대한 반응 특이성을 확인하기 위해서 네 개의 프라이머에서 하나 혹은 두 개를 제외하고 반응을 한 후에 기존의 증폭산물과 비교하였다.
민감도 비교
RT-LAMP와 RT-PCR의 민감도를 비교하기 위하여 RT-LAMP와 RT-PCR을 동일한 전체 RNA를 주형으로 260 ng/µl에서 2.6×10–6 ng/µl까지 단계적으로 10배씩 희석하여 반응을 수행하였다.
기기에 따른 재현성 확인
RT-LAMP가 등온이 유지되는 모든 기기에서 반응할 수 있는지 알아보기 위해 등온을 유지할 수 있는 기기인 유전자증폭기(BIOER, Hangzhou, China), 항온수조(Daihan LabTech Co., Ltd., Namyangju, Korea), 발열블록(FINEPCR Co., Ltd., Gunpo, Korea)을 이용하여 재현성을 확인하였다.
결과 및 고찰
RT-LAMP의 최적 반응 온도조건을 확인한 결과 62.8°C 이상에서 반응이 시작되는 것을 확인할 수 있었고, 69.5°C에서는 오히려 반응이 저해된 것을 확인하였다(Fig. 1). 62.8°C–69.5°C 사이의 온도조건만 유지된다면 기계적 조건에 관계없이 SYMMV에 대한 증폭이 가능하였다. 최적온도조건을 설정한 후 모든 반응은 65°C에서 실시하였다.
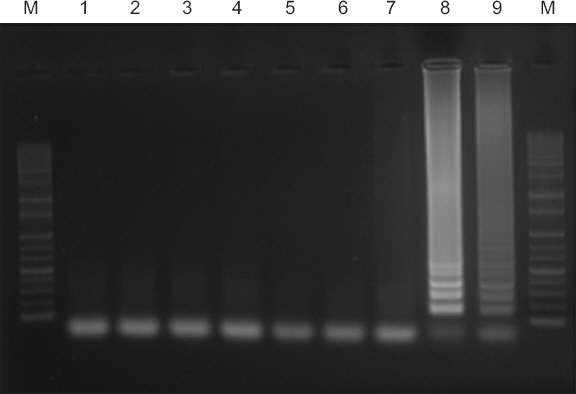
Optimal reaction temperature of reverse transcription-loop mediated isothermal amplification (RT-LAMP). RT-LAMP was performed under range of 45°C to 69.5°C. Lane M, 100 bp DNA ladder (Solgent, Daejeon, Korea); lanes 1–9 (45°C, 48.5°C, 49.8°C, 51.9°C, 54.8°C, 58.5°C, 62.8°C, 66.6°C, and 69.5°C, respectively).
최적반응 시간조건을 확인한 결과, 반응이 30분 이상 되었을 때 처음으로 반응이 확인되었으며, 50분 이상부터 최적의 반응을 보였다(Fig. 2). LAMP 방법은 기존의 PCR 방법과 유사하지만 등온조건에서 변성과정 없이 접합, 신장이 가능하다(Blomström 등, 2008; Nagamine 등, 2002). RNA 바이러스의 실험을 위해서는 RNA를 DNA로 역전사하는 과정을 거쳐야하는데 RT-LAMP는 일반적인 LAMP 방법과 동일하게 등온에서 역전사 과정과 LAMP 반응이 동시에 진행되기 때문에 RT-PCR과 비교했을 때 큰 시간 차이를 보이는 장점이 있어 RNA의 증폭 및 검출에 적용되고 있다(Fukuta 등, 2003a; Parida 등, 2004). 최적시간조건을 설정한 후 모든 반응은 50분으로 실시하였다.
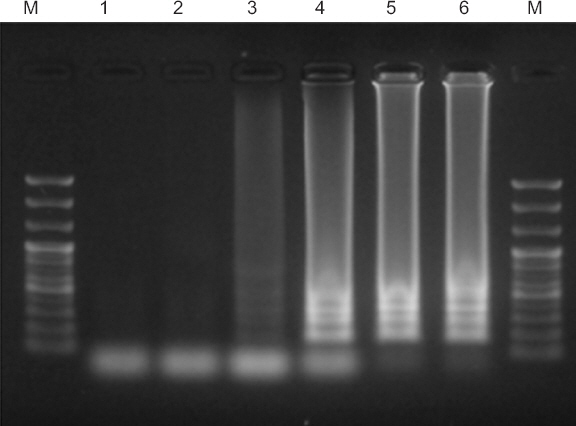
Optimal reaction time of reverse transcription-loop mediated isothermal amplification (RT-LAMP). RT-LAMP was performed under range of 10 to 60 minutes. Lane M, 100 bp DNA ladder; lanes 1–6 (10, 20, 30, 40, 50, and 60 minutes, respectively).
Primer의 특이성을 확인한 결과, SYMMV에서만 양성반응이 확인되었다(Fig. 3). 또한 네 개의 프라이머들에 대한 작동 특이성을 확인한 결과 모든 프라이머가 함께 있어야만 프라이머가 작동하여 반응이 일어나는 것이 확인되었다(Fig. 4). LAMP primer는 4개의 프라이머가 총 6부분의 염기서열영역과 반응하는데 이는 PCR과 비교하여도 높은 특이성을 나타낼 수 있을 것이라 생각된다.
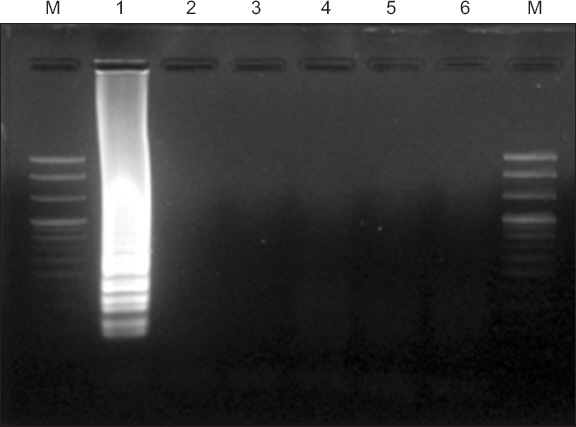
Specific reaction of primers for target virus. Lane M, 100 bp DNA ladder; lane 1, Soybean yellow mottle mosaic virus; lane 2, Soybean mosaic virus; lane 3, Soybean yellow common mosaic virus; lane 4, Peanut stunt virus; lane 5, Bean common mosaic virus; lane 6, Peanut mottle virus.

Reverse transcription-loop mediated isothermal amplification (RT-LAMP) primer set requirements for Soybean yellow mottle mosaic virus detection. Lane M, 100 bp DNA ladder; lane 1, negative control; lane 2, B+C+D; lane 3, A+C+D; lane 4, C+D; lane 5, A+B; lane 6, A+B+C+D. A, FIP; B, BIP; C, F3; D, B3.
RT-LAMP와 RT-PCR의 민감도를 비교한 결과 RT-LAMP는 2.6×10–5 ng/µl까지 RT-PCR은 2.6×10–4 ng/µl까지 밴드가 형성되는 것이 확인되었다. RT-PCR이 주형이 2.6×10–4 ng/µl일 때 매우 희미한 밴드를 형성한 것으로 보아 RT-LAMP가 RT-PCR보다 10–100배의 민감도를 가지고 있는 것으로 확인되었다(Fig. 5). RT-LAMP와 RT-PCR의 민감도를 비교했을 때 RT-LAMP를 적용한 바이러스 검출법 중 대다수의 바이러스병에 대하여 RT-PCR 방법보다 민감도가 높았다(Fukuta 등, 2003a; Zhang 등, 2011; Zhao 등, 2015).
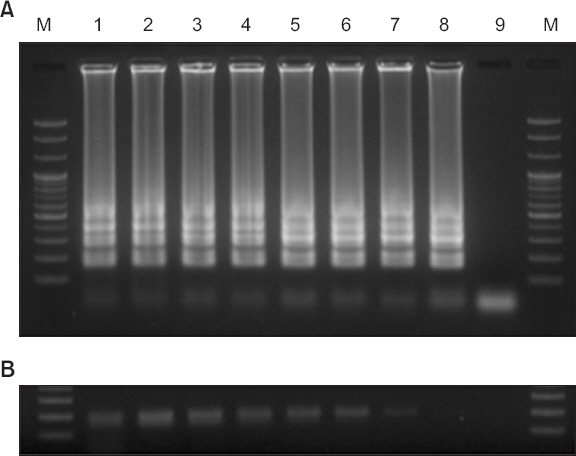
Sensitivity comparison of reverse transcription-loop mediated isothermal amplification (RT-LAMP) and RT-PCR for detecting Soybean yellow mottle mosaic virus (SYMMV). (A) Sensitivity analysis of RT-LAMP for the detection of SYMMV by agarose gel electrophoresis. (B) Sensitivity analysis of RT-PCR for the detection of SYMMV by agarose gel electrophoresis. Lane M, 100 bp DNA ladder; lanes 1–9, 10-fold dilution of total RNA (2.6×102 to 2.6×10–6, respectively).
RT-LAMP는 RT-PCR과 달리 등온에서 증폭이 가능하고 시간을 단축할 수 있는 장점을 가지고 있으며, 이와 같은 장점을 이용하여 농업현장에 RT-LAMP 방법을 적용하기 위해서는 항온수조나 발열블럭 등의 장비와 같이 이동성과 휴대성이 간편한 장비가 필수적으로 요구된다. RT-LAMP 방법의 중요한 요소 중의 하나인 등온조건을 유지할 수 있는 다양한 기기(유전자증폭기, 항온수조, 발열블록)를 이용하여 재현성을 확인한 결과, 모든 기기에서 동일한 RT-LAMP 결과를 확인 할 수 있었다(Fig. 6). 또한, 반응 후 전기영동이 아닌 SYBR green I을 이용하여 육안확인이 가능한지 알아보기 위해서 튜브 속 변색 또는 발광유무 통하여 반응 여부를 육안으로 확인한 결과 일반 광, 자외선 모두에서 양성 및 음성 대조군의 구분이 가능하였다(Fig. 7). 위의 특징을 이용한다면 현장에서 전기영동 없이 증폭산물의 반응유무를 육안으로 간편하게 확인 가능할 것으로 생각된다.

PCR test of reverse transcription-loop mediated isothermal amplification (RT-LAMP) on various thermostatic equipments. Lane M, 100 bp DNA ladder; lanes 1 and 2, positive and negative control in thermocycler machine; lanes 3 and 4, positive and negative control in heating block; lanes 5 and 6, positive and negative control in water bath.
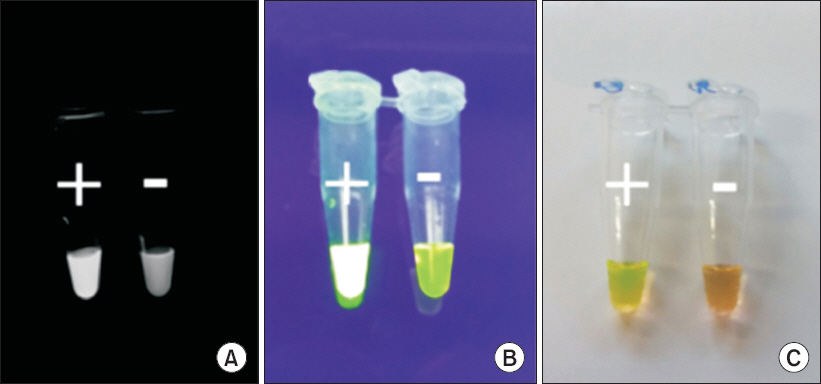
Visual detection for reverse transcription-loop mediated isothermal amplification (RT-LAMP) product with fluorescent dye. (A) Positive (luminescence, left) and negative (matte, right) fluorescent detection under UV transilluminator. (B) Positive (luminescence, left) and negative (matte, right) fluorescent detection under ultraviolet light. (C) Positive (yellow, left) and negative (orange, right) naked-eye detection under daylight.
식물바이러스 진단을 위하여 개발된 다양한 방법 중에서 국내에서는 효소결합면역흡착검사(enzyme-linked immunosorbent assay, ELISA)법과 RT-PCR 방법이 주로 이용되고 있다. ELISA 방법의 경우 대량의 시료를 비교적 저렴한 비용으로 신속하게 진단이 가능하지만 검출민감도가 낮고 검사 결과를 판독하는 과정에서 오류발생에 대한 한계가 있다(Lee 등, 2010). RT-PCR 방법은 검사 대상의 양적증가에 따른 진단비용과 소요시간 또한 증가하고, 기술 숙련자와 고가의 장비가 필요하다는 단점이 있다(Li와 Mock, 2005). 위와 같은 기존 진단법들의 단점을 극복하기 위해 개발된 LAMP 방법은 이미 많은 저널의 논문을 통하여 보고되었으며, 신속성 및 정확성 그리고 비용적인 부분에서 효율이 높은 방법으로 평가되고 있다(Mori와 Notomi, 2009; Parida 등, 2004).
본 실험 결과를 바탕으로 RT-LAMP는 SYMMV에 대한 신속, 정확한 진단에 적용될 수 있을 것이라 생각된다.
요약
SYMMV는 콩에서 빈번하게 발생하는 바이러스이며, 이 바이러스의 발생률은 계속해서 증가하고 있다. 본 연구에서는 콩에 발생하는 SYMMV를 신속하게 검출하기 위해서 RT-LAMP를 적용하였다. RT-LAMP 방법은 등온에서 단시간에 유전자 증폭이 가능하고, 전기영동 없이도 형광물질을 이용해 바이러스를 검출할 수 있는 이점이 있다. 프라이머는 SYMMV coat protein gene의 염기서열을 기반으로 4개의 프라이머를 설계하였다. 실험결과 SYMMV RT-LAMP는 65°C에서 50분간 증폭시켰을 때 최적의 효율을 보였다. 또한, RT-LAMP와 RT-PCR과의 민감도를 비교한 결과 RT-LAMP 방법이 10–100배 정도 더 우수한 민감도를 가지는 것으로 밝혀졌다. 본 실험 결과를 토대로 기존의 진단법과 비교하여 높은 민감도와 짧은 소요시간에 이점이 있는 RT-LAMP는 SYMMV의 현장 및 연구실에서의 진단에 적용될 수 있을 것이라 생각된다.
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgement
This research was carried out with the support Research & Development Program (Project No. PJ01124902) of National Institute of Crop Science, RDA, Republic of Korea.
