ņä£ļĪĀ
ņ×¼ļŻī ļ░Å ļ░®ļ▓Ģ
Ļ│Ąņŗ£ ĻĘĀņŻ╝ ļ░Å ļ░░ņ¢æļ░®ļ▓Ģ
LEDsļź╝ ņØ┤ņÜ®ĒĢ£ Ļ┤æ ņ▓śļ”¼ ļ░®ļ▓Ģ
ĻĘĀņé¼ņāØņן ļ░Å ļ®£ļØ╝ļŗī ņāēņåī ņĪ░ņé¼
Ļ▓░Ļ│╝
LEDs Ļ┤æņ¦łņØś ņŚ░ņåŹņĪ░ņé¼Ļ░Ć ĻĘĀņé¼ņāØņןņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢ź
Table┬Ā1
| Treatment* | Each mycelia diameter of four soil-borne fungal pathogens | |||
|---|---|---|---|---|
|
|
||||
|
Phytophthora cactorum KACC40166 (n=3)ŌĆĀ |
Athelia rolfsii KACC40170 (n=4)ŌĆĀ |
Helicobasidium mompa KACC40836 (n=4)ŌĆĀ |
Rosellinia necatrix KACC40168 (n=3)ŌĆĀ |
|
| ŌĆāŌĆāD | 61.4┬▒1.4 b | 82.4┬▒0.7 a | 58.3┬▒1.5 ab | 81.0┬▒3.5 a |
| ŌĆāŌĆāFL | 60.2┬▒0.6 bc | 76.0┬▒2.9 bc | 55.1┬▒2.5 bc | 31.9┬▒2.2 d |
| ŌĆāŌĆāB | 60.2┬▒2.3 bc | 74.9┬▒4.0 c | 52.5┬▒2.7 c | 22.2┬▒0.8 e |
| ŌĆāŌĆāG | 59.3┬▒0.4 c | 78.7┬▒3.1 abc | 55.2┬▒2.1 bc | 54.4┬▒6.0 bc |
| ŌĆāŌĆāR | 62.1┬▒0.5 ab | 78.5┬▒1.3 abc | 59.4┬▒0.9 a | 60.7┬▒10.8 bc |
| ŌĆāŌĆāBG | 61.1┬▒0.2 bc | 77.5┬▒2.5 bc | 53.8┬▒3.1 c | 26.6┬▒1.8 de |
| ŌĆāŌĆāBR | 61.5┬▒0.8 b | 80.2┬▒1.1 ab | 53.4┬▒3.7 c | 29.7┬▒2.0 de |
| ŌĆāŌĆāGR | 63.6┬▒0.8 a | 79.4┬▒3.4 ab | 55.3┬▒1.8 bc | 47.4┬▒3.5 c |
Values are presented as mean┬▒standard deviation.
Different letters within columns indicate significant difference based on Duncan's multiple range test at P=0.05.
LEDs Ļ┤æņ¦łņØś Ļ░äĒŚÉņĪ░ņé¼Ļ░Ć ĻĘĀņé¼ņāØņןņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢ź
Table┬Ā2
| Treatment* | Each mycelia diameter of four soil-borne fungal pathogens | |||
|---|---|---|---|---|
|
|
||||
|
Phytophthora cactorum KACC40166 (n=3)ŌĆĀ |
Athelia rolfsii KACC40170 (n=4)ŌĆĀ |
Helicobasidium mompa KACC40836 (n=4)ŌĆĀ |
Rosellinia necatrix KACC40168 (n=3)ŌĆĀ |
|
| ŌĆāŌĆāD | 55.3┬▒1.7 c | 71.4┬▒1.2 b | 34.0┬▒0.7 a | 64.4┬▒3.8 b |
| ŌĆāŌĆāFL | 57.4┬▒0.7 ab | 77.9┬▒1.8 a | 33.2┬▒2.3 ab | 29.8┬▒1.2 d |
| ŌĆāŌĆāB | 56.5┬▒1.6 bc | 64.9┬▒2.7 d | 30.4┬▒0.6 b | 26.8┬▒0.2 d |
| ŌĆāŌĆāG | 58.6┬▒1.7 a | 67.1┬▒1.2 cd | 30.0┬▒3.0 b | 57.3┬▒4.7 c |
| ŌĆāŌĆāR | 57.4┬▒0.9 ab | 64.8┬▒0.7 d | 31.8┬▒3.4 ab | 76.1┬▒1.0 a |
| ŌĆāŌĆāBG | 57.4┬▒1.0 ab | 66.5┬▒1.1 cd | 32.4┬▒1.8 ab | 26.9┬▒1.6 d |
| ŌĆāŌĆāBR | 56.5┬▒1.0 bc | 66.4┬▒1.9 cd | 34.1┬▒1.6 a | 28.6┬▒1.2 d |
| ŌĆāŌĆāGR | 56.8┬▒0.9 abc | 68.7┬▒3.1 bc | 34.2┬▒1.4 a | 63.9┬▒3.5 b |
Values are presented as mean┬▒standard deviation.
Different letters within columns indicate significant difference based on Duncan's multiple range test at P=0.05.
LEDs Ļ┤æņ¦ł ļ░Å Ļ┤æņĪ░ņé¼ ļ░®ļ▓ĢņØ┤ ļ®£ļØ╝ļŗī ņāēņåī ļ░Å ĻĘĀņé¼ĒÅŁņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢ź
Fig.┬Ā1
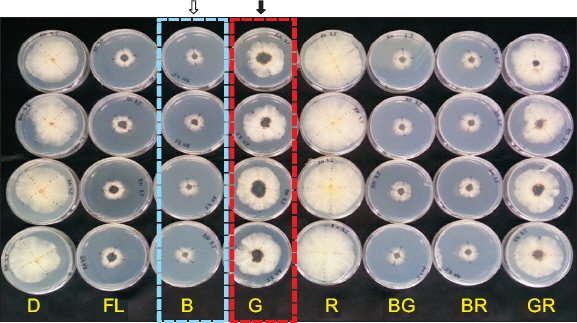
Table┬Ā3
| Treatment* | Lighting type | |
|---|---|---|
|
|
||
| Continuous | Intermittent | |
| ŌĆāŌĆāD | - | - |
| ŌĆāŌĆāFL | ++ | ++ |
| ŌĆāŌĆāB | + | + |
| ŌĆāŌĆāG | +++ | +++ |
| ŌĆāŌĆāR | - | - |
| ŌĆāŌĆāBG | + | + |
| ŌĆāŌĆāBR | + | + |
| ŌĆāŌĆāGR | + | ++ |
Table┬Ā4
| Treatment* | Width of hyphae (╬╝m) | ||
|---|---|---|---|
|
|
|||
| Without swelling | Swelling | With swelling | |
| ŌĆāŌĆāD | 2.8┬▒1.0 a | 5.7┬▒1.4 ab | 3.0┬▒1.0 a |
| ŌĆāŌĆāFL | 2.9┬▒0.6 a | 5.7┬▒1.1 ab | 2.6┬▒0.9 ab |
| ŌĆāŌĆāB | 2.1┬▒0.6 bcd | 4.3┬▒1.1 c | 2.2┬▒1.0 bc |
| ŌĆāŌĆāG | 2.5┬▒0.4 abc | 6.2┬▒1.0 ab | 3.2┬▒1.3 a |
| ŌĆāŌĆāR | 2.0┬▒0.5 cd | 5.5┬▒1.2 ab | 2.1┬▒0.6 bc |
| ŌĆāŌĆāBG | 1.8┬▒0.4 d | 4.5┬▒0.9 c | 1.8┬▒0.3 c |
| ŌĆāŌĆāBR | 2.6┬▒0.5 ab | 4.8┬▒0.6 bc | 1.8┬▒0.4 bc |
| ŌĆāŌĆāGR | 2.2┬▒0.5 bcd | 5.2┬▒0.8 bc | 2.2┬▒0.4 bc |



 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






