서향에서 분리한 신종 포티바이러스(Daphne Mottle Virus)의 동정
Identification of Daphne Mottle Virus Isolated from Daphne odora, a New Member of the Genus Potyvirus
Article information
Abstract
2014년, 국내 4개 지역에서 바이러스와 같은 병징을 보이는 서향 잎에서 신종 potyvirus를 분리하였다. 병징을 보이는 잎에서 추출한 즙액을 DN법(direct negative stain)으로 전자현미경을 이용해 관찰한 결과 사상형 형태의 입자가 관찰되었다. RT-PCR 검출 결과 3점의 시료에서 Cucumber mosaic virus와 potyvirus에 대하여 양성반응을 보였으며, 1점의 시료에서는 potyvirus 양성반응을 보였다. HC-Pro, CI, CP 유전자 일부를 BLAST 분석한 결과 각각 Daphne mosaic virus와 76%, 72%, 72%의 높은 뉴클레오티드 상동성을 보였다. 신종 potyvirus는 국부병반을 나타내는 지표식물(붉은명아주)을 이용하여 분리하였다. 본 논문에서는 서향에서 신종 potyvirus를 동정하였으며, 본 바이러스를 Daphne mottle virus (DapMoV)로 명명하였다.
Trans Abstract
A new poty-like virus was isolated from plants of winter daphne (Daphne odora) that showed virus-like symptoms on leaves, from four regions of Korea during 2014. Filamentous-shaped particles were observed by transmission electron microscopy of preparations extracted from symptomatic leaves and examined by the direct negative stain method. RT-PCR assay showed that three samples were positive for both Cucumber mosaic virus and potyvirus, and only one sample was positive for potyvirus only. A BLAST comparison to partial sequences from helper-component proteinase, cylindrical inclusion and coat protein genes detected the highest nucleotide identity of 76%, 72%, and 72% with Daphne mosaic virus, respectively, levels below the potyvirus species discrimination threshold. The new potyvirus was isolated using indicator plants (Chenopodium amaranticolor), in which local lesions were produced. In this study, we identified a novel potyvirus from winter daphne, which we have named Daphne mottle virus (DapMoV).
서론
팥꽃나무과(Tymelaeaceae)에 속하는 서향(Daphne odora)은 상록활엽관목으로 늦겨울과 이른 봄에 꽃을 피워 그 향기를 천리까지 보낸다고 하여 천리향이라는 이름으로 잘 알려져 있다(Garibaldi 등, 2009; Ro 등, 2009). 원산지가 중국으로 알려진 서향은 내한성이 약하여 제주도를 포함하여 일부 남부 지역에 자생하고 있으며(Liang 등, 2010; Ro 등, 2011), 관상가치가 뛰어나 정원, 길거리 및 아파트 조경용으로 많이 심겨지고 있는 정원수 중 하나이다(Kwon 등, 2005). 또한, 한의학에서 서향의 뿌리와 나무껍질은 관절염, 고열, 피부염 등의 치료를 위한 한방재료로 이용되기도 한다(Chen 등, 2009; Kim 등, 2005). 2009년, 국내에서 재배되는 서향에서 바이러스병 발생조사를 수행한 결과 5종의 바이러스(Cycas necrotic stunt virus [CNSV, Nepovirus], Cucumber mosaic virus [CMV, Cucumovirus], Daphne virus S [DVS, Carlavirus], Daphne virus Y [DVY, Potyvirus]와 Watermelon mosaic virus [WMV, Potyvirus])가 동정되었다(Lee와 Ryu, 2006, 2009). 동정된 5종 바이러스에 대한 진단법 개발, 염기서열 분석, 게놈구조 등의 분자생물학적 연구가 수행되었다(Lee 등, 2003, 2004, 2006). 국내에서 재배되고 있는 서향은 주로 중국과 일본에서 수입되고 있으며, 이와 같은 외래 식물체의 유입은 철저한 식물위생조치가 요구된다. 2014년, 수도권 일대에 위치한 수입식물재배지에서 재배 중이던 중국산 서향묘목과 대구의 가정집에서 관상용으로 기르던 서향에서 전형적인 바이러스 병징을 보이는 식물체를 채집하여 감염된 바이러스를 동정한 결과 신종 Potyvirus가 검출되었다. 본 논문에서는 이 신종 Potyvirus의 형태적, 생물학적 및 분자생물학적 특성에 대하여 기술하였으며, 본 바이러스를 Daphne mottle virus (DapMoV)로 명명하고자 한다.
시료채집
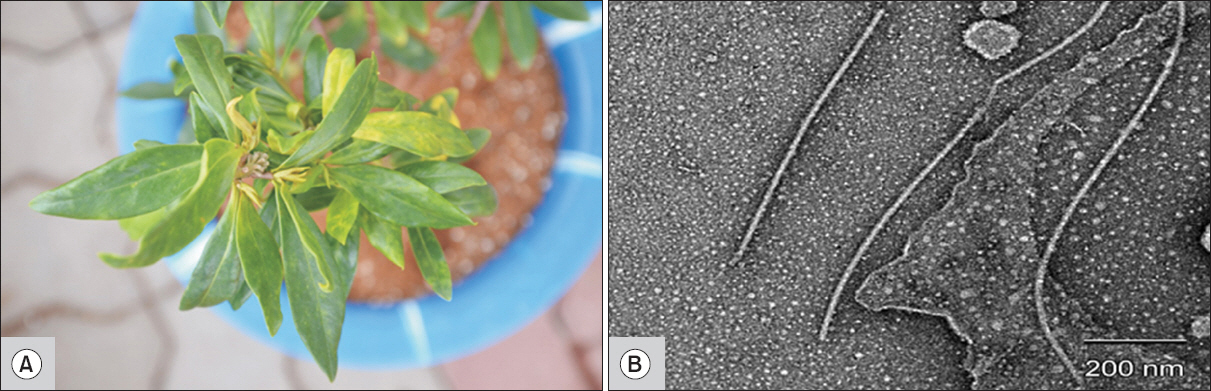
2014년 서울, 수원, 화성에 위치한 수입식물재배지와 대구 소재의 가정집에서 재배되고 있는 서향묘목을 포함하여 전체 4점의 시료를 채집하였다. 바이러스 감염주로 예상되는 서향묘목의 잎은 괴저, 황화, 퇴록, 뒤틀림의 병징을 보였다(Fig. 1A). 수도권 일대에서 채집한 시료 3점은 초저온냉동고(–80°C)에 보관하였고, 대구에서 수집한 시료는 온실에서 유지하면서 추가적인 실험에 이용하였다.
전자현미경 검경
서향에 감염된 바이러스 입자를 관찰하기 위하여 direct negative staining 방법을 이용하였다. 병징을 보이는 잎 50 mg을 절취하여 인산완충용액(phosphate buffer saline, pH 7.4)과 함께 마쇄한 뒤 즙액을 추출하였고, Park 등(2014)의 방법으로 바이러스 입자를 관찰하였다. 채집한 서향 4점의 시료에 대하여 전자현미경 검경을 실시한 결과, 750–780 nm 크기의 사상형 입자가 관찰되었다(Fig. 1B).
전체 RNA 추출 및 PCR 진단
서향에 감염된 바이러스를 동정하기 위하여 TRI Rea춇ent (MRC Inc., Cincinnati, OH, USA)를 이용하여 제공사의 매뉴얼에 따라 전체 RNA를 추출하였다. 전체 RNA는 랜덤프라이머(RN25)와 TOPscript Reverse Transcriptase (GeneAll, Seoul, Korea)를 사용하여 cDNA를 합성하였다. 합성된 cDNA를 PCR 증폭의 주형으로 이용하였으며, 국내 이미 보고된 5종 바이러스(CNSV, CMV, DVS, DVY, WMV)에 대하여 Lee와 Ryu (2009)의 방법으로 진단을 수행하였다. PCR 진단 결과 DVY, WMV, CNSV, DVS 4종에서는 음성반응을 보였다. 반면에 CMV의 경우 수원, 화성, 대구에서 채집한 3점의 시료에서는 양성반응을 보였으며, 서울에서 채집한 1점의 시료에서만 음성반응을 보였다. 양성반응을 보인 3점의 PCR 산물은 정제 후 direct seqeuncing을 통하여 CMV의 염기서열을 확인하여 최종 동정하였다(data not shown). 또한, 전자현미경 검경 결과를 바탕으로 Potyvirus속을 검출할 수 있는 universal primer (Table 1)를 이용하여 PCR을 수행하였다(Ha 등, 2008). 2쌍의 universal primer를 이용하여 PCR을 수행한 결과 전체 4점의 시료에서 680 bp (helper-component proteinase, HC-Pro), 682 bp (cylindrical inclusion, CI) 크기의 DNA 단편을 획득하였다. 추가적으로, 외피단백질(coat protein, CP) 영역을 증폭하기 위하여 NIb2F/NIb3R (350 bp) (Zheng 등, 2008) 프라이머를 이용하여 PCR을 수행하였다. 획득한 염기서열을 이용하여 forward 프라이머(NIb-F0: CTC TAT ACA GAG ATC ATA TAC AC)를 설계하여 oligo-dT anchor primer와 함께 PCR 증폭을 수행하여 최종적으로 CP 영역을 결정하였다.
염기서열 결정 및 유연관계 분석
증폭된 PCR 산물은 Expin Combo GP (GeneAll)를 이용하여 정제하였고, 이를 클로닝하였다. 클로닝은 Lee 등(2010)의 방법을 이용하여 수행하였고, 백색 콜로니 각각 8개를 선발하여 벡터의 T7과 SP6 영역을 증폭하였다. 예상 크기가 일치하는 콜로니는 배양 후 플라스미드 DNA 추출 후 EcoRI 제한효소로 절단한 후 전기영동하여 확인하였고, 솔젠트(Solgent, Daejeon, Korea)에 염기서열 분석을 의뢰하였다. 최종 결정된 염기서열은 National Center for Biotechnology Information (NCBI) BLAST를 통하여 이미 보고된 바이러스와의 상동성을 확인하였고, 이미 보고된 Potyvirus 23종을 이용하여 유연관계 분석을 Nam 등(2012)의 방법에 따라서 수행하였다. 획득한 염기서열을 NCBI GenBank nucleotide BLAST를 수행한 결과 HC-Pro 단편 염기서열은 Daphne mosaic virus (DapMV)와 76% (query cover: 97%; accession No.: DQ299908) 가장 높은 상동성을 보였다. CI 영역의 경우 DapMV와 72% (query cover: 89%; accession No.: DQ299908) 상동성을 보였다. 신종 potyvirus 여부를 결정하기 위하여 CP 영역에 대한 BLAST를 수행한 결과 뉴클레오타이드 72% (query cover: 91%; accession No.: DQ299908), 아미노산 74% (query cover: 99%; accession No.: YP611120) 상동성을 보였다. 23종의 Potyvirus들과 염기서열 유연관계를 분석한 결과, HC-Pro, CI 그리고 CP 유전자에서는 DapMV와 가장 유사함을 나타냈다(Fig. 2). 따라서, 천리향으로부터 검출된 본 바이러스는 이미 보고된 종들과 80% 미만의 상동성을 보였고, CP 영역의 아미노산의 경우 80% 미만의 상동성을 보였으므로, International Committee on Taxonomy of Viruses (ICTV)의 국제적 기준에 부합하여 Potyvirus속의 신종으로 동정하였다.

Maximum likelihood tree based on partial nucleotide sequences of cylindrical inclusion (CI; A), helper-component proteinase (HC-Pro; B), and coat protein (CP; C) region of closely related potyviruses. Phylogenetic tree generated using by DNAMAN software ver. 7.0 and bootstrap values applied from 1,000 replicates. Virus names and National Center for Biotechnology Information GenBank accession numbers were used in these analysis: BCMNV (Bean common mosaic necrosis virus, NC004047), BCMV (Bean common mosaic virus, NC003397), BruMV (Brugmansia mosaic virus, NC020105), BtMV (Beet mosaic virus, NC005304), BYMV (Bean yellow mosaic virus, NC003492), CABMV (Cowpea aphid-borne mosaic virus, NC004013), CeMV (Celery mosaic virus, NC015393), ClYVV (Clover yellow vein virus, NC003536), DapMV (Daphne mosaic virus, NC008028), JYMV (Japanese yam mosaic virus, NC000947), LMV (Lettuce mosaic virus, NC003605), MDMV (Maize dwarf mosaic virus, NC003377), NYSV (Narcissus yellow stripe virus, NC011541), PanVY (Panax virus Y, NC014252), PepMoV (Pepper mottle virus, NC001517), PeSMV (Pepper severe mosaic virus, NC008393), PPV (Plum pox virus, NC001445), PVY (Potato virus Y, NC001616), SCMV (Sugarcane mosaic virus, NC003398), SMV (Soybean mosaic virus, NC002634), TuMV (Turnip mosaic virus, NC002509), YMMV (Yam mild mosaic virus, NC019412), YMV (Yam mosaic virus, NC004752).
바이러스 분리
서향에 감염된 바이러스(가칭 Daphne mottle virus)를 분리하기 위하여 명아주과(Chenopodiaceae)를 포함하여 콩과(Leguminosae), 가지과(Solanaceae) 속의 지표식물 10종(Chenopodium amaranticolor, C. quinoa, Physalis floridana, Nicotiana debney, N. turkish, N. tabaccum cv. KY57, N. tabaccum cv. Samsun, N. tabaccum cv. Xanthi, Vigna sinensis, Glycine max cv. Wiliams 82)을 이용하여 즙액 접종하였다. 병징을 보이는 서향의 잎을 0.1 M 인산완충용액과 함께 마쇄하여 즙액을 추출하였고, Silicon carbide (Sigma-Aldrich, St Louis, MO, USA)를 이용하여 지표식물에 접종하였다. 명아주과의 C. amaratnicolor에서는 국부병반을 형성하였고, C. quinoa의 접종엽에서 퇴록반점을 보였다(Fig. 3). 이외에 나머지 8종의 지표식물에서는 병징이 발현되지 않았다. 국부병반을 보이는 C. amaranticolor는 순수분리하기 위하여 단병반을 분리를 3회 수행하였고, 최종적으로 분리된 병반은 C. quinoa에 접종하여 증식하였으며, RT-PCR과 direct sequencing을 수행한 후 접종원과 염기서열이 일치하는 것을 확인하였다(자료 미제출). Potyvirus의 경우 진딧물에 의해서 쉽게 전파되는 것으로 알려져 있으나(Gibbs 등, 2008), 외래 식물체에서 동정된 Daphne mottle virus에 대한 전염방법, 생물학적 특성 조사 등을 통하여 국내 농작물에 미칠 위험성에 대한 연구가 추가적으로 필요할 것으로 생각된다.
Acknowledgement
This research was supported by a grant from the Animal and Plant Quarantine Agency (QIA), Ministry of Agriculture, Republic of Korea (Project Code No. Z-1542051-2013-15-01).