식물근권세균을 처리한 감귤 잎에서 주사전자현미경을 통한 감귤 더뎅이병균의 생장 억제 관찰
Observation of Growth Inhibition of Elsinoe fawcettii on Satsuma Mandarin Leaves Pre-treated with Rhizobacterial Strains by a Scanning Electron Microscope
Article information
Abstract
감귤 더뎅이병을 일으키는 E. fawcettii에 항균효과가 있는 식물근권세균 B. gladioli MRL408-3, TRH423-3, P. fluorescens THJ609-3, TRH415-2에 의해 감귤 더뎅이병이 감소하였다. 이들 식물근권세균을 전 처리한 Satsuma mandarin 감귤 잎에 감귤 더뎅이병균을 접종한 후 주사전자현미경을 이용하여 관찰하였다. 식물근권세균을 전 처리한 잎에서 무처리한 잎에 비해 감귤 더뎅이병의 병반수가 감소되었다. 특히 B. gladioli MRL408-3 균주를 전 처리한 식물에서 감귤 더뎅이병의 병반수가 뚜렷하게 억제되었다. 주사전자현미경을 통해 관찰 결과 식물근권세균을 전 처리한 감귤 잎 표면에서 병원균의 발아율과 발아관의 길이가 감소되는 것을 확인하였다. 시판 농약인 imibenconazole을 처리한 잎에서 감귤 더뎅이병균의 성장이 가장 뚜렷하게 억제되었는데, 이는 병반수가 가장 적게 형성된 것과 상통한다. 이들 결과를 통하여 식물근권세균에 의해 감귤 잎 표면에서 감귤 더뎅이병균의 발아와 생장이 억제되고 그 결과 감귤 더뎅이병의 발생이 감소되는 것으로 판단된다.
Trans Abstract
Elsinoe fawcettii causing citrus scab was suppressed by rhizobacterial strains such as Burkholderia gladioli MRL408-3, TRH423-3 and Pseudomonas fluorescens THJ609-3, TRH415-2 having antifungal activity. The leaf surface of Satsuma mandarin, which was pre-treated with the rhizobacterial strains, was observed by a scanning electron microscope (SEM) after inoculation with E. fawcettii. The number of lesions was reduced on the leaves pre-treated with the rhizobacterial strains compared to those of untreated leaves. Especially, the lesions numbers was apparently reduced on the leaves pre-treated with B. gladioli MRL408-3. The observation by SEM revealed that not only the germination rate but also the length of germ tube of the pathogen were decreased on the rhizobacterial strains pre-treated leaves. These inhibition of the fungal growth was more strongly expressed on the leaves pre-treated with commercial fungicide imibenconazole, by which the lesions was rarely found on the leaves. Based on these results, it was suggested that rhizobacterial strains may inhibit the germination and growth of the E. fawcettii on the surface of citrus leaves, resulting in decrease of disease severity.
서론
제주 감귤포장에서 주로 재배되는 온주밀감에 발병하는 감귤 더뎅이병은 Elsinoe fawcettii에 의해 발생되는 병으로 주로 5–6월에 발생하기 시작하여 강우량이 많을 때 병 발생이 급증한다. E. fawcettii는 감귤나무의 잎, 가지, 과실을 감염시켜 시장에 판매되는 과실의 가치를 떨어뜨리고 농가의 수입을 감소시킬 수 있는 중요한 병해이다(Hyun 등, 2001; Timmer 등, 1996). 감귤 더뎅이병 방제는 imibenconazole과 트리프록시스토로빈 액상수화제 등과 같은 농약을 사용한 화학적 수단이 주로 이용되고 있다. 그러나 무분별한 농약 사용은 농약 잔류성, 환경오염, 병해충 저항성 및 인축의 독성 등의 문제를 야기할 수 있는 위험을 가지고 있다(Weller, 1988).
최근 친환경 농산품에 대한 수요자들의 수요가 높아지면서 무농약 재배과원을 포함한 친환경재배 과원의 수가 증가하고 있다. 농약을 거의 사용하지 않는 친환경 감귤과원에서는 감귤 더뎅이병이 빈번하게 발생하는데, 특히 전년도에 발생한 포장에는 감염된 가지나 잎에 감귤 더뎅이병균이 남아 있어 다음 해에 전염원으로서 역할을 할 수 있으며, 병 발생에 좋은 조건이 만족될 시에는 대발생의 원인이 될 수도 있다(David, 1988; Hyun 등, 2001).
감귤 병 방제수단으로 식물근권세균 중 Burkholderia gladioli와 Pseudomonas fluorescens에 의해 감귤 검은점무늬병이 유의적으로 억제되는 것을 실내실험을 통해 확인되었다(Ko 등, 2012). 또한 이들 식물근권세균이 포장에서 감귤 궤양병의 발생을 억제시키는 것으로 조사되어 농약사용이 제한된 친환경 농가에서는 식물근권세균을 통해 병 방제 수단으로 이용할 수 있는 가능성을 보여주고 있다(Yang 등, 2014).
그 외에도 식물근권세균의 항진균 활동에 의한 생물학적 방제에 대한 많은 연구들이 이루어져 있다. 예를 들면, Burkholderia subtilis KB-401은 오이 흰가루병에 대한 방제 효과가 보고되었다(Nam 등, 2010). 또한 참다래 꽃썩음병은 식물근권세균인 Streptomyces sp.의 항균작용이 73%로 확인되어 뛰어난 생물적 방제효과가 보고 되었다(Cho 등, 2007). 최근 이러한 식물병 억제 효과가 검증된 식물근권세균은 농업용 상품으로 Paenibacillus polymyxa 등 2종을 이용하여 실용화시킨 큐펙트®, 탑시드® (Greenbiotech, Paju, Korea)가 이미 시판되고 있다(Kim 등, 2012; Kloepper 등, 2004).
식물근권세균이 식물병을 억제하기 위해 뿌리표면에서 빠르게 증식하여 병원체와 경쟁을 하거나 병원체에 기생함으로써 생물학적 방제요인으로 작용하기도 한다(Rangarajan 등, 2003). 이러한 작용의 예로써 P. fluorescens WCS365는 Fusarium oxysporum f. sp. radicis‐lycopersici (Forl)에서 분비되는 푸사리산에 의해 유도되어(de Weert 등, 2004) 병원체의 균사에 증식함으로써 Forl의 병원성을 저하시켜 토마토 뿌리썩음병을 억제한다(Bolwerk 등, 2003). 또한 Forl에 감염된 뿌리에서 P. fluorescens WCS365가 병원체의 균사주변에 부착하여 증식된 모습이 주사전자현미경(scanning electron microscope)으로 관찰되었다(Kamilova 등, 2008). 결과적으로 P. fluorescens WCS365는 Forl의 활성과 생존 그리고 발아를 억제시키고 균사에 증식하여 새로운 포자형성을 방지하여 병원체의 확산을 억제시킨다(Validov 등, 2009).
식물근권세균에 의한 식물병이 억제되는 현상을 보다 정확하게 해석하기 위해서는 생화학적인 분석뿐 아니라 조직학적인 분석도 필요하다. 선행 연구에서는 식물근권세균을 전 처리한 후 감귤 더뎅이병균을 접종한 감귤 잎에서 감귤 더뎅이병균의 포자수와 발아율이 무처리한 잎보다 감소된다는 것을 형광현미경을 이용하여 확인하였다(Kim 등, 2011). 따라서 본 연구에서는 식물근권세균이 감귤 더뎅이병균의 생장에 어떠한 영향을 미치는지 보다 자세하게 알아보기 위해 주사전자현미경을 이용하여 관찰하였다. 이를 통해 식물근권세균을 전 처리한 감귤 잎에서 감귤 더뎅이병균의 발아율, 발아관 생장 억제 여부 및 식물근권세균과 감귤 더뎅이병균 사이의 상호작용 여부 등을 관찰하였다.
재료 및 방법
감귤 식물체
본 실험에서는 탱자에 접목한 2년생 감귤 묘목(품종: 궁천)을 일반 토양과 상토(뚝심이)를 2:1의 비율로 섞은 토양의 화분(직경 30 cm)에 옮겨 심은 후 주간 25°C±1°C, 야간 18°C±1°C가 유지되는 식물 배양실에서 배양하였다. 실험에는 최소한 4개 이상의 신초를 포함하고 있는 가지를 살균된 가위로 자른 후 자른 부위를 0.5%의 sodium hypochlorite solution으로 5초 동안 표면살균한 후 멸균수로 세척하여 멸균수가 담긴 삼각플라스크에 꽂아 실험 대상 식물로 사용하였다.
접종원
감귤 더뎅이병의 접종원으로 사용된 E. fawcettii는 제주도 서귀포시에 위치한 감귤 시험포장에서 더뎅이병 병징이 보이는 온주밀감의 잎에서 분리하였다(Kim 등, 2011). 분리된 감귤 더뎅이병균을 potato dextrose agar (PDA) 배지에 접종하여 배양기(DA-MIL-2500; DONG-A, Siheung, Korea)에 옮겨 25°C에서 20일간 배양한 후 균총을 배지에서부터 떼어 멸균된 spatula를 이용하여 잘게 분쇄하였다. 감귤 더뎅이병균의 포자를 수거하기 위해서 Frise medium (ammoniumtartrate 5 g, ammonium nitrate 1 g, potassium phosphate dibasic 1 g, ammonium sulfate 0.5 g, calcium chloride 0.1 g, sodium chloride 0.1 g, sucrose 20 g in 멸균수 1 l) 30 ml에 분쇄된 감귤 더뎅이병균 1 g을 넣은 후 shaking incubator (HB-201SL; HANBAEK Scientific Co., Bucheon, Korea)로 옮겨 70 rpm으로 27°C에서 48시간 배양하였다. 그 후 원심분리기(mega17R; HANIL, Seoul, Korea)를 이용하여 4°C에서 10,000 rpm으로 90초 동안 원심분리하여 상층액인 Frise medium을 제거하고 멸균수를 30 ml 채워서 세차게 섞어준 후 앞선 방법과 동일하게 원심분리하여 상층액을 제거하고 멸균수로 3회 세척하였다. 포자를 새롭게 생성할 수 있는 감귤 더뎅이병균에 멸균수를 30 ml 넣어 shaking incubator에 옮겨 70 rpm으로 27°C에서 24시간 동안 배양한 후 감귤 더뎅이병균의 농도를 4.0×106 conidia/ml가 되도록 조정하여 접종원으로 사용하였다.
식물근권세균
감귤 더뎅이병에 대한 전신적 저항성을 유도하거나 항균 효과가 입증된 4개 균주 B. gladioli MRL408-3, TRH423-3과 P. fluorescens THJ609-3, TRH415-2 (Kim 등, 2011)를 본 실험에 사용하였다. 식물근권세균들을 각각 tryptic soy agar (TSA; Becton, Dickinson and Company, Grenoble, France) 배지에 접종한 후 배양기에 옮겨 28°C에서 48시간 동안 배양하였다. 그 후 식물근권세균이 배양된 배지에 멸균수 10 ml를 넣고 루프를 이용하여 현탁액을 만든 후 UV/visspectrophotometer (Optizen POP; Mecasys, Daejeon, Korea)를 이용하여 2.0×107 cfu/ml의 농도로 조절하여 본 실험에 사용하였다.
감귤식물체에 식물근권세균 전 처리
선발된 식물근권세균에 의한 감귤 더뎅이병 억제효과를 알아보기 위해 식물근권세균 현탁액에 0.01% tween 20을 첨가한 후 삼각플라스크에 담겨 있는 감귤가지의 잎에 접종스프레이를 이용하여 감귤 잎 표면에 이슬이 맺힐 정도로 살포하였다. 식물근권세균에 의한 감귤 더뎅이병 억제효과를 비교하기 위하여 시판 중인 살균제인 imibenconazole 수화제(확시란®; DongbangAgro, Seoul, Korea)를 관행농도인 0.5 g/l로 살포하였다. 또한 무처리 비교구로 식물근권세균 현탁액 대신 멸균수를 처리한 감귤을 사용하였다. 예비 실험 결과 감귤 더뎅이병 발생 정도가 식물에 따라 매우 차이가 났으므로 한 식물에 무처리, 식물근권세균, 농약을 모두 처리함으로써 추후에 병원균을 접종하였을 때 발생하는 식물에 따른 병 발생 정도 차이가 나는 것을 피하였다. 전 처리한 감귤 잎은 6시간 동안 상온에서 자연건조 시켰다.
감귤식물체에 감귤 더뎅이병균 접종
감귤 더뎅이병균 현탁액에 0.01% tween 20을 첨가하여 무처리, 4가지 식물근권세균 또는 imibenconazole 수화제를 전 처리한 감귤 잎에 접종스프레이를 이용하여 이슬이 맺힐 정도로 살포하였다. 접종한 감귤 잎은 상대습도 99% 유지되는 dew chamber (DA-DC; DONG-A)로 옮겨 28°C에서 24시간 동안 보관한 후, 낮에는 25°C±1°C, 밤에는 18°C±1°C이고, 습도 70%−80%가 유지되는 식물배양실에 옮긴 후 14일 동안 감귤 잎에 형성되는 병반의 진행 과정을 관찰하였다. 시간적으로 분리된 실험을 총 3회 시행하였으며, 각각 실험마다 3개의 반복된 식물을 사용하였다. 병 발생 정도는 감귤 더뎅이병균을 접종 14일 후에 감염된 병반 수를 계수하여 ‘전체 병반수/조사엽수’로 측정하였다.
감염 식물의 주사전자현미경 관찰
식물근권세균에 의한 감귤 더뎅이병의 감염 억제 양상을 알아보기 위하여 식물근권세균을 전 처리한 후 감귤 더뎅이병균을 접종한 잎을 접종 1일, 3일, 5일 후에 채취하여 Hayat (1989)가 제시한 식물 전처리 방법에 따라 시행하였다.
채취한 잎을 면도날로 0.4×0.6 mm2의 크기로 잘라 2% glutaraldehyde를 포함한 0.05 M phosphate buffer solution (PBS; pH 7.2)에 담아 실온에서 2시간 동안 고정한 후 PBS로 10분 동안 3회 세척하였다. 그 후 2% osmium tetroxide로 4°C에서 2시간 동안 2차 고정한 후 멸균된 3차 증류수로 3회 세척하였다. 세척된 시료들은 ethanol 시리즈(각각 15분 동안 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 2회, 100% 3회)를 통해 탈수를 하였고 acetic acid로(각각 10분 동안 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 2회, 100% 2회) 치환하였다.
각 시료들은 critical point drier (CPD 030; BAL-Tec, Los Angeles, CA, USA)를 사용하여 임계점에서 건조시킨 후 스토브(직경 25 cm) 위에 치상하여 osmium plasma coater (OPC80T; FILGEN, Osaka, Japan)로 시료 표면을 금으로 코팅(~100 Å)하였다. 코팅한 후 주사전자현미경(JSM-6700F; JEOL Ltd., Tokyo, Japan)을 통해 20 kV에서 처리구 당 4개의 시료를 관찰하였고 주로 감귤 더뎅이병균의 수, 발아 여부, 발아관의 길이 또한 식물근권세균의 수와 감귤 더뎅이병균과의 접촉 여부 등을 관찰하였다.
통계분석
무처리, 식물근권세균 및 imibenconazole을 전 처리한 잎에서 감귤 더뎅이병균 접종 후 관찰된 식물의 병반수, 감귤 더뎅이병균의 발아된 포자 수, 발아관 길이 등의 분산분석과 처리평균 사이의 비교를 위하여 Duncan’s 검정을 SAS Institute ver. 8.02 (SAS Institute, Cary, NC, USA)를 이용하여 분석하였다.
결과 및 고찰
식물근권세균에 의해 감귤 더뎅이병이 억제되었으며 본 연구 결과는 감귤 더뎅이병에 대한 식물근권세균 억제 효과를 보고한 Kim 등(2011)에 의한 연구와 동일하였다. 감귤 잎에 멸균수를 전 처리한 무처리구에서는 감귤 더뎅이병 병반을 접종 후 5일째부터 육안으로 확인할 수 있었다. 접종 10일째부터는 병반부가 진해졌으며 감귤 더뎅이병의 전형적인 돌기가 형성되었으며 많은 수의 병반이 형성되었다(Fig. 1A, 2).

Satsuma mandarin leaves untreated (A), pre-treated with rhizobacterial strains Burkholderia gladioli MRL408-3 (B), TRH423-3 (C), Pseudomonas fluorescens THJ609-3 (D), TRH415-2 (E), and commercial fungicide imibenconazole (F) at 14 days after fungal inoculation with Elsinoe fawcettii. The concentration of the pathogen, the rhizobacteria and the fungicide were 4.0×106 conidia/ml, 2.0×107 cfu/ml and 0.5 g/l, respectively.

Number of lesions on Satsuma mandarin leaves untreated, pre-inoculated with the rhizobacterial strains Burkholderia gladioli MRL408-3, TRH423-3, Pseudomonas fluorescens THJ609-3, TRH415-2 and commercial fungicide imibenconazole at 14 days after inoculation with Elsinoe fawcettii. The concentration of the pathogen, the rhizobacteria and the fungicide were 4.0×106 conidia/ml, 2.0×107 cfu/ml and 0.5 g/l, respectively. Different letters indicate significant differences (P<0.05) according to Duncan’s multiple range test.
식물근권세균 B. gladioli와 P. fluorescens를 전 처리한 감귤 잎에서의 병반 형성은 무처리에 비해 늦게 발생했으며, 병반수도 적게 형성되었다(Fig. 1B–E 2). 특히 B. gladioli MRL408-3 균주를 전 처리한 식물에서 병반 형성이 뚜렷하게 억제되었다. 시판농약인 imibenconazole을 전 처리한 감귤 잎에서 식물근권세균을 전 처리한 잎보다 병 억제가 휠씬 뚜렷하게 나타나서 병징이 거의 나타나지 않았으며 병반수도 매우 적었다(Fig. 1F, 2). 이러한 연구 결과는 감귤더뎅이병에 대한 식물근권세균 억제 효과를 보고한 Kim 등(2011)에 의한 연구와 동일하였다. 본 실험에서뿐 아니라 B. gladioli는 Colletotrichum orbiculare에 의해 발생하는 오이탄저병과 모에 발생하는 Pythium ultimum에 의한 모잘록병에도 방제효과가 있었다고 보고되었다(Bae 등, 2007; Raupach와 Kloepper, 1998). 또한 P. fluorescens에 의해 땅콩 줄기썩음병과 마늘 흑색썩음병이 억제되었다고 보고되었다(Kang과 Jeun, 2012; Manjula 등, 2004).
또한 선행연구(Kim 등, 2011)에서 식물근권세균을 전 처리하고 감귤 더뎅이병균을 접종한 감귤 잎을 형광현미경으로 관찰하였을 때 무처리구에 비해 식물근권세균을 전 처리한 감귤 잎에서 감귤 더뎅이병균의 포자수가 약 60% 정도 감소하였으며, 발아율은 약 50% 정도 감소하였다. 뿐만 아니라 식물의 괴사율은 현저히 억제되는 것을 확인할 수 있었다. 본 실험에서도 식물근권세균 B. gladioli와 P. fluorescens가 감귤 더뎅이병균의 성장을 억제하는 것을 주사전자현미경을 통해 관찰할 수 있었다.
멸균수를 전 처리한 무처리구에서 접종 후 1일째 감귤 잎의 표면을 주사전자현미경으로 관찰하였을 때 감귤 더뎅이병균의 포자가 발아하기 시작하였으며, 식물근권세균을 전 처리한 감귤 잎에서는 무처리구와 감귤 더뎅이병균 발아관 형성의 차이는 나타나지 않았다(결과 미제시).
그러나 접종 3일 후 모든 식물근권세균을 전 처리한 감귤 잎 표면에서 감귤 더뎅이병균의 발아율이 무처리구와 비교하여 감소하는 경향이 나타났다(Fig. 3, 4). 발아율 억제 정도에 있어서 접종 후 시간이 경과됨에 따라 또한 전 처리한 식물근권세균의 균주에 따라 약간의 차이가 나타났다(Fig. 4, 5). 한편 Kim 등(2011)의 형광현미경을 통한 관찰 결과에서도 감귤 더뎅이병균의 발아율이 무처리에 비해 약 2배 정도 억제되어 유의성 있는 결과를 나타냈으며 이는 주사전자현미경으로 관찰한 본 연구 결과와 유사하였다. 예상한 바와 같이 imibenconazole을 전 처리한 잎에서 감귤 더뎅이병균의 발아율이 가장 억제되었으며 이는 형성된 감귤 더뎅이병 병반수가 가장 감소한 것과 동일한 경향을 나타냈다(Fig. 2–4).
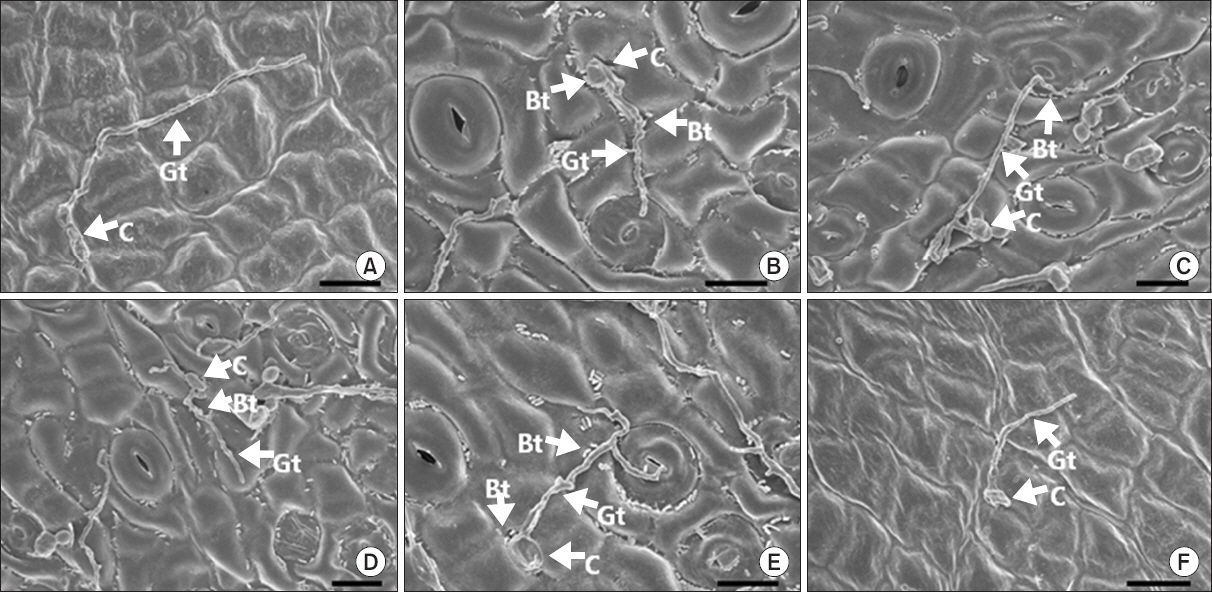
Photographs of scanning electron microscopic images on Satsuma mandarin leaves untreated (A), pre-treated with the rhizobacterial strains Burkholderia gladioli MRL408-3 (B), TRH423-3 (C), Pseudomonas fluorescens THJ609-3 (D), TRH415-2 (E), and commercial fungicide imibenconazole (F) at 3 days after inoculation with Elsinoe fawcettii. The concentration of the pathogen, the rhizobacteria and the fungicide were 4.0×106 conidia/ml, 2.0×107 cfu/ml and 0.5 g/l, respectively. C, conidium; Gt, germ tube; Bt, bacterial cell. Scale bars=10 μm.

Rate of germination of Elsinoe fawcettii on Satsuma mandarin leaves untreated, pre-inoculated with the rhizobacterial strains Burkholderia gladioli MRL408-3, TRH423-3, Pseudomonas fluorescens THJ609-3, TRH415-2, and commercial fungicide imibenconazole at 3 days (A) or 5 days (B) after inoculation with Elsinoe fawcettii. The concentration of the pathogen, the rhizobacteria and the fungicide were 4.0×106 conidia/ml, 2.0×107 cfu/ml and 0.5 g/l, respectively. Different letters indicate significant differences (P<0.05) according to Duncan’s multiple range test.
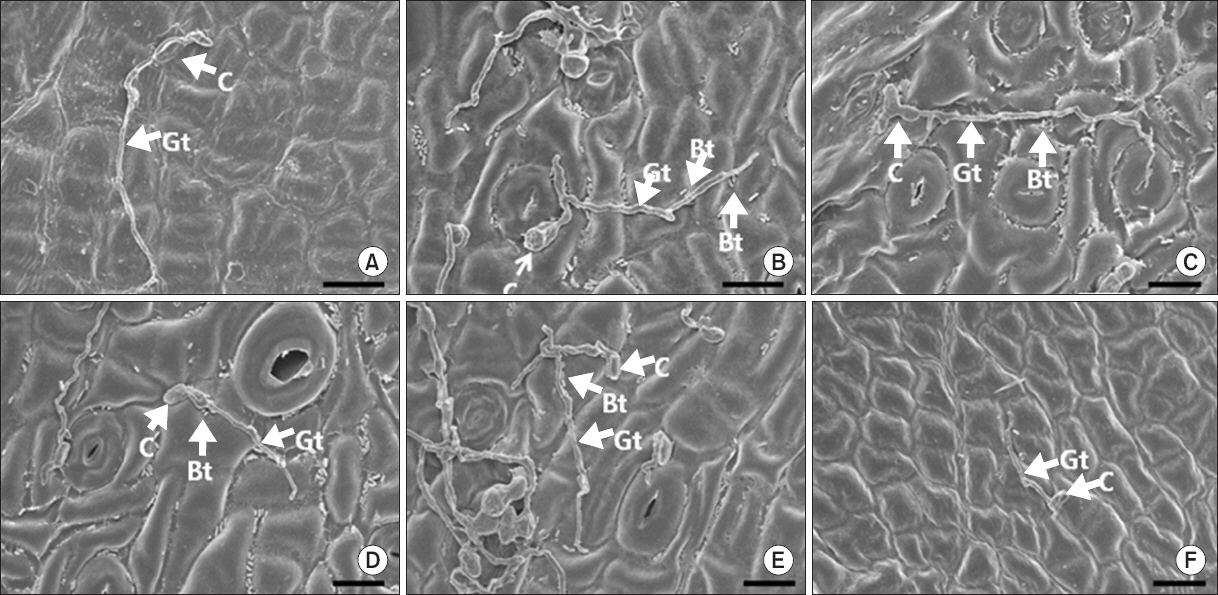
Photographs of scanning electron microscopic images on Satsuma mandarin leaves untreated (A), pre-treated with the rhizobacterial strains Burkholderia gladioli MRL408-3 (B), TRH423-3 (C), Pseudomonas fluorescens THJ609-3 (D), TRH415-2 (E), and commercial fungicide imibenconazole (F) at 5 days after inoculation with Elsinoe fawcettii. The concentration of the pathogen, the rhizobacteria and the fungicide were 4.0×106 conidia/ml, 2.0×107 cfu/ml and 0.5 g/l, respectively. C, conidium; Gt, germ tube; Bt, bacterial cell. Scale bars=10 μm.
이와 비슷한 연구결과로는 P. fluorescens THJ609-3을 전 처리한 감귤 잎에서 감귤 검은점무늬병균의 발아율이 상당히 감소하였고 감귤 잎에서의 병반수 역시 억제되었다고 보고되었다(Ko 등, 2012). 또한 친환경농가에서 사용할 수 있는 생물농약인 Serenade® (AgraQuest Inc., Davis, CA, USA)는 유채에서 Plasmodiophora brassicae의 휴면포자의 생존력과 발아를 감소시켜 유채의 뿌리혹병을 억제할 수 있다고 보고하였다(Lahlali 등, 2011).
감귤 더뎅이병균의 발아관 생장은 접종 후 3일째 B. gladioli TRH423-3을 전 처리한 감귤 잎의 경우를 제외한 모든 처리구에서 무처리구에 비해 유의성 있게 억제되었다(Fig. 3, 6). 또한 접종 후 5일째에는 모든 식물근권세균을 전 처리한 감귤 잎에서 발아관의 생장이 뚜렷하게 억제되었다(Fig. 3, 6). 이와 같은 결과는 식물근권세균을 전 처리한 감귤 잎에서 감귤 더뎅이병의 병반수가 멸균수를 전 처리한 감귤 잎에서의 병반수보다 적게 나타난 것과 동일한 경향으로 조사되었다(Fig. 2, 3, 6). 이들 결과를 통하여 식물근권세균에 의해 감귤 더뎅이병균의 발아관의 생장이 억제됨으로써 병반수 감소가 이루어진 것으로 추측할 수 있다. 실제로 imibenconazole을 전 처리한 잎에서 감귤 더뎅이병균의 발아관 길이가 가장 억제되었으며 감귤 잎에서의 감귤 더뎅이병균에 의한 병반수도 가장 적게 형성되었다(Fig. 2, 5, 6).
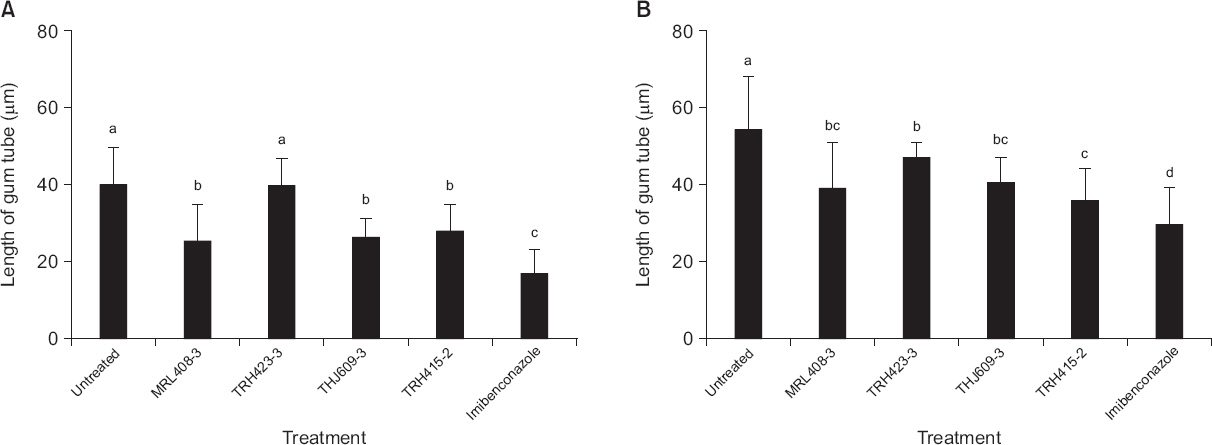
Length of gum tube of Elsinoe fawcettii on Satsuma mandarin leaves untreated, pre-inoculated with the rhizobacterial strains Burkholderia gladioli MRL408-3, TRH423-3, Pseudomonas fluorescens THJ609-3, TRH415-2, and commercial fungicide imibenconazole at 3 days (A) or 5 days (B) after inoculation with Elsinoe fawcettii. The concentration of the pathogen, the rhizobacteria and the fungicide were 4.0×106 conidia/ml, 2.0×107 cfu/ml and 0.5 g/l, respectively. Different letters indicate significant differences (P<0.05) according to Duncan’s multiple range test.
병원균의 발아관 생장을 억제함으로써 병 발생을 억제시킨다는 연구는 많이 보고되었다. 예를 들면, 복숭아의 흑곰팡이병을 일으키는 Rhizopus stolonifer에 효과가 있는 효모현탁액에 CaCl2를 첨가했을 때 포자발아와 발아관 생장을 억제시켜 과실에서의 병 진전을 억제한다는 결과가 보고되었으며, Ca가 포자발아와 발아관 생장을 억제시킴으로써 진균의 침입을 감소시킬 것이라고 보고되었다(Tian 등, 2002; Wisiniewski 등, 1995). 또한 Trichoderma harzianum의 단백질분해효소는 Bortrytis cinerea의 생물학적 방제 역할을 하는 것으로 알려져 있다. T. harzianum과 단백질분해효소가 포함된 배지에서 B. cinerea의 발아와 발아관의 길이가 감소된 것을 확인하였으며 T. harzianum이 합성한 단백질분해효소를 포함하는 배양액을 B. cinerea가 감염된 콩잎에 처리하였을 때 단백질분해효소의 합성이 증가했을 뿐만 아니라 발병도도 유의적으로 감소했다고 보고되었다(Elad와 Kapat, 1999).
감귤 식물체에서 식물근권세균이 정확하게 어떠한 방법에 의해 병원균의 생장을 억제시키는지는 알려져 있지 않다. 다만 식물근권세균이 직접적인 항생물질을 분비하든가 siderophore를 형성함으로써 금속이온의 영양적 경합을 통하여 병원균의 성장을 억제한다고 보고되어 있다(Beneduzi 등, 2012). 실제로 직접적인 항균효과를 가진 미생물에서 분비되는 물질로는 Pseudomonas속에서 분비하는2–4 diacetyphloroglucinol, pyoluteorin, pyrrolnitrin 등이 있다(Raaijmakers 등, 1997). 이 외에도 인삼에 뿌리썩음병을 일으키는 Fusarium cf. incarnatum는 Bacillus amyloliquefaciens subsp. plantarum에 의해 PDA 배지상에서 상당히 저지되었는데(Song 등, 2014) 이는 B. amyloliquefaciens subsp. plantarum의 대사산물에서 나타난 독성화합물이 F. cf. incarnatum의 생장을 억제하는 요인이며 그것은 즉각적인 병 억제효과를 보이는 중요한 역할을 한다고 보고되었다(Kim 등, 2009). 또한 근권세균인 Burkholderia cepacia의 경우 근군 내 밀도와 식물병의 발생 억제와 상관관계가 있다고 보고되었으나 일반적으로 길항미생물의 농도는 높을수록 식물병 억제 정도가 높다기보다는 어떠한 특정한 농도에서 병 진전이 최소가 된다고 알려져 있다(Park, 2000).
따라서 본 실험에서 사용한 식물근권세균을 감귤 잎에 전 처리하였을 때 감귤 더뎅이병이 억제되는 것은 식물근권세균이 감귤 더뎅이병균의 발아율과 발아관 생장을 억제시켰기 때문이라고 생각된다. 그러나 어떠한 작용에 의해 발아율과 발아관 생장을 억제시키는지는 아직까지 밝혀지지 않아서 앞으로 이 분야에 대한 더 많은 연구가 요구된다.
Acknowledgement
This research was supported by Golden Seed Project (Center for Horticultural Seed Development, No. 213003-04-3-WTS21), Ministry of Agriculture, Food and Rural Affairs (MAFRA), Ministry of Oceans and Fisheries (MOF), Rural Development Administration (RDA) and Korea Forest Service (KFS).