RT-PCR과 다공성 세라믹 큐브를 이용한 벼줄무늬잎마름바이러스 간편 진단
Simple and Rapid Detection for Rice stripe virus Using RT-PCR and Porous Ceramic Cubes
Article information
Abstract
다공성 세라믹 큐브를 이용한 RT-PCR 진단법은 별도의 핵산 추출 과정이나 용액 처리 없이, 식물체에 접촉시켜 큐브의 공극에 바이러스 입자나 핵산 등의 분자가 신속하게 흡수되면 이를 바로 RT-PCR 반응에 넣어 유전자를 증폭시키는 방법으로, 식물체로부터 빠르고 정확하게 바이러스를 진단하는 방법이다. 본 연구에서는 다공성 세라믹 큐브를 이용하여 벼에 발생하는 주요 바이러스인 벼줄무늬잎마름바이러스(RSV)를 진단하는 RTPCR 진단법을 확립하였다. 벼의 잎, 잎집, 또는 줄기를 대상으로 큐브 1개 또는 3개를 사용하여 즙액을 흡수시킨 후, 이를 RTPCR 주형으로 사용하였고, 그 결과 변성처리에 큰 차이 없이 증폭 효율이 나타났다. 또한 즙액을 흡수한 큐브는 9주차까지 상온에서 보관한 후 RT-PCR을 실시하여도 안정적으로 증폭 효율을 나타내었다.
Trans Abstract
A rapid and simple RT-PCR diagnosis method for detection of Rice stripe virus (RSV), one of major virus infecting rice, was developed using porous ceramic cubes in this study. The porous ceramic cube can rapidly absorb biological molecules such as small-sized proteins and nucleic acid fragments into its pores. We examined whether this ability of porous ceramic cubes could be applied for isolating viral nucleic acids or particles from the RSV- infected plant tissues. In this study, we found that the porous ceramic cube was capable of absorbing a detection level of viruses from the rice tissues infected with RSV and established RT-PCR-based RNA diagnosis method using porous ceramic cubes.
서론
국내에서 재배되는 벼의 주요 바이러스병은 벼줄무늬잎마름병, 벼오갈병, 벼검은줄오갈병이며, 이러한 질병은 각각 벼줄무늬잎마름바이러스(Rice stripe virus, RSV), 벼위축바이러스(Rice dwarf virus; RDV) 및 벼검은줄무늬위축바이러스(Rice black streaked dwarf virus; RBSDV)에 의해 발병한다. 특히, 애멸구에 의해 전반되는 RSV는 1935년에 국내에서 처음 보고된 이후 지속적으로 발생되고 있으며, 2007년과 2008년에는 충남 서천, 전북 부안 등의 약 4,450 ha 논과 전남 해남, 진도 지역을 중심으로 한 869 ha 논에서 대량 발생하여 큰 피해를 일으켰다(Kim 등, 2008; 2009a). 이러한 벼 바이러스병은 국내뿐만 아니라 쌀을 주식으로 하고 있는 아시아의 벼 재배지역에 큰 피해를 주고 있어, 국가간 교류를 통해 벼 바이러스 병의 확산 방지를 위한 노력이 절실히 요구되고 있다.
벼 바이러스 병의 확산 방지를 위한 가장 효율적인 방법은 바이러스 병 발생을 신속하게 진단하는 것이다. 일반적으로 식물 바이러스 진단에는 지표식물을 이용한 생물검정법과 전자현미경을 이용해 바이러스를 직접 관찰하는 dip진단법, 항혈청을 이용한 효소면역항체법(Enzyme-linked immunosorbent assay, ELISA)이나 Rapid Immuno-Gold Strip(RIGS)법, 병원체 유전체 증폭을 통한 Polymrase Chain Reaction(PCR)법과 Reverse Transcriptase-Polymerase Chain Reaction(RT-PCR)법 등이 이용되고 있다. 이러한 진단법 중 벼 바이러스를 진단하는 방법으론 ELISA와 RT-PCR법이 주로 이용되고 있고, 국내에서는 벼 바이러스 3종을 동시에 진단 할 수 있는 RT-PCR을 이용한 다중진단(multiplex RT-PCR)법이 보고되었다(Kim 등, 2007).
RT-PCR법은 ELISA에 비해 바이러스 검출감도와 특이도가 높지만, 주형 준비 과정이 복잡하고 시간과 노동력을 포함한 기타 경비가 많이 소요되기 때문에 대량 검정이 쉽지 않았다. 따라서 주형 준비 과정을 단순화 시키기 위해 PCR 반응용기에 항체를 결합시켜 바이러스 입자를 포획하거나(Nolasco 등, 1993), 반응 용기 표면에 바이러스 입자 또는 핵산을 직접 흡착시키는 방법 (Kim 등, 2009b), 주사기 바늘을 이용해 채취한 식물조직을 직접 주형으로 사용하거나(Hosokawa 등, 2006), 작은 식물조직으로부터 다공성 세라믹 큐브(porous ceramic cube)를 이용한 주형 준비법(Shin 등, 2015) 등이 보고되었다. 특히, 다공성 세라믹 큐브는 구멍(pore)의 크기와 표면특성 조절을 통해 PCR 저해 물질을 배제할 수 있는 초미세여과(ultrafiltration) 기능을 가지고 있어, 수 초 이내에 오이모자이크바이러스 검정용 주형을 간편하게 준비할 수 있어 RT-PCR 대량 검정에 적합할 것으로 판단된다(Shin 등, 2015). 그러나 다공성 세라믹 큐브를 이용한 RT-PCR 용 주형 준비법은 아직까지 보편화되어 있지 않기 때문에 이를 활용할 수 있는 조건을 조사할 필요가 있어, 본 연구에서는 RTPCR을 이용한 RSV 진단에 있어 다공성 세라믹 큐브의 활용 조건을 확립하고자 하였다.
재료 및 방법
잎 시료 및 다공성 세라믹 큐브
RSV에 감염된 벼와 건전한 식물체는 국립식량과학원에서 분양 받았으며, 온실에서 재배하면서 필요 시 식물체 부위별로 채취하여 실험에 사용하였다.
주형 흡수를 위한 다공성 세라믹 큐브는 ㈜ 바이오큐브시스템에서 분양 받았다. 큐브 종류는 가로, 세로, 높이가 0.5 mm× 1 mm×0.5 mm인 알루미나 큐브(Al2O3, No. 49)와 세로와 높이 가 0.5 mm로 동일하고 가로 길이가 1 mm(No. 50), 1.5 mm(No. 51), 2 mm(No. 52)인 규소 산화물 큐브(Low temperature cofired ceramic, LTCC)를 사용하였다(Fig. 1).
RT-PCR용 주형 준비
Total RNA는 Easy-spin™ Total RNAExtraction Kit(Intron, Korea)를 사용하여 건전한 벼와 RSV에 감염된 벼의 잎, 잎집, 줄기, 뿌리 조직(약 100 mg)으로부터 제조사의 방법에 따라 추출하였다. 세라믹 큐브를 이용한 주형준비는 세라믹 큐브 1개, 3개, 또는 5개를 식물체 조직에 올려놓고 핀셋의 편평한 부분으로 큐브를 눌러줌으로써 조직이 파쇄됨과 동시에, 큐브의 공극으로 주형이 흡수되도록 하였고, 주형이 흡수된 큐브를 RT-PCR 주형으로 바로 사용하거나 멸균수 12 μl에 넣어 95°C에서 5분 가열한 후 멸균수 8 μl를 취하여 RTPCR 주형으로 사용하였다.
RT-PCR 조건
Primer는 RSV 유전체 가운데 가장 작은 RNA4의 서열을 바탕으로 고안된 Kim 등(2009b)의 primer를 이용하였다. 정방향(5’-CATCACAGTGTCACTGGTCTTCAT-3’, RSR4-C10)과 역방향 (5’-AGTTGATAATAAGAATAGGAAATC-3’, RSR4-N30) primer에 의한 예상 증폭산물의 크기는 571bp이고, RT-PCR 증폭 절차는 다음과 같다. RT-PCR 반응액은 PCR tube에 total RNA 1 μl 또는 주형을 흡수한 다공성 세라믹 큐브, 10 pmol primer 각각 1 μl, 2x RT-PCR premix 10 μl(Genetbio SR-8000, Korea)를 넣고 멸균수를 첨가하여 전체 체적을 20 μl로 조정하여 준비하였다. RT-PCR은 역전사 반응(50°C/30분) 후 95 °C에서 10분간 변성 한 다음, 95°C/30초, 55°C/30초, 72°C/1분 과정을 35회 반복하였고, 72°C에서 5분간 반응시켜 수행하였다. PCR 산물은 1% 아가로스젤에서 60분간 전기 영동 후 EtBr(ethidium bromide)로 염색하여 UV광 하에서 확인하였다.
결과 및 고찰
다공성 세라믹 큐브를 이용한 벼 RSV 검정
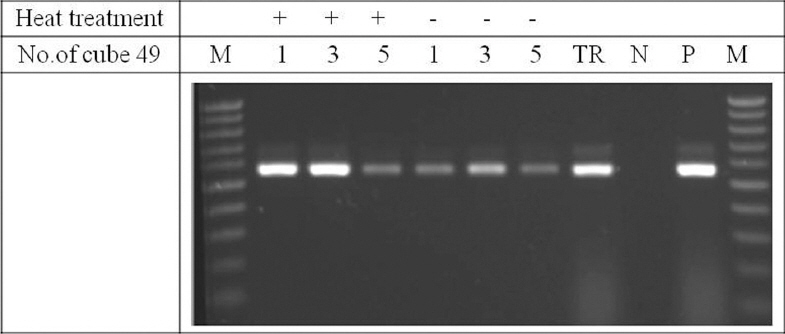
RSV가 감염 된 벼 잎을 대상으로 다공성 세라믹 큐브(49번) 1개, 3개, 5개를 2세트 준비하여 각각 벼 잎에 올려놓고 핀셋으로 눌러 즙액을 흡수시킨 뒤 한 세트는 가열하지 않고 바로 RT-PCR 주형으로 사용하고, 다른 한 세트는 튜브에 넣고 멸균수 12 μl를 넣어 95°C, 5분간 가열하여 변성 처리한 후 8 μl를 취하여 RT-PCR 주형으로 사용하였다. 또한 같은 시료로부터 전체 RNA를 추출하여 1 μl(약 0.2-0.5 μg)를 RT-PCR 주형으로 사용하였다. 그 결과 다공성 세라믹 큐브 1개 및 3개 사용한 것이 5개 사용한 것 보다 효율이 좋았고, 전반적으로 변성처리 한 것이 증폭 효율이 높았다. 또한 변성 처리한 큐브 1개와 3개를 사용한 RT-PCR은 정제한 RNA를 사용한 RT-PCR과 유사한 증폭 효율을 보였다(Fig. 2). 그러나 추가 실험에서 변성처리 여부가 큰 차이를 보이지 않아, 실험의 간편성을 위하여 변성 처리하지 않고 사용하였다.
다공성 세라믹 큐브의 종류에 따른 벼 RSV 검정
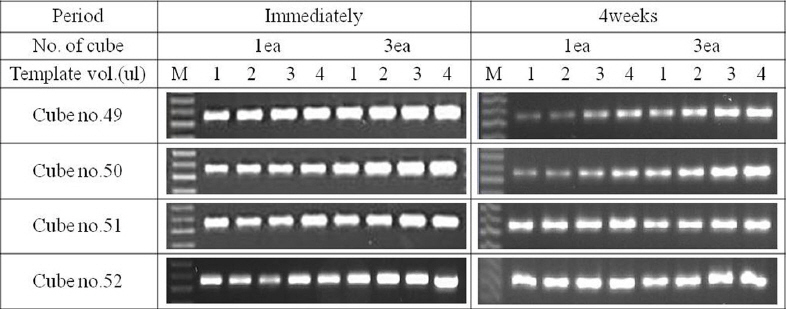
다공성 세라믹 큐브 종류에 따라 1개의 큐브를 이용하여 RT-PCR 한 결과, 모든 큐브에서 변성처리 여부의 큰 차이를 보이지 않았고 유사한 증폭 효율을 나타내었다(Fig. 3). 또한 큐브의 종류에 따라 큐브 개수 1개 또는 3개를 이용하여 즙액을 흡수시킨 후, 멸균수 25 μl에 변성 처리한 후, 바로 1 μl, 2 μl, 3 μl 와 4 μl를 주형으로 취하여 RT-PCR한 결과와 한 달간 냉동고(-20°C)에 보관 후 RT-PCR한 결과를 비교하였다(Fig. 4). 바로 RT-PCR한 경우에는 모든 조건에서 증폭효율이 유사하였으나, 한 달간 보관 후에 RT-PCR한 결과는 길이가 짧은 큐브 49번과 50번의 경우에서 사용된 큐브 개수와 주형의 양이 적을수록 증폭효율이 감소하였다. 큐브 51번과 52번의 경우는 모든 조건에서 증폭 효율이 처음과 큰 차이가 없었다. 이는 표면적이 큰 큐브일수록 공극의 수가 많기 때문에 흡수되는 바이러스 입자나 유전체의 양이 많아져서 상대적으로 증폭 효율이 높은 것으로 보여진다.
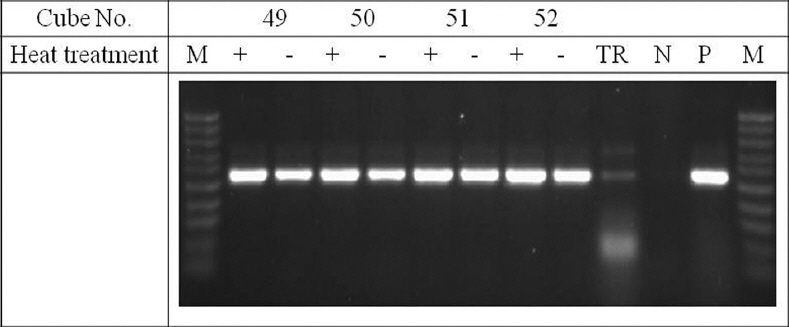
RSV detection by RT-PCR using four different kinds of porous ceramic cubes (no. 49, 50, 51 and 52) as a template. M: 100 bp ladder, TR: purified total RNA, N: negative control, P: positive control.
다공성 세라믹 큐브를 이용한 벼 부위별 RSV 검정
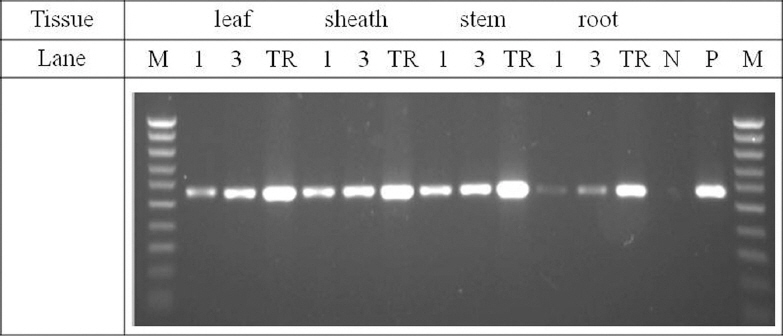
RSV 가감염된 벼의 잎, 잎집, 줄기 및 뿌리를 대상으로 큐브 (49 번) 1 개 와 3 개를사용하여 각각의 부위로부터 즙액을흡수시키고 같은 시료로부터 전체 RNA를 추출하여 RT-PCR 하였다 (Fig. 5). 잎, 잎집,줄기 및 뿌리 모든부위에서 RSV 가 진단되었으나 뿌리에서의 증폭 효율이 조금 낮게 나타났다. 이는 뿌리에 큐브를 올려 놓고 즙액을흡수시키는과정에서 상대적으로 다른 부위에 비해 흡수율이 낮은 결과로 보인다. 큐브 1 개를 사용했을 때보다 큐브 3 개를 사용했을 때 증폭 효율이 조금 높은 것으로 보였으나 큰차이가 없어서 1 개를 사용해서 RSV를 진단한다면 좀 더 비용을 줄일 것으로 보인다. 정제된 RNA 를 주형으로 한 RT-PCR 보다는증폭효율이 조금 낮았으나, 벼의 잎이나 잎집, 줄기를 대상으로 검정한다면 큰 차이 없이 진단이 가능할 것으로 보인다.
다공성 세라믹 큐브의 보관온도와 기간에 따른 벼 RSV 검정
벼에서 발생하는 바이러스 병은 국내에서뿐만 아니라 쌀을 주식으로 하고 있는 아시아 지역의 벼 재배지역에 피해를 주고 있어서 국가간 교류를 통해 바이러스 병의 확산을 막기 위한 노력이 필요하다. 이를 위해 국가간에 바이러스 발생을 상호 진단할 필요가 있다. 그러나 국제법상 바이러스 이병 식물체 시료를 반입할 수 없는 실정이기 때문에, 대신에 큐브를 사용하여 식물체로부터 바이러스 입자나 핵산을 흡즙하여 들여오면 간편하게 진단을 할 수 있을 것으로 보인다. 이를 위해서, 큐브의 보관온도나 보관기간에 따른 RT-PCR 효율성을 검정하였다. 보관온도는 상온, 냉장보관(4°C), 초저온냉동보관(-80°C), 그리고 아시아 지역의 기후를 고려하여 37°C 조건으로 실험하였고, 보관기간은 2주차와 4주차로 나누어서 실험하였다. 벼 시료는 앞에 실험과 같이, 잎, 잎집, 줄기 및 뿌리를 대상으로, 큐브(49번) 는 1개와 3개를 사용하였고, 변성 처리하지 않았으며, 정제된 핵산도 비교실험을 위하여 같이 진행하였다. 결과적으로, 모든 조건에서 RSV가 진단되었다(Fig. 6). 보관온도에 따른 차이는 초저온냉동보관(-80°C)이 다른 온도에 비해 증폭 효율이 조금 높은 편이었고, 보관기간은 4주차에서도 증폭 효율이 크게 떨어지지 않았다. 다른 조직에 비해 뿌리에서의 증폭 효율이 조금 낮은 편이었고, 큐브 1개 보다는 3개를 사용하는 것이 효율이 조금 높았다. 정제된 핵산과 비교했을 때, 약간 증폭 효율이 떨어지는 조건도 있었으나 대체로 큰 차이를 보이지 않았다. 보관 기간이 9주차이고, 보관 온도가 37°C인 경우 정제된 핵산은 분해되어 증폭 효율이 급격히 감소되었지만, 큐브를 사용한 경우 매우 안정적이어서 증폭 효율이 크게 감소하지 않았다(Fig. 7).
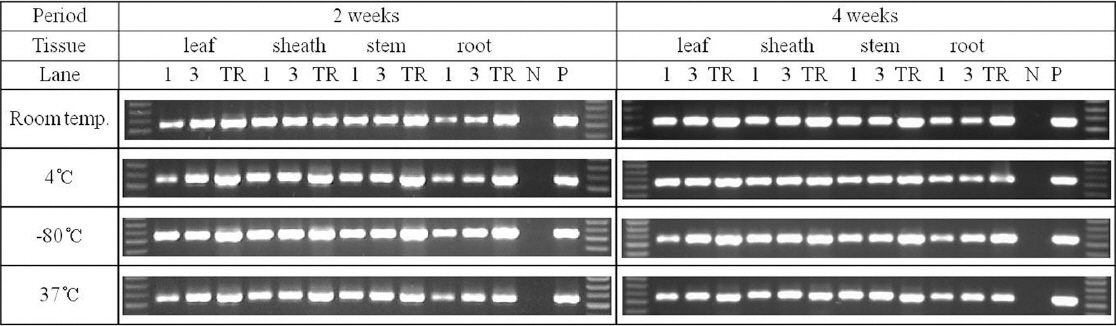
RSV detection by RT-PCR using the porous ceramic cube as template, wherein amplification was done using porous ceramic cube 1ea or 3ea from four different rice tissues, respectively, according to the storage temperatures and periods of ceramic porous cube. Porous ceramic cubes were used without heat treatment. TR: purified total RNA, N: negative control, P: positive control.

RSV detection by RT-PCR using the porous ceramic cube as template, wherein amplification was done using porous ceramic cube 1ea or 3ea from four different rice tissues, respectively after 9 weeks storage. TR: purified total RNA, N: negative control, P: positive control.
이와 같이, 벼 재배지역으로부터 수집된 시료를 대량으로, 또는 장기간 보관 후 RSV를 진단해야 하는 경우, 다공성 세라믹 큐브를 이용하면 감염 식물로부터 전체 핵산을 추출해야 하는 과정이 필요 없게 되어 매우 간편하고 빠르게 진단 할 수 있으며 진단 비용도 절감할 수 있다. 또한 해외에서 바이러스 이병 식물체 시료를 반입할 수 없는 경우, 식물체로부터 바이러스 입자 및 핵산을 흡수한 큐브를 이용하면 국가간 바이러스 발생 상황과 해외 유입 바이러스의 경로를 추적할 수 있는 좋은 재료로 사용할 수 있고, 또한 유전자원 확보도 가능하게 할 것으로 보인다.
Acknowledgement
This research was supported by a grant from the Agenda Program (PJ010113), funded by the Rural Development Administration of Korea.