국내 패션프루트(Passiflora edulis)에서 분리한 Cucumber Mosaic Virus의 특성
Characterization of Cucumber Mosaic Virus Isolated from Passion Fruit (Passiflora edulis) in Korea
Article information
Abstract
2020년 7월, 전라남도 해남에서 퇴록병반과 엽맥녹대 등 바이러스 병징이 보이는 패션프루트(Passiflora edulis) 잎으로부터 total RNA를 추출했으며, RT-PCR 검정과 염기서열 결정을 통해 CMV-HN2를 동정하였다. 패션프루트에 감염하는 CMV의 생물학적 특성을 확인하기 위해 10개 지표식물에 CMV-HN2를 접종한 결과, CMV-Fny와 비교하여 전형적인 CMV의 감염 패턴을 나타냈다. CMV 패션프루트 분리주들의 외피단백질에 대한 계통발생학적 분석한 결과, CMV의 패션프루트 분리주들은 subgroup I에 속하는 것으로 나타났으며, 그중 CMV-HN2는 subgroup IA에 속하는 것으로 나타났다. 또한 국내 패션프루트 CMV 분리주들 사이의 subgroup 차이가 확인되었다. 패션프루트 분리주 간의 외피단백질 아미노산 서열을 비교하였을 때, CMV-HN2는 다른 분리주들과 특이적으로 4-8개 아미노산 차이가 존재하였다. 이 결과를 통해, 패션프루트 CMV 분리주들의 외피단백질에서 유전적 다양성이 있음을 확인하였다.
Trans Abstract
In July 2020, total RNA was extracted from passion fruit (Passiflora edulis) leaves showing virus symptoms such as chlorotic spots and vein banding in Haenam, South Korea. Cucumber mosaic virus (CMV)-HN2 was identified through reverse transcription polymerase chain reaction and sequencing analysis. To confirm the biological characteristics of the CMV infecting passion fruit, 10 indicator plants were inoculated with CMV-HN2, and the results showed a typical CMV symptoms. Phylogenetic analysis based on the amino acid of the coat protein (CP) of CMVs revealed that the CMV passion fruit isolates belonged to subgroup I, among which CMV-HN2 belonged to subgroup IA. Additionally, CMVs isolated from passion fruit in Korea have amino acid sequence variation between the subgroup. Among them, CMV-HN2 had four to eight amino acid differences in CP from other CMV isolates from passion fruit. These results confirm the presence of genetic diversity in the CPs of passion fruit CMV isolates.
서 론
패션프루트는 시계초과에 속하는 작물로, 브라질에서 주로 재배되고 한국을 포함한 여러 나라에서도 널리 재배되고 있다(Fischer와 Rezende, 2008). 패션프루트는 항산화 효과뿐만 아니라 불안, 불면증, 천식 등을 치료하기 위해 민간요법으로 사용되어진다(Zeraik 등, 2011; Zibadi 등, 2008). 그러나 패션프루트의 재배와 생산은 바이러스, 곰팡이 등 각종 병원균에 의해 영향을 많이 받는다(Fischer와 Rezende, 2008). 그중 바이러스성 질병은 매우 심각한 질병을 야기하며 작물의 수확량을 감소시킨다(Chen 등, 2021). 패션프루트에 발생하는 바이러스는 전 세계적으로 20여 종 이상이 보고되었으며, 국내에서는 cucumber mosaic virus (CMV), Euphorbia leaf curl virus, East Asia passiflora virus, passionfruit woodiness virus가 보고되어 패션프루트 재배에 피해를 끼치는 것으로 알려져 있다(Fischer와 Rezende, 2008; Jaramillo Mesa 등, 2019; Jeon 등, 2022; Kil 등, 2016; Pares 등, 1985).
그중에 CMV는 Cucumovirus 속에 속하는 바이러스로 매우 넓은 기주 범위와 높은 변이성을 가진다. 혈청학적 관계와 뉴클레오타이드 서열 유사성에 따라 subgroup I과 subgroup II로 나뉘고 subgroup I은 coat protein과 RNA3의 5′ 영역을 통해 subgroup IA와 subgroup IB로 구분된다(Chen 등, 2007; Roossinck 등, 1999). Subgroup IB의 경우 아시아에 제한적으로 분포하는 것으로 알려져 있다(Choi 등, 1999; Roossinck 등, 1999).
패션프루트에 감염하는 CMV는 모자이크, 괴사, 잎말림과 같은 병징을 나타낸다(Yeturu 등, 2018). 국내의 경우, 패션프루트에 CMV의 발생이 50% 이상 확인되고 있지만 생물학적 특성이나 분자적 특성 분석은 이루어지지 않았다(Jeon 등, 2022). 본 연구는 전라남도 해남에서 퇴록병반과 엽맥녹대 등 바이러스 증상을 보이는 패션프루트를 채집하여 reverse transcription polymerase chain reaction (RT-PCR)과 염기서열 분석을 통해 CMV 분리주를 동정하였다. 또한 패션프루트에서 분리한 CMV 의 생물학적, 분자적 특성을 알아보고자 하였다.
재료 및 방법
바이러스원 및 지표식물 접종.
전라남도 해남의 패션프루트 재배농가에서 바이러스 병징을 나타내는 잎을 채집하여 -70°C의 초저온냉동고에서 유지하였다.
지표식물로 사용된 Nicotiana benthamiana, N. tabacum cv. Xanti nc, N. tabacum cv. Samsun, N. rustica, N. glutinosa, Chenopodium amaranticolor와 C. quinoa는 본 연구실에서 유지 중인 종자를 이용하였으며, 고추, 쥬키니호박, 오이는 시판 품종을 이용하였다. 모든 식물은 27°C, 60% 습도의 항온항습실에서 16시간의 광조건 및 8시간의 암조건으로 재배하였다.
채집된 잎은 막자사발에서 0.1 M phosphate buffer (pH 7.2)와 함께 마쇄하였다. 마쇄된 즙액은 건전 식물의 잎에 카보런덤을 얇게 뿌린 뒤 기계적으로 접종하였다.
핵산 추출 및 RT-PCR.
바이러스 병징을 보이는 패션푸르트 잎 디스크 2장을 기존에 잘 알려진 phenol/chloroform 방법을 이용하여 total RNA를 추출하였다(Sambrook 등, 1989).
추출된 total RNA는 패션푸르트에 보고된 11종 바이러스의 특이 프라이머를 이용하여 RT-PCR에 사용되었다. cDNA 합성을 위해 M-MLV reverse transcriptase (Promega, Madison, WI, USA)를 이용하여 42°C에서 1시간 동안 역전사 반응을 진행하였으며, 이후 5분간 94°C의 변성과정을 추가하였다. 20 µl의 역전사 반응액은 5x Reaction Buffer 4 µl, 10 mM dNTP 2 µl, 바이러스별 10 pmol reverse primer 1 µl, total RNA 2 µl, M-MLV reverse transcriptase 0.5 µl 및 10 µl의 멸균수로 조제하였다. 역전사 산물은 i-taq polymerase (iNtRON Biotechnology, Seongnam, Korea)를 이용하여 초기 변성 94°C 5분 이후 변성 95°C 30초, 결합 50°C 30초, 신장 72°C 30초의 과정을 34회 반복하고, 마지막 신장 단계를 72°C 5분간 수행하였다. PCR 반응액은 10x Reaction Buffer 5 µl, 10 mM dNTP 4 µl, 바이러스별 10 pmol forward/reverse primer 각 1 µl, cDNA 2 µl, i-taq polymerase 0.5 µl 및 36.5 µl의 멸균수로 조제하였다. RT-PCR 산물은 1% agarose gel에서 전기영동하여 Gel Doc XR+ Gel Documentation System (Bio-Rad Laboratories, Hercules, CA, USA)에서 UV로 확인하였다.
11종의 패션프루트 감염 바이러스를 검정하기 위한 바이러스별 특이 프라이머는 기존에 보고된 프라이머 서열 또는 National Center for Biotechnology Information (NCBI)에서 각 바이러스의 염기서열을 수집하여 보존된 서열을 대상으로 제작하였다(Table 1).
클로닝 및 염기서열 결정.
증폭된 PCR 산물은 pGEM-T easy vector (Promega)를 이용하여 클로닝하였다. 클로닝된 plasmid는 Macrogen (Seoul, Korea)에 의뢰하여 ABI 3730xl System을 통해 삽입된 DNA 서열을 결정하였다.
결정된 염기서열은 NCBI의 Basic Local Alignment Search Tool에서 Standard databases의 Highly similar sequences로 검색하였다.
계통발생학 분석 및 pairwise alignment.
17개의 CMV 분리주의 외피단백질 뉴클레오타이드 서열을 미국 국립생물정보센터(NCBI)로부터 확보하였으며, MEGA X프로그램의 Clustal W 툴을 통해 alignment 분석을 수행하였다. 이후 Maximum Likelihood법으로 1,000회의 bootstrap을 실시하여 계통수를 생성하였다.
정렬된 염기서열은 FASTA 파일로 변환하여 Sequence Demarcation Tool version 1.3 (SDTv1.3) 프로그램을 이용하여 pairwise alignment를 수행하였다.
결과 및 고찰
시료 채집 및 바이러스 동정.
2020년 7월, 전라남도 해남의 패션프루트 재배농가에서 바이러스 병징인 퇴록병반과 엽맥녹대가 보이는 패션프루트 잎 3개를 채집하였다(Fig. 1). 바이러스 동정을 위해 병징이 보이는 잎에서 추출된 total RNA를 국내 패션프루트에서 보고된 6종 및 해외에서 보고된 5종의 바이러스에 대한 특이 primer를 사용하여 RT-PCR 검정을 수행하였다(Table 1). RT-PCR 산물을 1% agarose gel에서 전기영동한 결과, 유일하게 CMV 외피단백질을 표적으로 하는 특이 primer 로 증폭된 657bp의 DNA 밴드가 확인되었다(Fig. 2). RT-PCR을 통해 얻어진 amplicon을 TA 클로닝하여 CMV 외피단백질의 염기서열을 결정하였다(Macrogen). 획득한 염기서열을 NCBI의 Basic Local Alignment Search Tool 검색 결과, 패션프루트에서 검정된 CMV는 기존 GenBank에 등록된 국내 여주에서 분리된 CMV-BGK 분리주(NCBI accession no. LC701732)와 99.09%의 상동성을 보였으며, 이를 CMV-HN2 (NCBI accession no. LC654689)로 명명하였다.
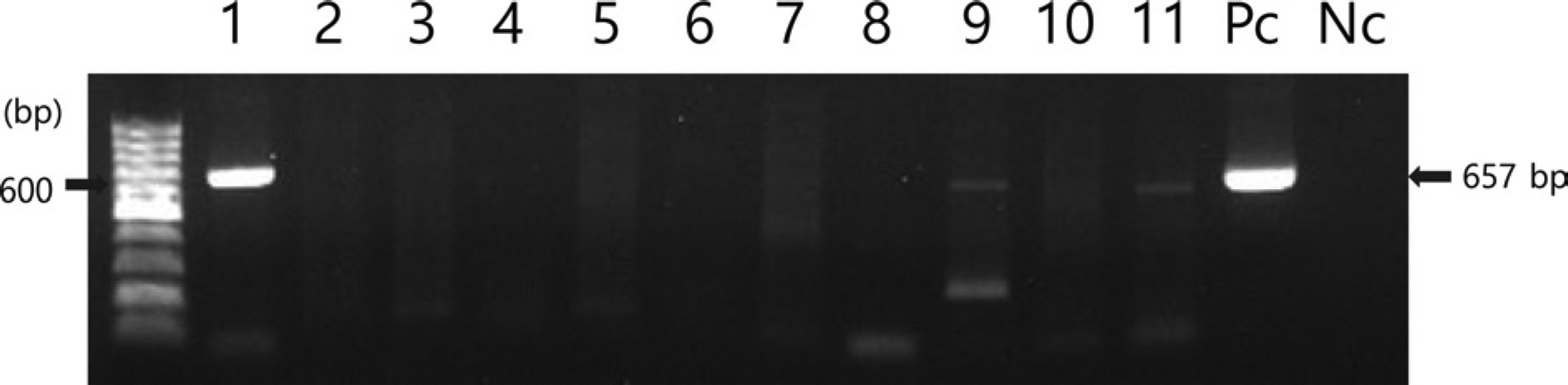
Detection of viruses in symptomatic passion fruit leaves in Haenam, Korea by reverse transcription and polymerase chain reaction with 11 specific primer sets. Lane 1, cucumber mosaic virus; Lane 2, East Asian Passiflora distortion virus; Lane 3, East Asian Passiflora virus; Lane 4, euphorbia leaf curl virus; Lane 5, jatropha mosaic virus; Lane 6, papaya leaf curl guangdong virus; Lane 7, passion fruit yellow mosaic virus; Lane 8, passion fruit woodiness virus; Lane 9, soybean mosaic virus; Lane 10, tomato yellow leaf curl virus; Lane 11, zucchini yellow mosaic virus; Pc, positive control; Nc, negative control.
기주식물 반응.
패션프루트에서 확인된 CMV의 생물학 적 특성을 확인하기 위해 CMV의 감염이 확인된 패션프루트 잎을 담배 5종(N. benthamiana, N. tabacum cv. Xanti nc, N. tabacum cv. Samsun, N. rustica, N. glutinosa), 명아주 2종(C. amaranticolor, C. quinoa), 고추(Capsicum annuum cv. Cheongyang), 쥬키니호박(Cucurbita pepo cv. Jeongilpum) 그리고 오이(Cucumis sativus cv. Daeseon)에 즙액 접종하였다. 지표식물에서 CMV-HN2는 담배 5종, 고추, 쥬키니호박 그리고 오이의 상엽에서 모자이크를 보이며 전신감염하였고, 명아주 2종에서는 접종엽에 국소 괴사 반점을 나타냈으며, 이러한 CMV-HN2의 지표식물 반응은 대조구로 사용된 CMV의 대표적인 분리주인 CMV-Fny와 유사하였으며, 전형적인 CMV의 병징을 나타냈다(Table 2). 따라서 패션프루트에 감염하는 CMV가 일반적인 CMV 분리주와 마찬가지로 다양한 기주식물에 감염할 수 있다는 것을 시사한다.
CMV 외피단백질 서열 분석.
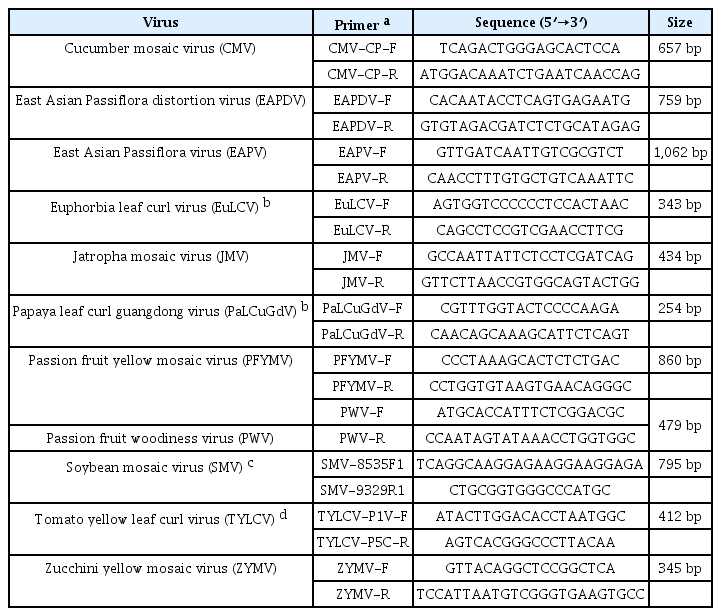
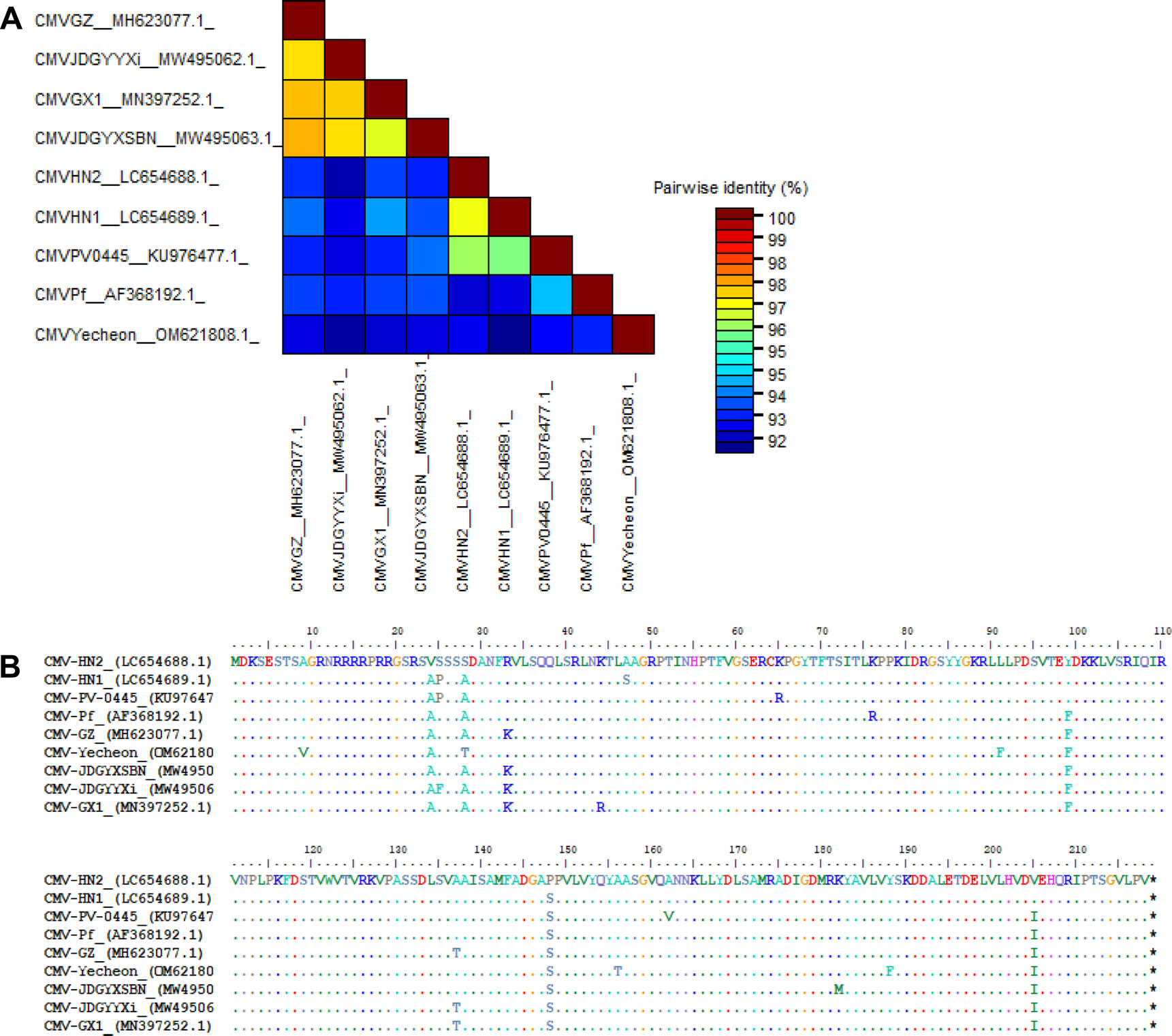
다양한 CMV 분리주와 패션프루트에서 분리된 8개의 CMV 분리주가 아미노산 수준에서 계통 분석이 수행되었다(MEGA X software). 보고된 패션프루트 분리주들은 subgroup I에 속하는 것을 확인할 수 있었으며, 그중 CMV-HN2는 subgroup IA에 속하는 것으로 나타났다(Fig. 3). Subgroup IA에 속한 패션프루트 분리주들은 나이지리아와 국내에서 분리되었으며, subgroup IB에 속한 패션프루트 분리주들은 중국, 일본, 국내 예천지역에서 분리되어 subgroup IB의 아시아에 제한된 분포와 일치하였다 (Fig. 3). 또한 중국과 일본의 패션프루트에서 분리된 CMV 분리주들은 하나의 클러스터를 형성하였다. 각 서브그룹에 속하는 패션프루트에서 분리된 CMV와 CMV-HN2의 정확한 외피단백질 서열 차이를 확인하기 위해 뉴클레오타이드와 아미노산 수준에서 각각 비교 분석하였다. 뉴클레오타이드 수준에서 패션프루트 분리주 간에 pairwise alignment (SDTv1.3 software)를 수행한 결과, CMV-HN2는 약 92%에서 97% 수준의 염기서열 상동성을 나타냈다(Fig. 4A). 서브그룹 간 염기서열 상동성은 92%에서 94% 수준이었으며, 국내 예천지역의 패션프루트 분리주 CMV (CMV-Yecheon)와 CMV-HN2 또한 93% 수준의 염기서열 상동성을 보였다. 아미노산 수준에서 CMV-HN2는 패션프루트에서 분리된 CMV 분리주(CMV-GX1, CMV-GZ, CMV-HN1, CMV-JDGYYX, CMV-JDGYXSBN 및 CMV-KoPF)와 4-8개의 아미노산 차이로 96%에서 98% 수준의 염기서열 상동성을 보였다(Fig. 4B). 이러한 결과는 세계적인 패션프루트 분리주들 간의 외피단백질이 유전적 다양성이 존재하며, 국내 패션프루트 분리주 CMV 사이에도 유전적 차이가 있음을 보여준다. 본 연구는 국내 패션프루트의 주요 병원성 바이러스인 CMV를 분리하여 생물학적, 분자적 특성을 확인해 향후 국내 패션푸르트 감염 바이러스 연구를 위한 기초 자료로 활용될 것으로 사료된다.

Phylogenetic analysis of coat proteins (CP) of cucumber mosaic virus (CMV) at amino acid level. ●, CMV-HN2; ○, another CMVs isolated from passion fruit. Phylogenetic tree was carried out using the maximum likelihood method and 1,000 bootstrap replicates were used by Clustal W in MEGA 7 software.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea govern-ment (MSIT) (NRF-2021R1F1A1061543).