2023 파프리카 종자의 Fusarium oxysporum 오염에 의한 철원지역 파프리카 모잘록병 대발생
Paprika Damping-off Outbreak Caused by Fusarium oxysporum Contaminated Seeds in Cheorwon Province in 2023
Article information
Abstract
2023년 강원특별자치도 철원군의 파프리카 농가 74곳에서 특정 품종의 유묘에 줄기가 잘록해져서 쓰러지는 모잘록병 증상을 보이는 병이 대발생함에 따라 본 연구에서는 모잘록병의 원인을 규명하고자 하였다. 모잘록병으로 의심되는 유묘에서 현미경으로 관찰 시, 초승달 모양의 F. oxysporum의 전형적인 분생포자가 관찰되었다. 이에 따라 F. oxysporum 특이 프라이머를 이용하여 PCR을 수행하여 양성 밴드를 확보하였으며, 염기서열을 분석한 결과 F. oxysporum의 유전자임이 확인되었다. 농가에서 분리한 F. oxysporum의 병원성의 재현성을 확인하기 위해 농가에서 분리한 F. oxysporum 균주를 다른 파프리카 품종의 건전주에 접종하여 모잘록병이 발생함을 확인하였다. 이번 모잘록병의 대발생이 오염된 종자에 의한 것인지, 농가 환경에서 감염되어 확산된 것인지의 여부를 확인하기 위해, 표면살균 처리한 파프리카 종자와 살균하지 않은 무처리 종자를 MS 배지에 각각 치상하여 배양하였다. 그 결과, 무처리 종자배지에서만 분홍색의 전형적인 F. oxysporum의 균사가 확인되었다. 또한, 농가에서 분리한 균주, 농가에서 분리한 균주를 접종하여 얻은 균주 그리고 같은 파프리리카 품종의 제조생산번호가 같은 미개봉 종자에서 분리한 균주가 동일한 F. oxysporum인지를 확인하기 위해 18S rRNA region의 염기서열을 이용하여 분자계통분류학적 분석을 진행한 결과, 결과 3종의 F. oxysporum 균주가 같은 그룹으로 분류되었으며, 기존에 철원군에서 보고된 F. oxysporum과는 다른 그룹임을 확인하였다. 이는 파프리카의 모잘록병 대발생의 원인은 F. oxysporum에 오염된 종자에 의한 것임을 증명하였다.
Trans Abstract
In 2023, symptoms like damping-off disease were observed in 74 paprika growing in greenhouses in Cheorwon-gun, Gangwon-do, Korea. In this study, we tried to find the cause of the damping-off disease outbreak. We collected symptomatic seedlings and observed the typical crescent-shaped conidia of Fusarium oxysporum by microscope. To confirm the presence of F. oxysporum in the samples, polymerase chain reaction was performed using primers specific for F. oxysporum; the resulting sequence showed 99.11% identity with F. oxysporum. To confirm the pathogenicity of the F. oxysporum (CW) isolated from the samples, healthy paprika plants were inoculated with F. oxysporum CW and damping-off symptoms were observed 2 weeks later. To investigate whether the damping-off disease outbreak in Cheorwon-gun was caused by F. oxysporum-contaminated seeds, 100 paprika seeds were disinfected and placed in Murashige and Skoog medium. Typical pink F. oxysporum hyphae were found only in control non-disinfected seeds. An 18S rRNA-based and a TEF gene-based phylogenetic analysis showed that the F. oxysporum CW isolate was not grouped with a F. oxysporum isolate reported from Cheorwon-gun in 2019. This study is the first report that an outbreak of damping-off disease in paprika in Cheorwon-gun, Gangwon-do, Korea, was caused by contamination of F. oxysporum seeds.
서 론
파프리카(paprika)는 가지과(Solanaceae family) 고추속(Capsicum genus)에 속하는 작물로, 품종에 따라 다양한 색과 단맛부터 매운맛까지 종류가 다양하다(Arrizabalaga-Larraña-ga 등, 2021; Barbosa 등, 2020). 비타민 A, B, C와 E 등 영양소가 풍부하여 전 세계적으로 인기 있는 식재료 중 하나이며, 생으로 먹거나 건조한 뒤 가루로 만들어 요리에 첨가하여 먹는 등 다양한 방식으로 소비되고 있다(Mamedov 등, 2015; Topuz 등, 2009). 파프리카는 철원군을 대표하는 고소득 경제 작물로 철원군 통계 자료(2021)에 의하면 철원지역 파프리카 재배면적과 생산량은 2015년 재배면적 113 ha에서 11,142.0 t이고 2021년에는 210 ha에서 18,916.7 t으로 점차 증가하고 있는 추세이다.
Fusarium oxysporum은 토양전염성 곰팡이로 작물의 뿌리에 감염하여 기주의 물관부에서 병원균이 증식하여 통로를 막아 시들음병, 괴사, 황백화 증상 등을 유발한다(Ma 등, 2013; Michielse와 Rep, 2009; Tjamos와 Beckman, 2013). 가지과(Solanaceae)와 박과(Cucurbitaceae) 작물을 포함하여 100여 종의 식물에 감염되며, 특히 토마토, 파프리카, 바나나 등 경제적으로 중요한 작물에 감염하여 큰 피해를 일으킨다(Gherbawy 와 Yaser, 2003; Husaini 등, 2018; Li 등, 2020; Michielse와 Rep, 2009). F. oxysporum은 상위 10개의 식물 병원성 곰팡이 중 5위를 차지하고 있으며, 시들음 증상으로 인해 100%의 수확량 손실이 일어날 정도로 치명적인 병원균 중 하나이다(Dean 등, 2012; Maitlo 등, 2014).
2023년 2월 강원특별자치도 철원군의 파프리카 74곳 농가에서 특정 품종의 파프리카 유묘에서 줄기의 지제부가 잘록해져서 쓰러지는 등 모잘록병 의심 병징을 보이는 현상이 대발생하였다. 본 연구에서는 파프리카 유묘에서 모잘록 증상의 원인 규명을 위해, 병원성 미생물을 분리 및 동정하고, 역학조사 및 계통 분류학적 분석을 통해 유통 전 종자 오염에 의한 파프리카의 모잘록병이 발병된 것임을 확인하였다.
재료 및 방법
파프리카 유묘에서 병원균 분리.
강원특별자치도 철원군의 파프리카 농가에서 모잘록병 증상을 보이는 파프리카 유묘와 발아한 뒤 분리된 종피를 채집하여 병원균을 분리하였다. 모잘록 증상을 보이는 파프리카 유묘를 채집하여 각 줄기, 뿌리 및 종피의 3개 부위로 나누어 식물체 표면을 각각 70% 에탄올에 30초씩 2회 표면 소독 후, 멸균수로 3회 세척하였으며, 멸균된 filter paper를 이용하여 남아있는 물기를 제거하였다. 표면소독을 마친 각각의 시료는 줄기, 뿌리는 5 mm 크기로 각 3개씩 준비하였으며, 파프리카 종피도 3개를 준비하였다. 시료는 항생제(penicillin 0.3 g/l과 tetracycline 0.3 g/l)가 첨가된 potato dextrose agar (PDA) 배지에 치상하여 11일간 배양하여 발생한 균주를 순수 분리하였다.
Polymerase chain reaction (PCR) 증폭 및DNA 염기서열 분석.
병원균을 검정하기 위해 농가에서 채집한 모잘록 증상을 보이는 샘플에서 DNA를 추출(BCS FOLDER; Biocube system, Suwon, Korea)하고, DNA를 template으로 하여 Çolak 과 Biçici (2013)에서 사용된 프라이머(uni-f: ATCATCTTGTGCCAACTTCAG, uni-r: GTTTGTGATCTTTGAGTTGCCA)를 이용하여 PCR을 수행하였다. PCR reaction mix 조성은 Biocube (Biocube system) 1개, F/R 프라이머 각 1 µl (10 pmol), 2X RT-PCR premix 10 µl, 멸균수 8 µl를 첨가하여 총 volume을 20 µl로 하였다. PCR 조건은 95°C에서 3분간 denaturation 후, 95°C에서 30초, 60°C에서 30초, 72°C에서 30초의 조건으로 35 cycle을 수행한 다음 72°C에서 5분 수행하였다. PCR 반응물은 1% aga-rose gel에서 전기영동으로 증폭 여부를 확인하였고, Dokdo-Prep TM GEL/PCR purification kit (Elpis biotech, Daejeon, Korea)를 이용하여 PCR 반응물을 정제한 뒤 Applied Biosystems 3730XL DNA Analyzer (Applied Biosystems, Foster City, CA, USA)를 이용하여 Sanger sequencing 분석법으로 염기서열을 분석하였다(Bionics, Seoul, Korea).
파프리카 종자의 병원균 오염 여부 확인을 위한 병원균 분리.
병 발생의 원인이 종자 오염인지 농가 환경에서 감염된 것인지를 확인하기 위해 채집 샘플과 생산포장번호가 같은 미개봉된 파프리카 종자 제품(품종: 키씨, Keessie RZ, Lot No: 102733738)과 대조군으로 타품종 종자(품종: 아시아레드)를 준비하였다. 각 파프리카 종자를 사용하여, 총 200립 중, 100립은 종자의 표면살균 처리를 하기 위해 5% sodium hypochlorite solution (Daejung, Siheung, Korea)을 1%로 희석한 용액에 10초간 표면 소독한 뒤, 멸균수에 10분씩 2회 세척 후 멸균된 filter paper를 이용하여 남은 물기를 제거하여 준비하였고, 나머지 100립은 표면살균을 하지 않는 무처리군으로 준비하였으며, 각 Murashige & Skoog 배지(Duchefa, Haarlem, Netherlands) 1 plate당 50립씩 치상하여 종자로부터 병원균(F. oxysporum CW-S)을 배양하였다.
분리균의 병원성 확인.
농가에서 채집한 샘플에서 분리한 균주(F. oxysporum CW)의 병원성 검정을 위해 건전 파프리카(품종: 아시아레드)에 F. oxysporum CW를 접종하여 균주의 병원성을 확인하였다. PDA 배지에서 25°C에서 7일간 배양한 후 1×107 conidia/ml의 농도로 포자 현탁액을 제조하여 접종원을 준비하였다. 파종 후 4주 된 파프리카 작물에 포자 현탁액 10 ml을 관주 처리하였다(Park 등, 2019).
18S rRNA 분석.
농가 채집 샘플에서 분리된 F. oxysporum CW와 생산포장번호가 같은 미개봉 종자에서 분리된 균주(F. oxysporum CW-S), 병원성 확인 후 분리한 균주(F. oxysporum CW-2)를 PDA 배지에서 25°C에서 7일간 배양한 후, 18S rRNA 염기서열을 분석한 후, NS1과 NS8 프라이머로 PCR 및 sequencing을 수행하여 forward 및 reverse 서열을 합쳐 하나의 contig file을 만든 뒤, NCBI BLAST를 수행하여 상위 10개에 해당하는 균으로 계통분류학적 분석을 진행하였다(Macrogen, Seoul, Korea).
Translation elongation factor (TEF) 1-alpha 유전자 분석.
Park 등(2019)에서 보고된 철원군의 파프리카에서 분리된 F. oysporum (MK732352)과 유연관계를 분석하기 위하여 본 실험에서 분리한 F. oysporum (F. oysporum CW)의 TEF 유전자 염기서열을 확보하였다. Geiser 등(2004)에서 사용된 TEF 프라이머(F-ATGGGTAAGGA(A/G)GACAAGAC, R-GGA(G/A) GTACCAGT(G/C)ATCATGTT)를 이용하여 annealing 온도를 53°C로 설정하고 PCR을 수행한 결과 약 700 bp의 PCR 산물을 획득하였다. 이를 pGEMⓇ-T easy Vector (Promega, Madison, WA, USA)를 이용하여 cloning한 뒤, 염기서열 분석(Bionics)을 통해 TEF 유전자 염기서열을 확보하였다. 이후 분리균의 계통분류학적 분석을 위해, National Center for Biotechnology Information (NCBI)에 GenBank에 등록되어 있는 균주의 TEF 유전자 염기서열을 이용하여 MEGA11 (Tamura 등, 2021) 프로그램으로 계통수를 작성하였다. 프로그램은 Maximum Likely-hood model과 Kimura 2-parameter model/method를 적용하고, bootstrap은 1,000회를 실시하였다.
결 과
모잘록 병징을 보이는 파프리카 유묘에서 F. oxysporum 분리 및 동정.
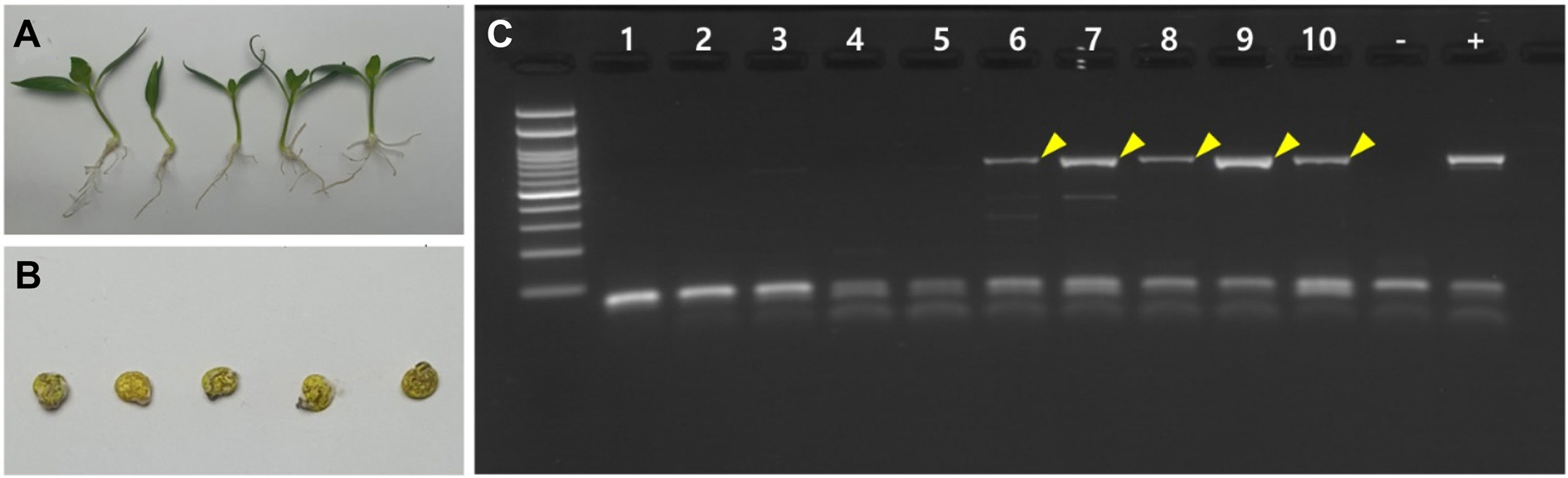
2023년 2월 강원특별자치도 철원군의 파프리카 농가 74곳에서 유묘에서 모잘록병으로 의심되는 작물병이 대발생하였다. 특정 시기에 생산 및 포장(Lot. No. 102733738)된 키 씨 품종의 종자를 파종한 농가에서 어린 모의 줄기 지제부가 잘록해지고, 물러져 유모가 쓰러지는 증상이 발생하였다(Fig. 1A). CX43 생물 현미경(Olympus, Tokyo, Japan)을 통해 농가에서 채집한 샘플에서 Fusarium sp. 포자의 전형적인 모양인 초승달 모양의 분생포자가 관찰되었다(Fig. 1B). Fusarium 감염 여부를 확인하기 위해, 농가에서 채집한 모잘록 병징을 보이는 유묘와 그 주변에 발아된 후 탈락된 종피를 채집하여 F. oxysporum 특이 프라이머를 이용해 PCR 검정을 수행한 결과, 모잘록병으로 의심되는 유묘에서만 672 bp 크기의 밴드가 확인되었다(Fig. 1C). 검출된 PCR 산물의 염기서열 분석 및 NCBI BLAST search 한 결과, F. oxysporum과 유사도가 99.11%로 채집샘플의 모잘록 병징의 원인은 F. oxysporum에 의한 것으로 확인되었다.

Detection of Fusarium oxysporum from paprika seedlings in a greenhouse with symptoms of damping-off disease. (A) Symptomatic paprika seedlings (collected samples). (B) Conidia from hyphae isolated from the collected samples by microscope. (C) Detection of F. oxysporum from samples by polymerase chain reaction using primers specific for F. oxysporum. Yellow arrowheads indicate F. oxysporum band. Lane 1, healthy paprika seedling; Lanes 2-3, symptomatic paprika seedlings; Lanes 4-5, sporoderm of germinated seedlings; -, distilled water.
F. oxysporum이 검출된 파프리카 종자의 종자 감염 여부 확인.
같은 농가에서 동시 재배 중인 다른 파프리카 품종에서는 모잘록병이 발생하지 않았고, 문제 특정 시기에 생산되어 포장된 키씨 품종에서만 모잘록병이 발생하였으므로 키씨 품종에 대한 F. oxysporum의 감염 경로에 대한 원인 규명을 위해, 종자 채종시 F. oxysporum에 감염된 것인지 제품 포장 단계에서 오염된 것이지 여부를 확인하기 위한 실험을 진행하였다(Fig. 2). 표면살균 처리한 종자와 표면살균 처리하지 않은 무처리 종자를 각 100립씩 Murashige and Skoog (MS) 배지에 치상하고 각각 12일과 21일째에 종자를 관찰한 결과, 키씨 품종의 경우 표면살균 처리를 한 처리군 종자에서는 종자가 발아되었으나 무처리군에서는 전형적인 연한 핑크색의 Fusarium 곰팡이 균사가 발생하였으며, 표면살균 처리한 종자에 비해 21째에도 발아가 거의 이루어지지 않았다(Fig. 2A-D). 생물 현미경을 통해 곰팡이 포자를 관찰한 결과, 전형적인 F. oxysporum의 쌀알 모양인 소분생자(microconidia)와 격벽이 형성된 초승달 모양의 대분생자(macroconidia)가 확인되었다(Fig. 2E). MS 배지에 발생한 F. oxysporum의 여부를 다시 한번 확인하기 위해, 각 처리군에서 유모와 종자를 취하여 F. oxysporum 특이 프라이머를 이용해 PCR 검정을 수행한 결과, F. oxysporum이 발생한 종자살균 무처리 군에서 양성 밴드가 검출되었고(Fig. 3), 염기서열 분석으로 최종 F. oxysporum임을 확인하였다.
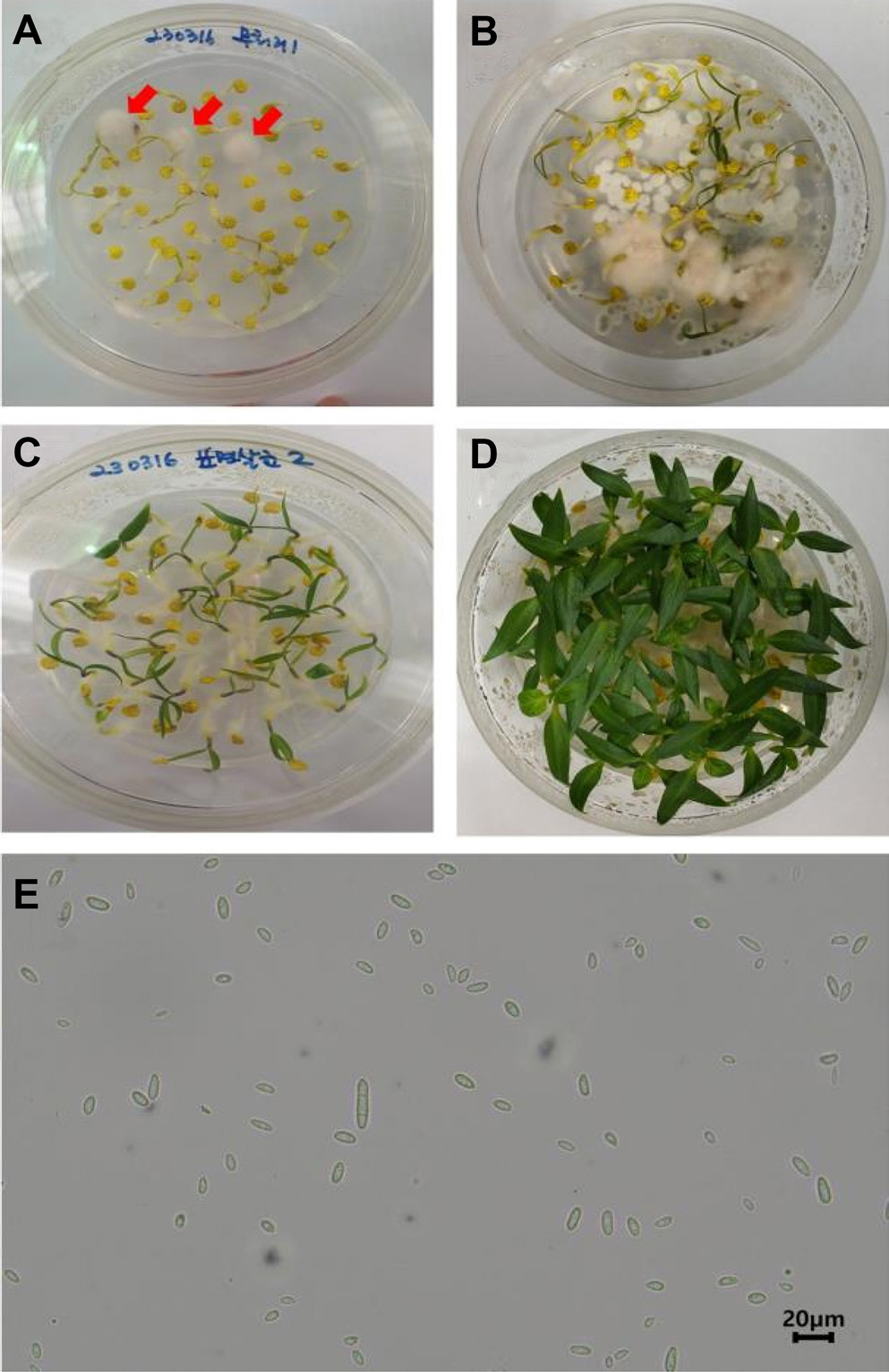
The occurrence of Fusarium oxysporum in disinfected and control paprika seedlings in Murashige and Skoog medium. (A) Non-disinfected seeds 12 days post-seeding (red arrows F. oxysporum). (B) Non-disinfected seeds 21 days post-seeding. (C) Disinfected seeds 12 days post-seeding. (D) Disinfected seeds 21 days post-seeding. (E) Occurrence of Fusarium sp. spores from hyphae isolated from non-disinfected seeds at 12 days post-seeding.
분리된 F. oxysporum의 병원성 검정.
농가 샘플에서 분리한 F. oxysporum 균주(F. oxysporum CW)의 병원성을 확인하기 위해, 건전 파프리카(품종: 아시아레드)에 F. oxysporum CW를 접종하고, 2주 후 결과를 확인하였다(Fig. 4). 그 결과, 무처리 건전 파프리카에서는 정상적으로 뿌리 생장과 지상부의 생장이 일어났으며(Fig. 4A), 반면에, F. oxysporum CW를 접종한 파프리카에서 줄기 하단부가 물러지고 암갈색으로 변색되면서 잘록해지는 전형적인 모잘록병 증상이 나타났으며, 점점 뿌리발육이 불량하여 성장하지 못하고 쓰러지는 증상이 나타났다(Fig. 4B). 모잘록 병이 발생한 파프리카에서 분리한 균사(F. oxysporum CW-2)를 PDA 배지에 배양한 뒤 현미경 관찰을 한 결과, 전형적인 F. oxysporum의 소분생자(microconidia)와 대분생자(macroconidia)가 확인되었다.

Detection of Fusarium oxysporum causing damping-off disease on Keessie seedlings by polymerase chain reaction (PCR). (A) Seed-lings from disinfected Keessie seeds. (B) Non-germinated seeds from non-disinfected Keessie seeds. (C) F. oxysporum was detected in non-geminated and non-disinfected Keessie seeds by PCR using primers specific for F. oxysporum (yellow arrowheads, F. oxysporum band). Lanes 1-5, seedlings from disinfected seeds; Lanes 6-10, non-germinated seeds from non-disinfected seeds; -, distilled water; +, F. oxysporum.
기존에 보고된 F. oxysporum과 분리 균주(F. oxysporum CW 와 CW-2) 간 분자계통학적 유연관계 분석.
초기 농가에서 모잘록병으로 의심되는 유묘에서 분리한 균주(F. oxysporum CW)와 건전 파프리카에 F. oxysporum CW를 접종하여 분리된 균주(F. oxysporum CW-2) 간 유사성을 확인하기 위해, 분자계통학적 유연관계를 분석하였다. 각 균주로부터 18S rRNA region 의 염기서열을 분석한 결과, 두 균주에서 F. oxysporum과 유사성이 99%로 확인되었고, 모두 중국의 비둘기콩에서 분리된 F. oxysporum (JF807401.1과 KU512835.1)이 포함된 계통군(clade)을 형성하였다(Fig. 5A, B). 따라서, 초기 농가에서 분리한 F. oxysporum CW와 건전 파프리카에 F. oxysporum CW를 접종하여 분리된 균주(F. oxysporum CW-2)는 동일한 것임을 확인하였다.2023년 철원군 파프리카 유묘에서 발생한 모잘록병 대발생의 원인이 종자 오염인지 2019년도에 첫 보고된 F. oysporum (MK732352)에 의한 농가 환경에서 발병된 것인지를 확인하기 위해, 먼저 F. oxysporum CW와 F. oxysporum CW-2를 채집 샘플과 생산 포장번호가 같은 미개봉된 파프리카 종자에서 분리한 F. oxysporum CW-S 간 분자계통학적 유연관계를 분석하였다(Fig. 5C). 그 결과, 세 균주에서 F. oxysporum과 유사성이 99%로 확인되었고, 모두 중국의 비둘기콩에서 분리된 F. oxysporum (JF807401.1과 KU512835.1)이 포함된 계통군(clade)을 형성하였고, 각 세 분리균주는 동일한 것임을 확인하였다(Fig. 5). 마지막으로, 2024년에 농가에서 분리된 F. oxysporum CW의 TEF 유전자에 대한 BLAST 결과 상동성이 높은 10개의 균주(DQ452430.1, DQ452432.1, KF928931.1, KP964909.1, KX822794.1, MK059958.1, MT809754.1, OP903519.1, OP918942.1, OQ241898.1)와 상동성이 낮은 1개 균주(OR466198.1) 그리고 Park 등(2019)에서 보고된 F. oxysporum (MK732352)을 포함하여 분자계통학적 유연관계를 분석하였다. 13개 F. oxysporum 균주 간 분자계통학적 유연관계를 분석한 결과, 분리된 균주(F. oxysporum CW)는 Park 등(2019)에서 보고된 분리균(MK732352)과 다른 clade로 양파(KP964909), 상추(MK059958), 스타티스(KX822794)에서 분리된 푸자리움과 같은 clade에 속하는 것으로 확인되었다(Fig. 6).
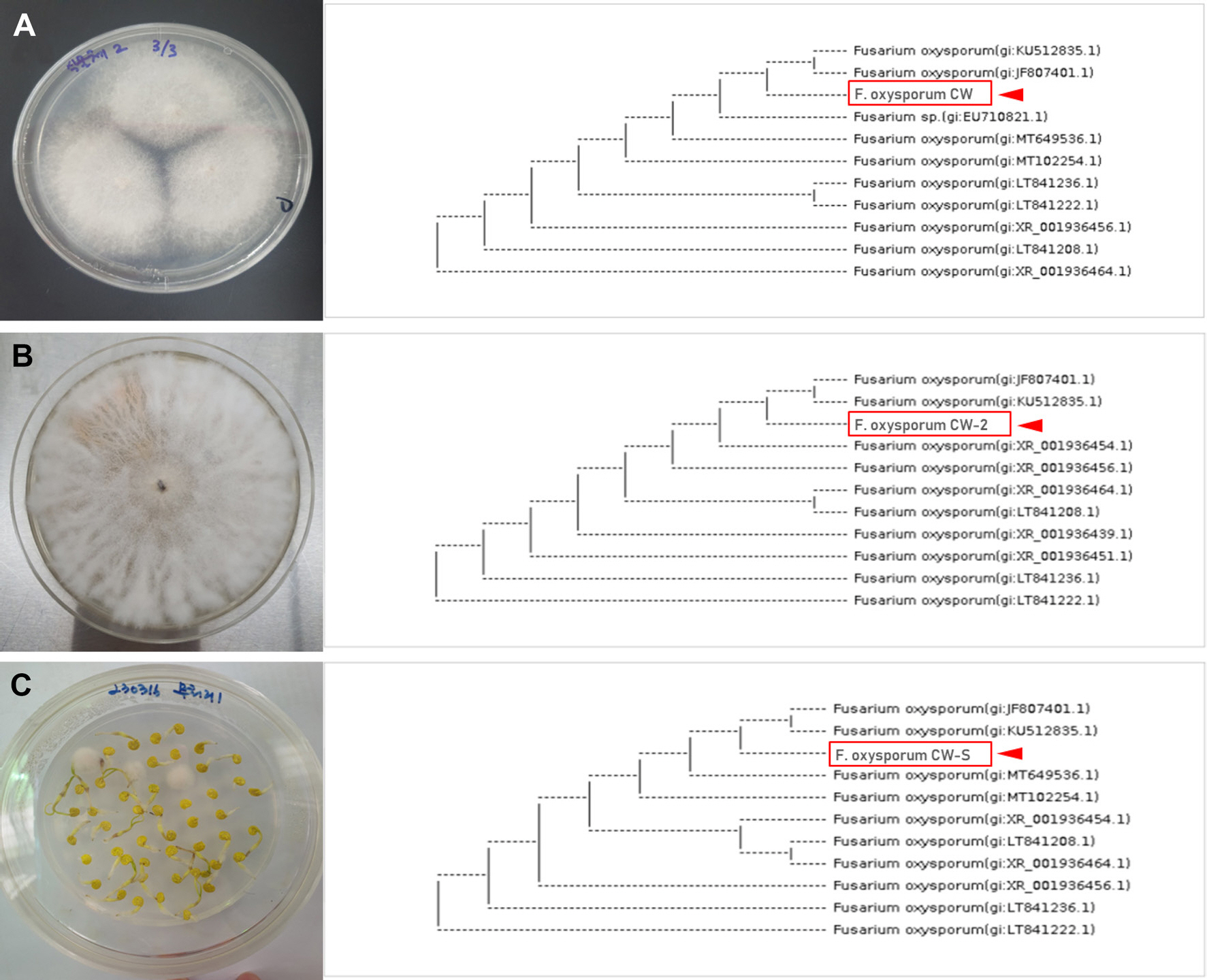
18S rRNA-based phylogenetic analysis using sequences from Fusarium oxysporum isolated from (A) symptomatic Keessie seedlings (F. oxysporum CW), (B) F. oxysporum CW-inoculated Asia red plants (F. oxysporum CW-2), (C) unopened Keessie seeds (F. oxysporum CW-S).

Translation elongation factor gene-based phylogenetic analysis using sequences from 13 Fusarium oxysporum isolates, including F. oxysporum CW (white arrowhead) and F. oxysporum MK732352 (black arrowhead).
따라서, 2023년 철원군 파프리카 농가에서 대발생한 모잘록병의 원인은 농가 환경에서 감염되어 병이 확산되어 대발생한 것이 아닌, F. oxysporum에 오염된 종자에 의해 철원군 파프리카 농가에 모잘록병이 발생한 것을 증명하였다.
고 찰
본 연구에서는 특정 기간에 생산 및 포장된 파프리카 키씨 품종을 파종한 철원군 74개 농가에서 파프리카 유묘의 줄기가 무르고 가늘어져서 쓰러지는 증상이 대발생하여 코흐의 가설(Koch's postulates)에 따라 모잘록병의 원인인 병원성 미생물을 확인하였다. 먼저 모잘록 병징이 있는 파프리카 유묘에서 곰팡이 균사를 채취하여 현미경으로 F. oxysporum의 포자를 관찰하였고, PCR로 증폭된 유전자의 염기서열 분석을 통하여 F. oxysporum임을 확인하였다(Fig. 1). 이후 모잘록병으로 의심되는 유묘에서 순수 분리한 F. oxysporum CW의 포자 현탁액을 다른 품종의 파프리카 접종하였을 때, 뿌리 발달 불량 및 줄기가 잘록해져서 쓰러져 생장하지 못하는 전형적인 모잘록병 증상이 관찰되었다(Fig. 4). 이러한 결과를 통하여, 농가에서 대발생한 모잘록병의 원인은 F. oxysporum임을 확인하였다.
2023년에 철원군에서 발생한 모잘록병 발생의 현상은 특정 품종에 한정되어 발생하고 있다는 역학 조사를 근거로 하여, 모잘록병이 특정 품종의 종자 표면 오염 및 채종 시 종자 감염 또는, 농가 환경에서 감염되어 대발생된 것인지에 대한 확인이 필요하였다. 따라서, 종자 오염 여부를 확인하기 위해 종자 검정을 수행하였고, 그 결과, 표면살균 처리한 파프리카 종자에서는 F. oxysporum이 발생하지 않은 반면, 표면살균을 하지 않은 무처리군에서 F. oxysporum이 확인되었으며, 종자 100립을 기준으로 5립에서 F. oxysporum의 균사가 배양되었다(Fig. 2, 3, Table 1). 추가적으로 키씨 품종 외에 다른 품종의 종자(아시아레드)를 적용하여 같은 방법으로 종자 검정을 수행하였으나, F. oxysporum는 배양되지 않았다(data not shown).
농가 샘플에서 분리한 최종적으로 모잘록병으로 의심되는 유묘에서 분리한 균주와 무처리 종자에서 분리한 균주 그리고 병원성 검정 후 분리한 균주의 18S rRNA 동정을 통하여 분자계통학적 유연관계를 분석한 결과, 중국의 비둘기콩에서 분리된 F. oxysporum (JF807401.1과 KU512835.1)이 포함된 동일한 clade에 속하는 것으로 모두 동일한 것임이 증명되었다(Fig. 5). 또한, F. oxysporum의 TEF 유전자 부분을 이용하여 2023년에 철원군 농가에서 분리된 F. oxysporum CW와 2019년에 보고된 F. oxysporum (MK732352)과 분자계통학적 유연관계를 분석한 결과, 두 분리 균주는 서로 다른 clade에 포함되어 있는 것을 확인함으로써(Fig. 6), 2023년 철원군 파프리카 농가에서 대발생한 모잘록병의 원인은 특성 시기에 생산 및 제조된 F. oxysporum에 오염된 종자에 의한 것으로 확인되었다.
식물 곰팡이병은 곤충, 토양, 잡초, 오염된 종자 및 오염된 농기구 등 다양한 방식으로 전염되고 다른 작물로 전파될 수 있다(Camó 등, 2019; Jain 등, 2019; Lazarovits 등, 2014). F. oxysporum은 작물이 재배되는 전 시기에 감염할 수 있으며, 감염된 식물은 관다발이 막혀 양분흡수가 불량하여 시들다가 결국에는 고사하게 됨으로 생산량 감소 및 경제적 피해를 유발한다. 또한, 넓은 기주범위를 갖는 F. oxysporum은 주변 작물에 확산되어 추가적인 피해를 일으킬 수 있다(Nalini 등, 2018).
종자 가격이 높은 파프리카의 경우, F. oxysporum에 의한 식물병 발생 시 다른 작물에 비해 더 큰 경제적 손실이 우려되며, 대부분의 종자가 해외에서 수입되는 만큼 오염된 종자로 인한 해외의 유해 식물 병원균의 유입이 우려됨으로 해외 종자 수입시 주의가 필요해 보인다.
이번 철원군 파프리카 농가에서 대발생한 모잘록병은 F. oxysporum에 오염된 종자의 유통으로 비롯된 것으로, 본 종자검정 실험(Figs. 2, 3)을 통해 오염된 종자에 표면살균 처리를 한 경우, F. oxysporum이 제거되어 0%의 발생률을 보여주는 만큼 종자소독의 중요성에 대한 인식의 제고가 필요하다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This research was supported in part by grants from Research Program funded by Cheorwon Agricultural Technology Center.