Aksenov, A. A., Pasamontes, A., Peirano, D. J., Zhao, W., Dandekar, A. M., Fiehn, O. et al. 2014. Detection of Huanglongbing disease using differential mobility spectrometry.
Anal. Chem. 86: 2481-2488.


Amavizca, E., Bashan, Y., Ryu, C.-M., Farag, M. A., Bebout, B. M. and de-Bashan, L. E. 2017. Enhanced performance of the microalga
Chlorella sorokiniana remotely induced by the plant growth-promoting bacteria
Azospirillum brasilense and
Bacillus pumilus.
Sci. Rep. 7: 41310.



Attaran, E., Rostás, M. and Zeier, J. 2008.
Pseudomonas syringae elic-its emission of the terpenoid (E,E)-4,8,12-trimethyl-1,3,7,11-tri-decatetraene in
Arabidopsis leaves via jasmonate signaling and expression of the terpene synthase TPS4.
Mol. Plant-Microbe Interact. 21: 1482-1497.


Audrain, B., Farag, M. A., Ryu, C.-M. and Ghigo, J.-M. 2015. Role of bacterial volatile compounds in bacterial biology.
FEMS Microbiol. Rev. 39: 222-233.


Avalos, M., van Wezel, G. P., Raaijmakers, J. M. and Garbeva, P. 2018. Healthy scents: microbial volatiles as new frontier in antibiotic research?
Curr. Opin. Microbiol. 45: 84-91.


Bakry, A. M., Abbas, S., Ali, B., Majeed, H., Abouelwafa, M. Y., Mousa, A. et al. 2016. Microencapsulation of oils: a comprehensive review of benefits, techniques, and applications.
Compr. Rev. Food Sci. Food Saf. 15: 143-182.


Banchio, E., Xie, X., Zhang, H. and Paré, P. W. 2009. Soil bacteria elevate essential oil accumulation and emissions in sweet basil.
J. Agric. Food Chem. 57: 653-657.


Beck, J. J., Porter, N., Cook, D., Gee, W. S., Griffith, C. M., Rands, A. D. et al. 2015. In-field volatile analysis employing a hand-held portable GC-MS: emission profiles differentiate damaged and undamaged yellow starthistle flower heads.
Phytochem. Anal. 26: 395-403.


Blake, R. S., Monks, P. S. and Ellis, A. M. 2009. Proton-transfer reaction mass spectrometry.
Chem. Rev. 109: 861-896.


Blasioli, S., Biondi, E., Samudrala, D., Spinelli, F., Cellini, A., Bertaccini, A. et al. 2014. Identification of volatile markers in potato brown rot and ring rot by combined GC-MS and PTR-MS techniques: study on
in vitro and
in vivo samples.
J. Agric. Food Chem. 62: 337-347.


Boland, W. 1995. The chemistry of gamete attraction: chemical structures, biosynthesis, and (a)biotic degradation of algal pheromones.
Proc. Natl. Acad. Sci. U. S. A. 92: 37-43.



Broberg, M., Lee, G. W., Nykyri, J., Lee, Y. H., Pirhonen, M. and Palva, E. T. 2014. The global response regulator ExpA controls virulence gene expression through RsmA-mediated and RsmA-independent pathways in
Pectobacterium wasabiae SCC3193.
Appl. Environ. Microbiol. 80: 1972-1984.



Buckley, A. M. and Greenblatt, M. 1994. The sol-gel preparation of silica gels.
J. Chem. Educ. 71: 599.

Bui, H. X., Hadi, B. A. R., Oliva, R. and Schroeder, N. E. 2020. Beneficial bacterial volatile compounds for the control of root-knot nema-tode and bacterial leaf blight on rice.
Crop Prot. 135: 104792.

Castelyn, H. D., Appelgryn, J. J., Mafa, M. S., Pretorius, Z. A. and Visser, B. 2014. Volatiles emitted by leaf rust infected wheat induce a defence response in exposed uninfected wheat seedlings.
Australas. Plant Pathol. 44: 245-254.

Cellini, A., Biondi, E., Buriani, G., Farneti, B., Rodriguez-Estrada, M. T., Braschi, I. et al. 2016. Characterization of volatile organic compounds emitted by kiwifruit plants infected with
Pseudomonas syringae pv.
actinidiae and their effects on host defences.
Trees 30: 795-806.

Cellini, A., Buriani, G., Rocchi, L., Rondelli, E., Savioli, S., Rodriguez Estrada, M. T. et al. 2018. Biological relevance of volatile organic compounds emitted during the pathogenic interactions between apple plants and
Erwinia amylovora.
Mol. Plant Pathol. 19: 158-168.


Cellini, A., Spinelli, F., Donati, I., Ryu, C.-M. and Kloepper, J. W. 2021. Bacterial volatile compound-based tools for crop management and quality.
Trends Plant Sci. 26: 968-983.


Chan, A. S., Valle, J. D., Lao, K., Malapit, C., Chua, M. and So, R. C. 2009. Evaluation of silica-gel microcapsule for the controlled release of insect repellent, N, N-diethyl-2-methoxybenzaimide, on cotton. Philipp. J. Sci. 138: 13-21.
Chinchilla, D., Bruisson, S., Meyer, S., Zühlke, D., Hirschfeld, C., Joller, C. et al. 2019. A sulfur-containing volatile emitted by potato-as-sociated bacteria confers protection against late blight through direct anti-oomycete activity.
Sci. Rep. 9: 18778.



Cho, G., Kim, J., Park, C. G., Nislow, C., Weller, D. M. and Kwak, Y.-S. 2017. Caryolan-1-ol, an antifungal volatile produced by
Streptomyces spp., inhibits the endomembrane system of fungi.
Open Biol. 7: 170075.



Choi, H. K., Song, G. C., Yi, H.-S. and Ryu, C.-M. 2014. Field evaluation of the bacterial volatile derivative 3-pentanol in priming for induced resistance in pepper.
J. Chem. Ecol. 40: 882-892.


Chung, J.-H., Song, G. C. and Ryu, C.-M. 2016. Sweet scents from good bacteria: case studies on bacterial volatile compounds for plant growth and immunity.
Plant Mol. Biol. 90: 677-687.


Contreras, J. A., Murray, J. A., Tolley, S. E., Oliphant, J. L., Tolley, H. D., Lammert, S. A. et al. 2008. Hand-portable gas chromatograph-toroidal ion trap mass spectrometer (GC-TMS) for detection of hazardous compounds.
J. Am. Soc. Mass Spectr. 19: 1425-1434.

Cortes-Barco, A. M., Goodwin, P. H. and Hsiang, T. 2010a. Comparison of induced resistance activated by benzothiadiazole, (2R,3R)-butanediol and an isoparaffin mixture against anthracnose of
Nicotiana benthamiana.
Plant Pathol. 59: 643-653.

Cortes-Barco, A. M., Hsiang, T. and Goodwin, P. H. 2010b. Induced systemic resistance against three foliar diseases of
Agrostis stolonifera by (
2R,3R)-butanediol or an isoparaffin mixture.
Ann. Appl. Biol. 157: 179-189.

D’Alessandro, M., Erb, M., Ton, J., Brandenburg, A., Karlen, D., Zopfi, J. et al. 2014. Volatiles produced by soilborne endophytic bacteria increase plant pathogen resistance and affect tritrophic interactions.
Plant Cell Environ. 37: 813-826.


Dandurishvili, N., Toklikishvili, N., Ovadis, M., Eliashvili, P., Giorgobiani, N., Keshelava, R. et al. 2011. Broad-range antagonistic rhizobacteria
Pseudomonas fluorescens and
Serratia plymuthica suppress
Agrobacterium crown gall tumours on tomato plants.
J. Appl. Microbiol. 110: 341-352.


Deng, C., Zhang, X. and Li, N. 2004. Investigation of volatile bio-markers in lung cancer blood using solid-phase microextraction and capillary gas chromatography-mass spectrometry.
J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 808: 269-277.


Elmassry, M. M. and Piechulla, B. 2020. Volatilomes of bacterial infections in humans.
Front. Neurosci. 14: 257.



Farag, M. A., Song, G. C., Park, Y.-S., Audrain, B., Lee, S., Ghigo, J.-M. et al. 2017. Biological and chemical strategies for exploring inter- and intra-kingdom communication mediated via bacterial volatile signals.
Nat. Protoc. 12: 1359-1377.


Fatima, S. and Anjum, T. 2017. Identification of a potential ISR determinant from
Pseudomonas aeruginosa PM12 against Fusarium wilt in tomato.
Front. Plant Sci. 8: 848.



Feron, G., Mauvais, G., Martin, F., Sémon, E. and Blin-Perrin, C. 2007. Microbial production of 4-hydroxybenzylidene acetone, the direct precursor of raspberry ketone.
Lett. Appl. Microbiol. 45: 29-35.


Frost, C. J., Appel, H. M., Carlson, J. E., De Moraes, C. M., Mescher, M. C. and Schultz, J. C. 2007. Within-plant signalling via volatiles overcomes vascular constraints on systemic signalling and primes responses against herbivores.
Ecol. Lett. 10: 490-498.


Garbeva, P. and Weisskopf, L. 2020. Airborne medicine: bacterial volatiles and their influence on plant health.
New Phytol. 226: 32-43.


Ghosh, S. K. 2006. Functional coatings and microencapsulation: a general perspective. In: Functional Coatings, ed. by S. K. Ghosh, pp. 1-28. Wiley-VCH Verlag, Weinheim, Germany.

Gong, A.-D., Wu, N.-N., Kong, X.-W., Zhang, Y.-M., Hu, M.-J., Gong, S.-J. et al. 2019. Inhibitory effect of volatiles emitted from
Alcaligenes faecalis N1-4 on
Aspergillus flavus and aflatoxins in storage.
Front. Microbiol. 10: 1419.



Han, S. H., Lee, S. J., Moon, J. H., Park, K. H., Yang, K. Y., Cho, B. H. et al. 2006. GacS-dependent production of 2R, 3R-butanediol by
Pseudomonas chlororaphis O6 is a major determinant for eliciting systemic resistance against
Erwinia carotovora but not against
Pseudomonas syringae pv.
tabaci in tobacco.
Mol. Plant-Microbe Interact. 19: 924-930.


Hao, H.-T., Zhao, X., Shang, Q.-H., Wang, Y., Guo, Z.-H., Zhang, Y.-B. et al. 2016. Comparative digital gene expression analysis of the
Arabidopsis response to volatiles emitted by
Bacillus amyloliquefaciens.
PLoS ONE 11: e0158621.



Havenga, W. J. and Rohwer, E. R. 2000. The use of SPME and GC-MS for the chemical characterisation and assessment of PAH pol-lution in aqueous environmental samples.
Int. J. Environ. Anal. Chem. 78: 205-221.

Heil, M. 2014. Herbivore-induced plant volatiles: targets, perception and unanswered questions.
New Phytol. 204: 297-306.

Heuskin, S., Lorge, S., Lognay, G., Wathelet, J.-P., Béra, F., Leroy, P. et al. 2012. A semiochemical slow-release formulation in a biological control approach to attract hoverflies.
J. Environ. Ecol. 3: 72-85.

Huang, C.-J., Tsay, J.-F., Chang, S.-Y., Yang, H.-P., Wu, W.-S. and Chen, C.-Y. 2012. Dimethyl disulfide is an induced systemic resistance elicitor produced by
Bacillus cereus C1L.
Pest Manag. Sci. 68: 1306-1310.


Huang, J., Cardoza, Y. J., Schmelz, E. A., Raina, R., Engelberth, J. and Tumlinson, J. H. 2003. Differential volatile emissions and salicylic acid levels from tobacco plants in response to different strains of
Pseudomonas syringae.
Planta 217: 767-775.


Jyothi, N. V. N., Prasanna, P. M., Sakarkar, S. N., Prabha, K. S., Ramaiah, P. S. and Srawan, G. Y. 2010. Microencapsulation techniques, factors influencing encapsulation efficiency.
J. Microencapsul. 27: 187-197.


Kai, M. and Piechulla, B. 2009. Plant growth promotion due to rhizobacterial volatiles: an effect of CO
2?
FEBS Lett. 583: 3473-3477.


Kim, K.-S., Lee, S. and Ryu, C.-M. 2013. Interspecific bacterial sensing through airborne signals modulates locomotion and drug resistance.
Nat. Commun. 4: 1809.


Kishimoto, K., Matsui, K., Ozawa, R. and Takabayashi, J. 2005. Volatile C6-aldehydes and Allo-ocimene activate defense genes and induce resistance against
Botrytis cinerea in
Arabidopsis thaliana.
Plant Cell Physiol. 46: 1093-1102.


Kishimoto, K., Matsui, K., Ozawa, R. and Takabayashi, J. 2006. Components of C6-aldehyde-induced resistance in
Arabidopsis thaliana against a necrotrophic fungal pathogen,
Botrytis cinerea.
Plant Sci. 170: 715-723.

Kishimoto, K., Matsui, K., Ozawa, R. and Takabayashi, J. 2007. Volatile 1-octen-3-ol induces a defensive response in
Arabidopsis thaliana.
J. Gen. Plant Pathol. 73: 35-37.

Kõiv, V., Andresen, L., Broberg, M., Frolova, J., Somervuo, P., Auvinen, P. et al. 2013. Lack of RsmA-mediated control results in constant hypervirulence, cell elongation, and hyperflagellation in
Pectobacterium wasabiae.
PLoS One 8: e54248.



Kong, H. G., Shin, T. S., Kim, T. H. and Ryu, C.-M. 2018. Stereoisomers of the bacterial volatile compound 2,3-butanediol differently elicit systemic defense responses of pepper against multiple viruses in the field.
Front. Plant Sci. 9: 90.



Lammers, A., Lalk, M. and Garbeva, P. 2022. Air ambulance: antimicrobial power of bacterial volatiles.
Antibiotics (Basel) 11: 109.



Ledger, T., Rojas, S., Timmermann, T., Pinedo, I., Poupin, M. J., Garrido, T. et al. 2016. Volatile-mediated effects predominate in
Paraburkholderia phytofirmans growth promotion and salt stress tolerance of
Arabidopsis thaliana.
Front. Microbiol. 7: 1838.



Lee, B., Farag, M. A., Park, H. B., Kloepper, J. W., Lee, S. H. and Ryu, C.-M. 2012. Induced resistance by a long-chain bacterial volatile: elicitation of plant systemic defense by a C13 volatile produced by
Paenibacillus polymyxa.
PLoS ONE 7: e48744.



Lemfack, M. C., Gohlke, B.-O., Toguem, S. M. T., Preissner, S., Piechulla, B. and Preissner, R. 2017. mVOC 2.0: a database of microbial volatiles.
Nucleic Acids Res. 46: D1261-D1265.


Li, Z., Paul, R., Ba Tis, T., Saville, A. C., Hansel, J. C., Yu, T. et al. 2019. Non-invasive plant disease diagnostics enabled by smart-phone-based fingerprinting of leaf volatiles.
Nat. Plants 5: 856-866.


Lindinger, W. and Jordan, A. 1998. Proton-transfer-reaction mass spectrometry (PTR-MS): online monitoring of volatile organic compounds at pptv levels.
Chem. Soc. Rev. 27: 347-375.

Lisec, J., Schauer, N., Kopka, J., Willmitzer, L. and Fernie, A. R. 2006. Gas chromatography mass spectrometry-based metabolite profiling in plants.
Nat. Protoc. 1: 387-396.


Lyu, A., Yang, L., Wu, M., Zhang, J. and Li, G. 2020. High efficacy of the volatile organic compounds of
Streptomyces yanglinensis 3-10 in suppression of
Aspergillus contamination on peanut kernels.
Front. Microbiol. 11: 142.



Maßberg, D. and Hatt, H. 2018. Human olfactory receptors: novel cellular functions outside of the nose.
Physiol. Rev. 98: 1739-1763.


Massawe, V. C., Hanif, A., Farzand, A., Mburu, D. K., Ochola, S. O., Wu, L. et al. 2018. Volatile compounds of endophytic
Bacillus spp. have biocontrol activity against
Sclerotinia sclerotiorum.
Phytopathology 108: 1373-1385.


Miekisch, W., Schubert, J. K. and Noeldge-Schomburg, G. F. E. 2004. Diagnostic potential of breath analysis: focus on volatile organic compounds.
Clin. Chim. Acta. 347: 25-39.


Naznin, H. A., Kiyohara, D., Kimura, M., Miyazawa, M., Shimizu, M. and Hyakumachi, M. 2014. Systemic resistance induced by volatile organic compounds emitted by plant growth-promoting fungi in
Arabidopsis thaliana.
PLoS One 9: e86882.



Ojaghian, M. R., Wang, L., Xie, G.-L. and Zhang, J.-Z. 2019. Effect of volatiles produced by
Trichoderma spp. on expression of glutathione transferase genes in
Sclerotinia sclerotiorum.
Biol. Control 136: 103999.

Peng, G., Zhao, X., Li, Y., Wang, R., Huang, Y. and Qi, G. 2019. Engi-neering
Bacillus velezensis with high production of acetoin primes strong induced systemic resistance in
Arabidopsis thaliana.
Microbiol. Res. 227: 126297.


Poveda, J. 2021. Beneficial effects of microbial volatile organic compounds (MVOCs) in plants.
Appl. Soil Ecol. 168: 104118.

Prosen, H. and Zupančič-Kralj, L. 1999. Solid-phase microextraction.
TrAC Trends Anal. Chem. 18: 272-282.

Rajer, F. U., Wu, H., Xie, Y., Xie, S., Raza, W., Tahir, H. A. S. et al. 2017. Volatile organic compounds produced by a soil-isolate,
Bacillus subtilis FA26 induce adverse ultra-structural changes to the cells of
Clavibacter michiganensis ssp.
sepedonicus, the causal agent of bacterial ring rot of potato.
Microbiology (Reading) 163: 523-530.


Raza, W., Ling, N., Liu, D., Wei, Z., Huang, Q. and Shen, Q. 2016a. Volatile organic compounds produced by
Pseudomonas fluorescens WR-1 restrict the growth and virulence traits of
Ralstonia solanacearum.
Microbiol. Res. 192: 103-113.


Raza, W., Ling, N., Yang, L., Huang, Q. and Shen, Q. 2016b. Response of tomato wilt pathogen
Ralstonia solanacearum to the volatile organic compounds produced by a biocontrol strain
Bacillus amyloliquefaciens SQR-9.
Sci. Rep. 6: 24856.



Rezende, D. C., Fialho, M. B., Brand, S. C., Blumer, S. and Pascholati, S. F. 2015. Antimicrobial activity of volatile organic compounds and their effect on lipid peroxidation and electrolyte loss in
Colletotrichum gloeosporioides and
Colletotrichum acutatum mycelia.
Afr. J. Microbiol. Res. 9: 1527-1535.

Rosenberg, M., Kopelman, I. J. and Talmon, Y. 1990. Factors affecting retention in spray-drying microencapsulation of volatile materials.
J. Agric. Food Chem. 38: 1288-1294.

Rudrappa, T., Biedrzycki, M. L., Kunjeti, S. G., Donofrio, N. M., Czymmek, K. J., Paré, P. W. et al. 2010. The rhizobacterial elicitor acetoin induces systemic resistance in
Arabidopsis thaliana.
Commun. Integr. Biol. 3: 130-138.



Ryu, C.-M., Farag, M. A., Hu, C.-H., Reddy, M. S., Kloepper, J. W. and Paré, P. W. 2004. Bacterial volatiles induce systemic resistance in
Arabidopsis.
Plant Physiol. 134: 1017-1026.




Ryu, C.-M., Farag, M. A., Hu, C.-H., Reddy, M. S., Wei, H.-X., Paré, P. W. et al. 2003. Bacterial volatiles promote growth in
Arabidopsis.
Proc. Natl. Acad. Sci. U. S. A. 100: 4927-4932.



Santoro, M. V., Zygadlo, J., Giordano, W. and Banchio, E. 2011. Volatile organic compounds from rhizobacteria increase biosynthesis of essential oils and growth parameters in peppermint (
Mentha piperita).
Plant Physiol. Biochem. 49: 1177-1182.


Santos, F. J. and Galceran, M. T. 2003. Modern developments in gas chromatography-mass spectrometry-based environmental analysis.
J. Chromatogr. A 1000: 125-151.


Scala, A., Allmann, S., Mirabella, R., Haring, M. A. and Schuurink, R. C. 2013. Green leaf volatiles: a plant's multifunctional weapon against herbivores and pathogens.
Int. J. Mol. Sci. 14: 17781-17811.



Schulz-Bohm, K., Gerards, S., Hundscheid, M., Melenhorst, J., de Boer, W. and Garbeva, P. 2018. Calling from distance: attraction of soil bacteria by plant root volatiles.
ISME J. 12: 1252-1262.



Schulz-Bohm, K., Martín-Sánchez, L. and Garbeva, P. 2017. Microbial volatiles: small molecules with an important role in intra- and inter-kingdom interactions.
Front. Microbiol. 8: 2484.



Schulz, S. and Dickschat, J. S. 2007. Bacterial volatiles: the smell of small organisms.
Nat. Prod. Rep. 24: 814-842.


Sharifi, R., Lee, S.-M. and Ryu, C.-M. 2018. Microbe-induced plant volatiles.
New Phytol. 220: 684-691.


Sharifi, R. and Ryu, C.-M. 2016. Are bacterial volatile compounds poisonous odors to a fungal pathogen
Botrytis cinerea, alarm signals to
Arabidopsis seedlings for eliciting induced resistance, or both?
Front. Microbiol. 7: 196.



Sharifi, R. and Ryu, C.-M. 2018. Biogenic volatile compounds for plant disease diagnosis and health improvement.
Plant Pathol. J. 34: 459-469.



Sholberg, P. and Randall, P. 2005. Hexanal vapor for postharvest decay control and aroma production in stored pome fruit. Phytopathology 95: S96.
Sholberg, P. and Randall, P. 2007. Fumigation of stored pome fruit with hexanal reduces blue and gray mold decay.
HortScience 42: 611-616.

Song, G. C., Riu, M. and Ryu, C.-M. 2019. Beyond the two compartments Petri-dish: optimising growth promotion and induced resistance in cucumber exposed to gaseous bacterial volatiles in a miniature greenhouse system.
Plant Methods 15: 9.



Song, G. C. and Ryu, C.-M. 2013. Two volatile organic compounds trigger plant self-defense against a bacterial pathogen and a sucking insect in cucumber under open field conditions.
Int. J. Mol. Sci. 14: 9803-9819.



Soottitantawat, A., Yoshii, H., Furuta, T., Ohkawara, M. and Linko, P. 2003. Microencapsulation by spray drying: influence of emulsion size on the retention of volatile compounds.
J. Food Sci. 68: 2256-2262.

Spinelli, F., Cellini, A., Vanneste, J. L., Rodriguez-Estrada, M. T., Costa, G., Savioli, S. et al. 2012. Emission of volatile compounds by
Erwinia amylovora: biological activity
in vitro and possible exploi-tation for bacterial identification.
Trees 26: 141-152.

Spinelli, F., Noferini, M., Vanneste, J. L. and Costa, G. 2010. Potential of the electronic-nose for the diagnosis of bacterial and fungal diseases in fruit trees.
EPPO Bull. 40: 59-67.

Sri, S., Seethadevi, A., Suria Prabha, K., Muthuprasanna, P. and Pavitra, P. 2012. Microencapsulation: a review. Int. J. Pharm. Bio Sci. 3: P509-P531.
Tahir, H. A. S., Gu, Q., Wu, H., Niu, Y., Huo, R. and Gao, X. 2017.
Bacillus volatiles adversely affect the physiology and ultra-structure of
Ralstonia solanacearum and induce systemic resistance in tobacco against bacterial wilt.
Sci. Rep. 7: 40481.




Tyagi, S., Lee, K.-J., Shukla, P. and Chae, J.-C. 2020. Dimethyl disulfide exerts antifungal activity against
Sclerotinia minor by damaging its membrane and induces systemic resistance in host plants.
Sci. Rep. 10: 6547.




Ul Hassan, M. N., Zainal, Z. and Ismail, I. 2015. Green leaf volatiles: biosynthesis, biological functions and their applications in biotechnology.
Plant Biotechnol. J. 13: 727-739.


Vandendriessche, T., Keulemans, J., Geeraerd, A., Nicolai, B. M. and Hertog, M. L. A. T. M. 2012. Evaluation of fast volatile analysis for detection of
Botrytis cinerea infections in strawberry.
Food Microbiol. 32: 406-414.


Velázquez-Becerra, C., Macías-Rodríguez, L. I., López-Bucio, J., Flores-Cortez, I., Santoyo, G., Hernández-Soberano, C. et al. 2013. The rhizobacterium
Arthrobacter agilis produces dimethylhexadecylamine, a compound that inhibits growth of phytopathogenic fungi
in vitro.
Protoplasma 250: 1251-1262.


Weise, T., Kai, M., Gummesson, A., Troeger, A., von Reuss, S., Piepen-born, S. et al. 2012. Volatile organic compounds produced by the phytopathogenic bacterium
Xanthomonas campestris pv.
vesicatoria 85-10.
Beilstein J. Org. Chem. 8: 579-596.



Weisskopf, L., Schulz, S. and Garbeva, P. 2021. Microbial volatile organic compounds in intra-kingdom and inter-kingdom interactions.
Nat. Rev. Microbiol. 19: 391-404.


Xiao, Z., Liu, W., Zhu, G., Zhou, R. and Niu, Y. 2014. A review of the preparation and application of flavour and essential oils microcapsules based on complex coacervation technology.
J. Sci. Food Agric. 94: 1482-1494.


Xie, S., Zang, H., Wu, H., Uddin Rajer, F. and Gao, X. 2018. Antibacterial effects of volatiles produced by
Bacillus strain D13 against
Xanthomonas oryzae pv.
oryzae.
Mol. Plant Pathol. 19: 49-58.


Yang, M., Lu, L., Pang, J., Hu, Y., Guo, Q., Li, Z. et al. 2019. Biocontrol activity of volatile organic compounds from
Streptomyces alboflavus TD-1 against
Aspergillus flavus growth and aflatoxin production.
J. Microbiol. 57: 396-404.


Yu, Y. T., Liu, L. N., Zhu, X. L. and Kong, X. Z. 2012. Microencapsulation of dodecyl acetate by complex coacervation of whey protein with acacia gum and its release behavior.
Chin. Chem. Lett. 23: 847-850.

Zada, A., Falach, L. and Byers, J. A. 2009. Development of sol-gel formulations for slow release of pheromones.
Chemoecology 19: 37-45.

Zhang, C., Zhang, M., Yan, Z., Wang, F., Yuan, X., Zhao, S. et al. 2021. CO
2 is a key constituent of the plant growth-promoting volatiles generated by bacteria in a sealed system.
Plant Cell Rep. 40: 59-68.


Zhang, Y., Li, T., Liu, Y., Li, X., Zhang, C., Feng, Z. et al. 2019. Volatile organic compounds produced by
Pseudomonas chlororaphis subsp.
aureofaciens SPS-41 as biological fumigants to control
Ceratocystis fimbriata in postharvest sweet potatoes.
J. Agric. Food Chem. 67: 3702-3710.


Zhao, P., Li, P., Wu, S., Zhou, M., Zhi, R. and Gao, H. 2019. Volatile organic compounds (VOCs) from
Bacillus subtilis CF-3 reduce anthracnose and elicit active defense responses in harvested litchi fruits.
AMB Express 9: 119.




Zhou, J.-Y., Li, X., Zheng, J.-Y. and Dai, C.-C. 2016. Volatiles released by endophytic
Pseudomonas fluorescens promoting the growth and volatile oil accumulation in
Atractylodes lancea.
Plant Physiol. Biochem. 101: 132-140.


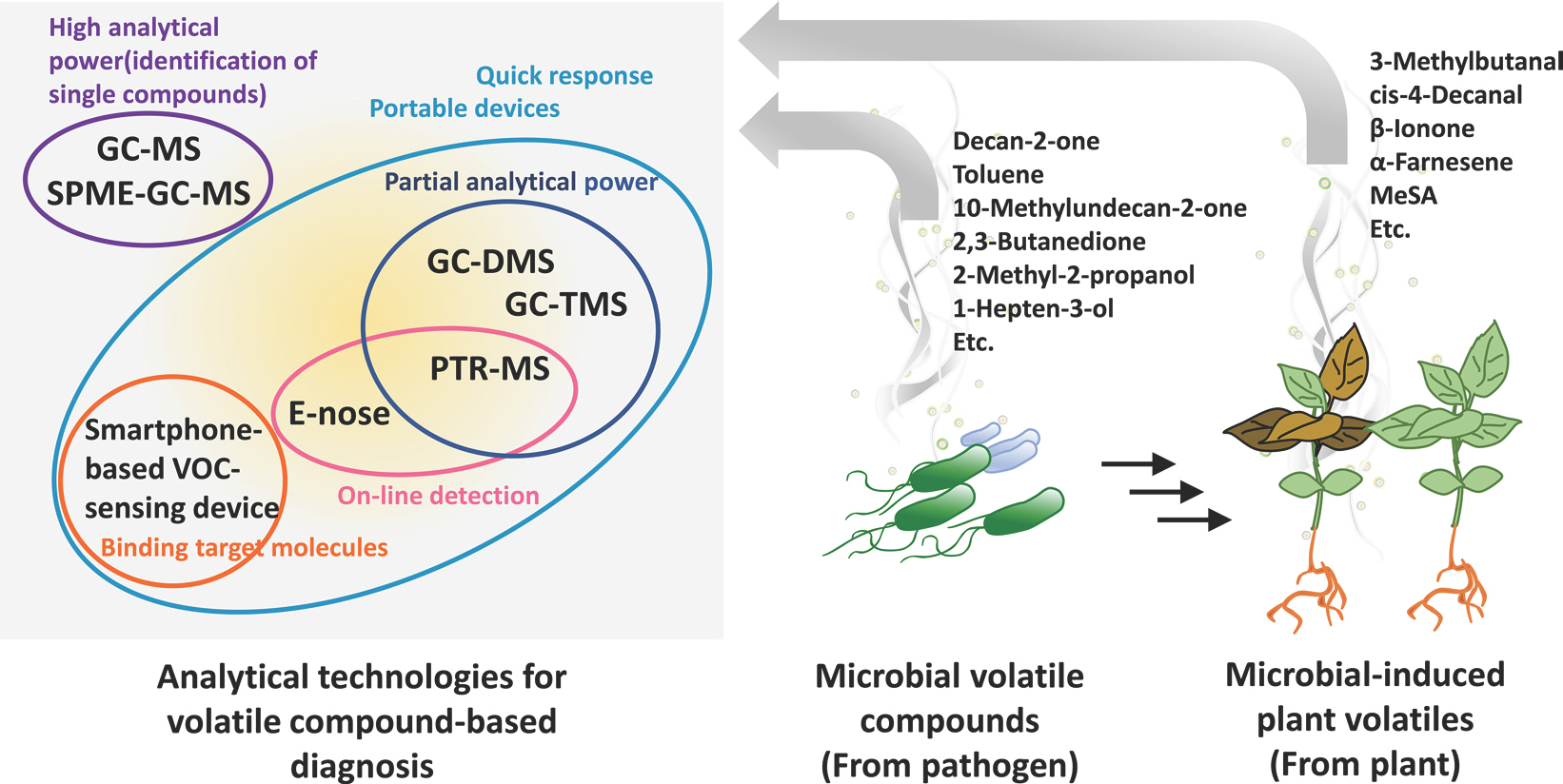
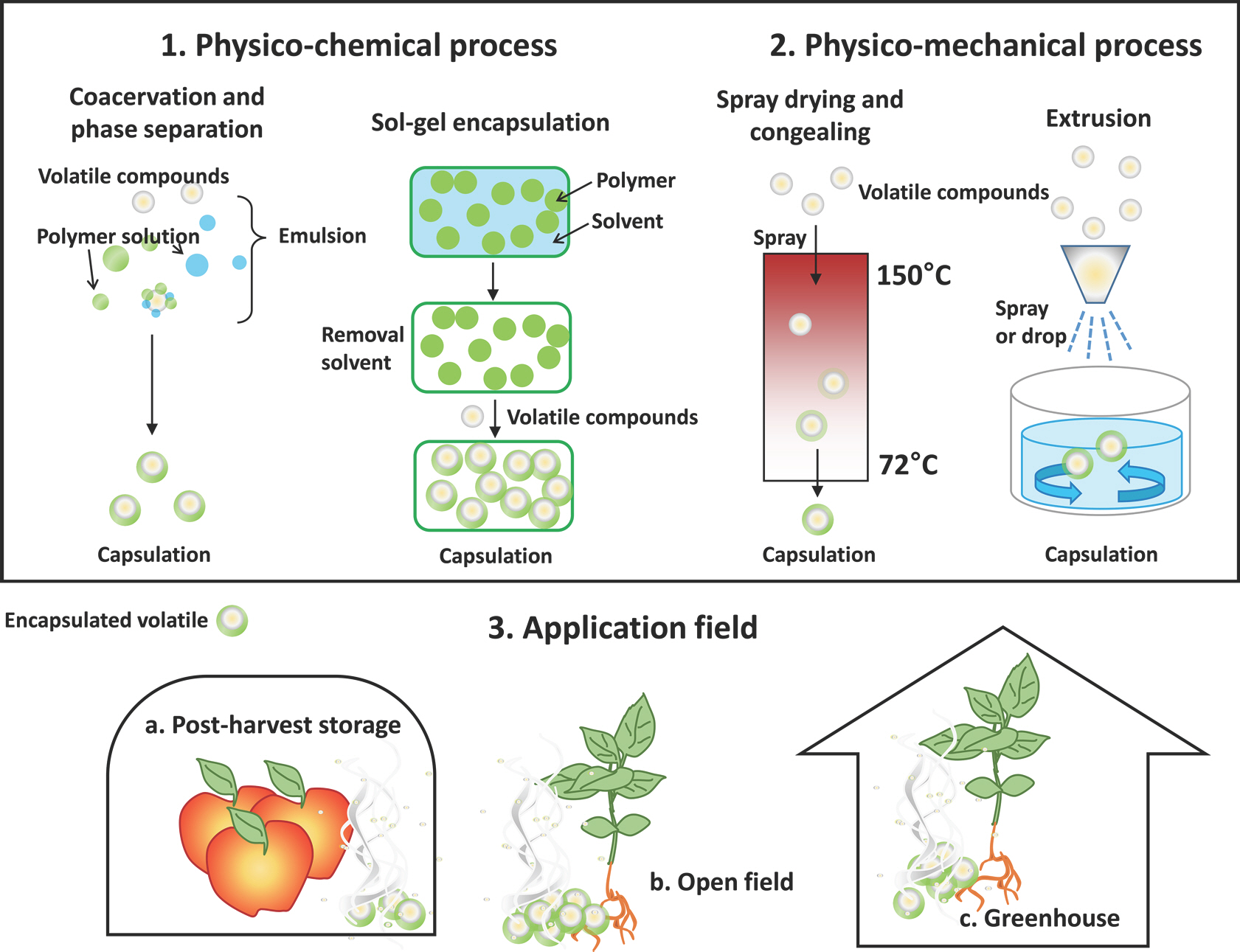




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






