서론
식물은 움직이지 못하는 단점을 극복하기 위하여 외부 자극이나 스트레스에 대한 민감한 반응을 통하여 지구상에 생존해왔다(Brooker 등, 2008). 이러한 자극이나 스트레스 중에서 미생물에 의한 병은 식물이 존재하기 위하여 극복해야 할 중요한 생존 전략이다. 지금까지 동물처럼 순환계를 가지고 있지않는 식물체가 한 부분에서 일어나는 반응을 식물 전체에 어떻게 전달하며 이러한 신호전달 기전이 어떻게 일어 나는지에 대한 의문은 많은 식물병리학자들에게 있어 숙제로 남아 있었다(Agrios, 2004; Ausubel, 2005). 1961년 Ross 박사가 발표한 두 편의 논문에서 담배에 과민감반응(Hypersensitive response, HR)을 일으키는 Tobacco necrosis virus(TNV)를 먼저 접종하고 1주일 후에 다른 종류의 바이러스를 접종했을 때 병 발생이 현저해 줄어드는 것을 관찰하여 이를 전신획득저항성(systemic acquired resistance, SAR)이라고 지칭하였다(Ross, 1961a,b). 표현형으로 동물에서 일어나는 항체-항원반응에 의한 백신반응과 비슷하지만 당시 동물과 비교하는 것을 생각하지 못했다. 1982년 Joseph Kuc가 “Induced immunity against plant disease”라는 논문을 발표 했을 때 많은 이들은 식물에 과연 “면역(immunity)”라는 단어가 합당한지에 대한 논의가 일었을 정도이다(Kuc, 1982). 다양한 물질에 의한 식물의 유도저항성(induced resistance)를 연구하면서 기존에 알고 있던 많은 물질들이 전신획득저항성을 유도하는 인자들이 보고되었다(Hammerschmidt와 Nicholson, 1999; Hammerschmidt와 Yang-Cashman, 1995). 1991년에는 식물의 뿌리 주위(근권)에 생존하는 세균 중에 식물의 생장을 촉진시키는 일명 식물생장촉진근권세균(plant growth-promoting rhizobacteria, PGPR)에 의해서도 전신획득저항성(SAR)과 비슷한 저항성 반응이 일어나는 것을 Kloepper 그룹에서 발표하여 병원균이 아닌 유용미생물에 의해서도 전신저항성이 유도되는 것을 밝혔고 이를 유도전신저항성(induced systemic resistance, ISR)로 명명하였다(Kloepper 등, 2004; Wei 등, 1991).
이후 20세기 후반 미생물과 식물의 유전체 연구가 가속화 되고 각각의 유전체 지도가 완성되면서 이러한 식물-미생물 상호작용에서 식물면역에 관련된 일들이 시스템생물학적 관점에서 바라보게 되었다(Koornneef와 Meinke, 2010). 가장 괄목할 만한 발전은 애기장대(Arabidopsis thaliana)라는 모델 식물의 유전체분석(genome sequencing)과 돌연변이체은행(Arabidopsis Stock Centers, www.arabidopsis.org/portals/mutants/stockcenters.jsp) 설립이다(Somerville와 Koornneef, 2002). 애기장대를 통하여 지금까지 우리가 알지 못했던 식물-미생물 상호작용의 새로운 현상들을 이해하게 되는 계기가 되었다(Nishimura와 Dangl, 2010). 그 중에 식물면역과 관련된 가장 획기적인 발견은 식물의 선모 단백질 수용체(flagellin receptor) 이다. 식물에서 최초로 식물병원성 세균의 선모를 형성하는 flagellin 중 22개의 단백질이 세균의 종류에 상관없이 일정하며 이러한 분자 패턴(molecular pattern)을 인식하는 식물의 인식체(receptor)를 규명하였다(Gomez-Gomez와 Boller, 2000). 이후 세균에 일반적인 elongation factor Tu(EF-Tu)도 식물이 인식하는 패턴인 것이 밝혀졌다(Zipfel 등, 2006). 이러한 발견은 이미 동물에서 이 flagellin 수용체가 발견되어 있어 이 수용체와 그 하위단계의 신호전달체계와의 유사성 때문에 식물도 동물이 가지고 있는 선천면역(innate immunity)를 가지고 있다는 것을 최초로 증명한 것이다(Ausubel, 2005). 이후 식물병원균이 가지고 있는 일반적인 인자를 인식하는 식물의 다양한 수용체들(pattern recognition receptors, PRR)이 발견되었다(Zipfel, 2008).
식물병리학적 측면에서 바라보면 이러한 식물면역 증진은 다양한 식물병으로부터 식물을 보호하는 획기적인 방법이 될 수 있다(Pieterse 등, 2014). 식물면역 증진을 통한 식물병 방제는 기존의 화학농약이 가지고 있는 독성, 환경오염, 저항성균의 출현 등 여러 가지 문제점을 극복할 수 있는 대안으로 인식되고 있다(Kloepper 등, 2004; Pieterse 등, 2014). 이 방법의 가장 큰 특징은 1) 한번 처리로 장기간 효과가 지속된다는 것과 2) 다양한 병원균에 대하여 광범위한 방제효과를 보인다는 것이다(Kloepper 등, 2004; van Loon 등, 1998). 하지만 식물의 면역을 과도하게 증진시켰을 경우 식물의 생장이 억제되는 약해가 발생하는 경우가 있다는 문제점도 있다(Heil, 1999). 이를 생태학적으로 식물에너지보존이론(allocation fitness cost)로 설명하는데 ‘식물은 한정된 에너지를 가지고 있다고 전제하고 면역 증진에 과도한 에너지를 사용함으로써 생장에 필요한 에너지가 부족하여 생장이 감소한다’는 가설이다. 대표적인 물질로 신젠타에서 개발했던 비온(Bion®)이라는 상품명을 가진 acibenzolar-S-methyl로 밀과 고추에 처리시 급격한 수확량의 감소를 가져오는 것이 보고되었다(Choi 등, 2014; Heil, 1999; 2001; Heil와 Baldwin, 2002; Heil 등, 2000). 그렇다면 이러한 문제를 극복할 수 있는 방법은 없을까? 그 해결책으로 제시된 것이 앞서 언급한 식물생장촉진근권세균에의한 유도전신저항성(ISR)이다. 기존의 SAR과 달리 ISR은 식물의 생장에 대한 약해없이 면역반응을 유도하기 때문에 농업에 지속가능한 농법으로 새롭게 조명되고 있다. 그 기작에 대하여 아직 연구가 많이 되어 있지 않지만 식물이 에너지 효율을 극대화 하기 위하여 면역을 지속해서 유도하는 것이 아니라 병원균의 침입 시에만 강하고 빠르게 반응하는 독특한 저항성 반응 기전을 가지는데 이를 방어 프라이밍(defense priming)이라고 부른다(Conrath 등, 2006).
본 리뷰에서는 최근 지금까지 알려진 미생물 유래 식물 면역증진 물질을 소개하고 이를 농업에 활용할 수 있는 방안을 모색하는데 목적이 있다. 앞서 비슷한 리뷰에서 다루지 않았던 진균, 세균, 바이러스유래 식물면역 증진 물질들을 10가지 그룹으로 나누고 각 그룹에 해당하는 인자들의 예와 면역유도방법과 포장적용 시험, 기전연구를 중심으로 기술하였다(De Vleesschauwer와 Hofte, 2009).
Fig. 1
New dimension of biological control through the elicitation of plant immunity by microbial determinants. Following the recognition of microbial determinants, plants augment plant immune responses via. signaling transduction and exhibit self-protection against broad spectrum of plant pathogens.
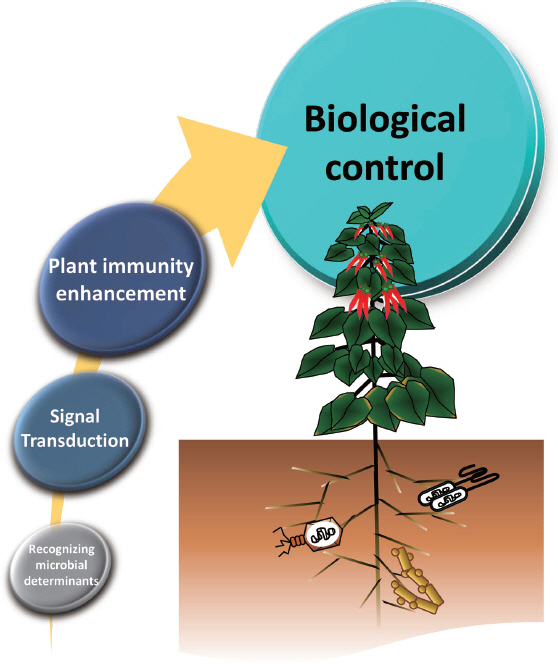
생물적 방제의 새로운 프레임: 미생물에 의한 식물면역
이번 세션에서는 바이러스, 세균, 진균에 의한 식물면역유도에 대하여 기술하겠다. 식물면역의 필요충분조건은 먼저 처리하는 미생물이나 그 결정인자가 병원균과 공간적으로 분리되어야 한다. 그리고 보통 병원균 접종 전 3-7일 전 미생물이나 결정인자를 처리한다(Kloepper 등, 2004; Ross, 1961a,b).
바이러스에 의한 식물면역 증진
앞서 언급한 바와 같이 1961년 Ross의 실험을 통하여 TNV 처리에 의해서 다양한 다른 종의 바이러스에 대한 식물 면역이 일어나는 것을 보고하기 이전에(Ross, 1961a; b) 이미 1920년대에 교차저항성(cross-protection)의 개념이 존재하고 있었다(Holmes, 1929; McKinney, 1926). 바이러스 감염에 의한 다른 바이러스에 대한 면역은 아주 긴 역사를 가지고 있다(Fletcher, 1978; Hugues 와 Ollennu, 1994; Kosaka 등, 2006; Kurth 등, 2012; McKinney, 1926; Nakazono-Nagaoka 등, 2009; Valkonen 등, 2002; Wen 등, 1991; You 등, 2005; Yoon 등, 2006). Ross 이후 바이러스 뿐만 아니라 다양한 병과 작물에 대한 적용 확대 실험이 진행되었다. 오이 모델로 진행된 실험에서 TNV를 처리후 탄저병원균인 Colletotrichum lagenarium(Coutte와 Wagih, 1983)에 대한 면역뿐만 아니라 절대기생체인, 흰가루병원균인 Sphaerotheca fuliginea(Bashan와 Cohen, 1982; Conti 등, 1990)와 Pseudoperonospora cubensis (Okuno 등, 1991)에 대한 면역 증진도 보고되었다. 최근에는 Citrus tristeza virus(CTV)에 의해서 발생하는 트리스테자병(tristeza disease)의 효과적인 방제를 위하여 약독 CTV를 전처리 함으로서 성공적으로 이 병을 방제하거나 CTV 저항성 대목을 사용한 예가 대표적이다(Lee와 Keremane, 2013).
이 밖에도 RNA 간섭을 이용한 효과적인 방제 전략으로 병원성 바이러스의 유전자 조각을 비병원성 바이러스에 삽입하여 식물이 병원성 바이러스로부터 보호하려는 시도가 이루어 지고 있다(Bazzini 등, 2006; Culver, 1996; Taki 등, 2013; Tamura 등, 2013). 여기서 가장 많이 사용되는 비병원성 바이러스는 Apple latent spherical cheravirus(ALSV)로 광범위한 기주 범위를 가지면서 전혀 병징을 나타내지 않는 특징을 가지고 있다(Taki 등, 2013; Tamura 등, 2013). 앞으로 유전자 조작의 문제를 극복한다면 포장에서 사용될 수 있을 가능성도 높다.
식물이 바이러스병을 억제하는 기전은 최근 연구를 바탕으로 크게 4가지로 분류할 수 있다(Valérie Nicaise, 2014). 1) Dominant 저항성, 2) Recessive 저항성, 3) RNA 간섭, 4) 식물호르몬에 의한 유전자발현이 그것인데 바이러스에 대한 식물면역 증진의 가능한 기전으로는 RNA 간섭과 호르몬 기반 저항성발현이다. 하지만 아직까지 이 부분에 대한 자세한 연구가 부족한 실정이다. 바이러스에 의한 식물면역(SAR)의 신호 전달 물질로 최근 들어 salicylic acid의 휘발성형태로 알려진 methyl salicylate의 역할이 대두되었고, 식물 전신으로 신호가 전달될 때 중요한 역할을 하는 것이 밝혀졌다(Dempsey와 Klessig, 2012; Park 등, 2007; Vlot 등, 2008).
세균에 의한 식물면역 증진
미생물 중에서 세균에 의한 식물의 면역증진은 비병원성 근권세균에 대한 연구가 주로 알려졌다. 식물생장촉진근권세균(PGPR)이 식물의 전신저항성을 유도한다는 연구결과가 보고되면서, 유용세균에 의한 식물의 면역증진 효과가 생물학적인 방제법으로 주목받았다(Klopper 등, 1991; Klopper 등, 2004; van Loon, 2007). PGPR은 Bacillus 종, Pseudomonas 종, Serratia 종(Bakker 등, 2007; Klopper 등, 2004; Pieterse 등, 2014) 등에서 다양하게 보고되었다. 세균에 의한 식물의 면역증진은 PGPR 뿐만 아니라, 병원성 세균에 의해 유도되는 식물저항성이 보고되고 있다(Boller와 Felix, 2009). 앞서 언급한 바와 같이 병원균에서 유래된 flagella의 핵심 도메인인flg22가 식물의 PAMP triggered immunity(PTI) 반응을 일으킨다는 것이 중요한 사례이다(Gomez-Gomez와 Boller, 2000).
여러 연구를 통하여 세균에 의한 면역증진 기작으로 다양한 요인들이 거론되고 있다. 먼저 Pseudomonas 종이 생산하는 항생물질을 통한 면역 증진 작용이 보고되었다. 근권세균이 생산하는 phenazine (Lugtenberg와 Kamilova, 2009; Mavrodi 등, 2006), 2,4-diacyl phloroglucinol(Thomashow, 1996), pyoluteorin과 pyrrolnitrin(Kirner 등, 1998; Nowak-Tompson 등, 1999) 등은 병원균에 대한 식물의 면역 증진을 통하여 식물을 보호하는 것으로 알려졌다. Bacillus 종에서 발생하는 휘발성 물질과 그람음성세균의 정족수 인식에 사용되는 N-acyl-homoserine lactone이 식물의 면역 증진에 기여하는 것으로 보고되었다(Pierson 등, 1998; Ryu 등, 2004). 그 외에도 세균의 세포벽 구성성분들인 lipopolysaccharides(LPS), 세균의 salicylic acid와 siderophore 등의 외부 분비물질도 식물 면역 증진의 결정인자로 알려져 있다(De Vleesschauwer와 Hofte, 2009; Lugtenberg와 Kamilova 2009). 신호전달 측면에서 ISR과 SAR은 각각 jasmonic acid과 salicylic acid의 서로 다른 식물호르몬을 요구하는 것으로 알려져 있지만, ISR을 일으키는 근권세균이 salicylic acid을 생산하는 결과를 보여 예외도 존재하는 것으로 알려져있다(Farag 등, 2013; Klopper, 2004; van Loon, 2007).
진균에 의한 식물면역 증진
식물면역 증진을 보이는 진균은 크게 공생관계를 가지고 있는 균근균(mycorrhizal fungi)과 PGPR과 유사한 부생균인 식물생장촉진근권진균(plant growth-promoting fungi, PGPF)로 구분할 수 있다. 균근균은 식물의 뿌리 조직 또는 뿌리 세포 내에서 공생을 하는 진균류로, 육상 식물의 80%는 균근균과 공생을 한다(Schüßler 등, 2001). 공생을 통해 균근균은 식물로부터 영양 성분들을 받고 (Smith와 Smith, 2011), 식물은 균근균에 의해 인산과 같은 영양분의 획득과 환경스트레스와 식물 병원균에 대한 저항성이 증진된다(Cordier 등, 1998; Harrison, 1999; Hause와 Fester, 2005; Pozo 등, 2002; Pozo와 Azcón-Aguilar, 2007). 균근균에 의한 식물 면역 유도는 진균, 난균, 세균뿐만 아니라 바이러스까지 효과를 보이며, 지상부 병원균뿐만 아니라, 토양 전염성 병원균에 대한 효과적인 병 방제 결과도 보고되었다(Ahmed 등, 2000; Bigirimana 등, 1998; De Meyer 등, 1998; Harman 등, 2004a; Harman 등, 2004b; Koike 등, 2001; Lo 등, 2000; Serfling 등, 2007; Stein 등, 2008; Waller 등, 2008; Yedidia 등, 2003). 이러한 면역 유도 반응은 균근균에 의해 방어 프라이밍이 유도되어 오랜 기간 동안 저항성 반응이 유지되는 것으로 보고되었다(Campos-Soriano 등, 2012). 균근균에 의한 식물 면역 증진 기작은 식물 정착 시기에 따라 조절되는데(Pozo와 Azcón-Aguilar, 2007), 공생과정 초기에는 식물의 salicylic acid을 증가시켜 활물기생 병원체(biotroph)에 대한 면역 기작을 증진시키고(Güimil 등, 2005; Paszkowski, 2006), 후기에는 식물 내 jasmonic acid 생산을 촉진하여 사물병원균(necrotroph)과 곤충에 대한 저항성이 증가된다(Howe와 Jander, 2008; Pozo 등, 2009). 이와 같은 과정을 통해 식물이 생산하는 salicylic acid 와 jasmonic acid는 균근균의 식물 정착에도 중요한 작용을 하는 것으로 보인다(de Román 등, 2011; Hause 등, 2002; 2007; Hause와 Schaarschmidt, 2009; Herrera-Medina 등, 2003).
PGPF는 식물과 공생하는 균근균(mycorrhizal fungi)과는 달리 근권 토양이나 식물 뿌리 표면에서 군집화하는 비공생적 부생영양 진균류이다. 자낭균류(Penicillium, Trichoderma, Fusarium, Phoma, Gliocladium)와 난균류(Pythium)가 PGPF로 보고되었으며(Bent, 2006; De Meyer 등, 1998; Harman 등, 2004b), PGPF에 의한 식물의 면역 증진 반응에 대해 많은 연구가 이루어졌다. 비병원성 Fusaruim oxysporium과 Trichoderma 종에 의해 식물의 면역 반응이 유도되어 모잘록 병원균인 Pythium ultimum에 대한 저항성이 증진되는 것이 보고되었다(Benhamou 등, 2002; de Meyer 등, 1998). 또한 Piriformospora indica와 Trichoderma viride에서 ISR에 의한 병 저항성이 밝혀졌다(Engelberth 등, 2001; Korolev 등, 2008; Segarra 등, 2007; Viterbo 등, 2007). 그리고 Penicillium janczewskii의 멸균 배양 여과액을 처리하였을 때, 메론과 목화, 담배에서 ISR이 유도되었다(Koike 등, 2001; Madi와 Katan, 1998).
Penicillium sp. GP16-2, T. harzianum T39, P. indica 등의 PGPF에 의한 면역 증진 기작은 모델 식물인 애기장대를 이용한 연구를 통해서 jasmonic acid와 ethylene 신호전달기작에 의한 면역 반응이 중요한 역할을 하는 것으로 밝혀졌다(Hossain 등, 2008; Korolev 등, 2008; Stein 등, 2008). 균근균과 마찬가지로 대표적인 PGPF인 P. indica에 의해 방어 프라이밍이 유도되었다(Pieterse 등, 2000; 2001; Stein 등, 2008; Waller 등, 2008).
물적 방제의 은색 탄환(silver bullet): 식물면역증진 미생물 결정 인자
본 세션에서는 식물면역 증진이 보고된 미생물의 결정인자를 외부 구조(진균: chitin, glucan; 세균: LPS, EPS, flagella)와 대사 산물(식물호르몬 유사체, 항생물질, 정족수 인식물질, 비타민, 분비단백질, 휘발성물질)로 나누어 기술하였다(Fig. 2, Table 1).
Fig. 2
Microbial determinants from fungi, bacteria, and viruses for eliciting plant immunity. Essential epitope produced from vitamins, antibiotics, phytohormones, lipopolysaccharides/extracellular polysaccharides (LPS/EPS), volatile organic compounds (VOC), N-acyl homoserine lactone (AHL) from bacteria, cell wall components from fungi and nucleotides from virus are presented. Microbe/pathogen-associated molecular pattern (MAMP/PAMP) (e.g. flagellin) was recognized by pattern recognition receptor (e.g. FLS2). Perception of microbial determinants in plant activates signaling transduction and immune responses against fungi, bacteria, and viruses. Four clades for the augmentation of plant immunity were classified as microbes, microbial determinants, plant recognition, and immune responses.
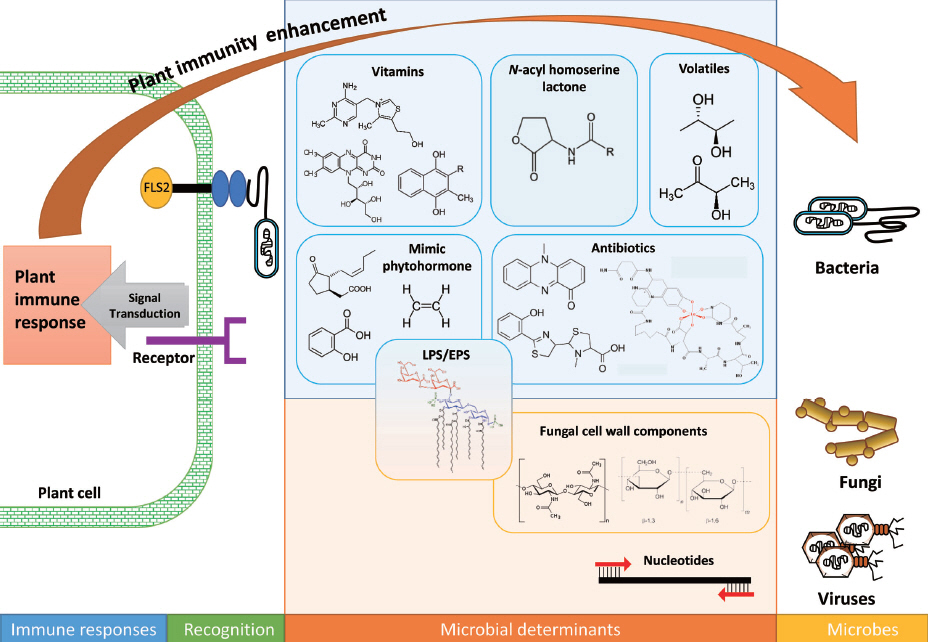
Table 1
Microbial determinants-mediated plant immune responses
| Microbial determinants | Origin | Defense response and signal transduction | Target plants | References | |
|---|---|---|---|---|---|
| Microbe/pathogen-associated molecular pattern | Chitin | All fungi | Jasmonic acid signaling | A. thaliana, A. sativa, O. sativa, and T. aestivum | Tada et al., 2001; Takai et al., 2001; Vander et al., 1998 |
| β-Glucans | Fungi (M. grisea and P. oryzae) and Oomycetes (P. sojae) | Ethylene signaling, MAP kinase signaling | G. max, N. benthamiana, and O. sativa | Klarzynski et al., 2000; Sharp et al., 1984a; Yamaguchi et al., 2000 | |
| Lipopolysaccharides (LPS) | Gram-negative bacteria (Pseudomonads spp., Xanthomonads spp.) | ROS, PCD/salicylic acid signaling | A. thaliana, C. annuum, N. tabacum, and O. sativa | Coventry and Dubery, 2001; Desaki et al., 2006; Meyer et al., 2001 | |
| Exopolysaccharide (EPS) | Gram-positive (B. amyloliquefaciens and B. polymyxa) and Gram-negative (P. agglomerans and P. fluorescens) bacteria | ISR | C. sativus and T. aestivum | Ortmann and Moerschbacher, 2006; Park et al., 2008 | |
| Flagellin | Gram-negative bacteria | non-host resistance, PTI | A. thaliana and S. lycopersicum | Felix et al., 1999 | |
| Elongation factor (EF-Tu) | Gram-negative bacteria | PTI | A. thaliana and Brassicaceae | Kunze et al., 2004 | |
|
|
|||||
| Antibiotics | Siderophore | P. fluorescens, P. putida, and S. marcescens | Salicylic acid/SAR | A. thaliana, E. globulus, Fabaceae, and S. lycopersicum | Bakker et al., 2007; De Vleesschauwer et al., 2008; Press et al., 1997 |
| 2,4-diacetylphloroglucinol (DAPG) | P. fluorescens | ISR | A. thaliana and T. aestivum | Iavicoli et al., 2003; Weller et al., 2002 | |
| Cyclic lipopeptide | Pseudomoans spp. and Bacillus spp. | Jasmonic acid | Fabaceae, M. oryzae., S. cereale, and S. lycopersicum | Ongena et al., 2007; Rahman et al., 2014, 2015 | |
|
|
|||||
| Mimic-plant hormone | Salicylic acid | P. aeruginosa and P. fluorescens | Salicylic acid/SAR | P. vulgaris and N. benthamiana | De Meyer and Hofte, 1997; Maurhofer et al., 1998 |
| Methyl jasmonic acid | nonpathogenic F. oxysporum | ISR/Jasmonic acid | A. thaliana and S. lycopersicum | Brodhun et al., 2013; Cole et al., 2014; Vijayan et al., 1998 | |
| Coronatine | P. syringae pv. tomato | ISR/Jasmonic acid | S. lycopersicum | Ishiga et al., 2009; Uppalapati et al., 2005 | |
| Ethylene | P. syringae | ISR | A. thaliana, O. sativa, and S. lycopersicum | Fukuda et al., 1993; Lund et al., 1998; Thomma et al., 1999; Weinga and Vo¨lksch, 1997 | |
|
|
|||||
| Quorum sensing molecules | N-acyl homoserine lactones (AHL) | Gram-negative bacteria (S. liquefaciens and P. putida) | Salicylic acid | A. thaliana and S. lycopersicum | Schikora et al., 2011; Schuhegger et al., 2006 |
|
|
|||||
| Vitamin | Vitamin B1 (thiamine) | Gram-positive (B. subtilis) and Gram-negative (E. coli) bacteria | SAR | A. thaliana, N. benthamiana, and O. sativa | Ahn et al., 2005, 2007 |
| Vitamin B2 (riboflavin) | Gram-positive (B. subtilis) and Gram-negative (E. coli) bacteria | SAR | O. sativa and S. lycopersicum, | Azami-Sardooei et al., 2010; Taheri and Hofte, 2007; Taheri and Tarighi, 2010 | |
| Vitamin K3 (menadione) | Gram-positive (B. subtilis) and Gram-negative (E. coli) bacteria | SAR,ROS | A. thaliana and Musa spp. AAA | Bentley and Meganathan, 1982; Borges et al., 2004 | |
| Vitamin Bx(PABA, para-aminobenzoic acid) | Bacillus spp. | SAR | C. annuum | Song et al., 2013 | |
|
|
|||||
| Protein | Harpin | Gram-negative bacteria (P. syringae and E. amylovora) | HR, SAR /salicylic acid | A. thaliana, N. benthamiana, and S. lycopersicum | He et al., 1993; Wei et al., 1992 |
|
|
|||||
| Volatile organic compound | 2,3-butanediol | Gram-positive (B. subtilis) and Gram-negative (E. aerogenes and S. arcescens) bacteria | ISR/Jasmonic acid | A. thaliana, C. sativus, N. benthamiana, and Z. mays | Cortes-Barco et al., 2010a; Ryu et al., 2014; Song and Ryu, 2013 |
Chitin
Chitin(β-1,4 linked N-acetylglucosamine)은 진균의 세포벽의 주요 성분으로, 식물체 방어 기작인 분자 패턴인식 기반의 면역 증진 물질로 잘 알려져 있다(Boller 등, 1995; Shibuya와 Minami, 2001). 식물 병원성 진균의 세포벽 내에 있는 chitin, glycopeptide, ergosterol 등이 식물의 면역 반응을 유도되는 것이 이미 보고되었다(Basse 등, 1993; Baureithel 등, 1994; Granado 등, 1995). 이후 벼, 밀, 애기장대에서 chitin에 의해서 방어 관련 유전자의 발현 변화와 활성산소 변화가 알려졌으며(Takai 등, 2001; Vander 등, 1998; Zhang 등, 2002), 귀리에서는 저항성 반응의 하나인 프로그램 세포사멸(programed cell death) 유도가 보고되었다(Tada 등, 2001).
최근 기전 연구를 통하여 식물의 분자 패턴 수용체가 발견 되었는데 Kaku 등(2006)은 벼에서 LysM 도메인을 가지는 chitin 접합 단백질(chitin elicitor binding protein, CEBiP)가 chitin과 직접 결합하며, 하위 신호 전달의 중요한 역할을 하는 것을 밝혀냈다. CEBiP는 하위단계 kinase인 chitin-elicitor receptor kinase(CERK1)와 복합체를 이루어 식물 면역을 증진시킨다(Miya 등, 2007; Wan 등, 2008). 벼에서는 chitin에 인식 후에 의한 병원균에 대한 독성 물질인 phytoalexin과 jasmonic acid 합성이 촉진되는 것으로 밝혀졌다(Nojiri 등, 1996; Yamada 등, 1993).
Glucan
Glucan은 곰팡이의 세포벽 구성물질로서 일반적으로 α-와 β-glucan이 주요 구성성분으로 알려져 있다(Fujikawa 등, 2012). 식물세포는 식물병원성 곰팡이의 glucan을 chitin의 경우와 마찬가지로 분자 패턴으로 인식하여 식물의 면역반응을 유도한다(Jones와 Dangl, 2006). 일반적으로 glucan 인지 시, 식물체 내에서는 면역 반응이 일어나서 식물체 전체로 다양한 식물병에 대한 저항성을 가지게 된다(Jones와 Dangl, 2006).
Glucan은 세포벽에 chitin이 존재하지 않지만 면역을 증가하는 세포벽 유래 결정인자를 탐색하던 중 Phytophthora megasperma var. sojae에서 유래한 세포벽 성분인 β-1,3-glucan이 콩에서 phytoalexin 생산 촉진 현상이 발견되었다(Ayers 등, 1976). 초기에는 모델 난균류인 Phytophthora 종에 의한 식물의 유도저항성을 증진시키는 실험들이 수행되었다. 그 중에서 Phytophthora sojae는 콩과식물에서 phytoalexin과 glycoillin 축적이 보고되었다(Sharp 등, 1984; Yamaguchi 등, 2000). 난균류 Phytophthora 종과 Pythium 종 계열에서 β-1,3-glucan의 핵심 유도인자 도메인을 찾고 식물의 수용체에 대한 노력이 이어졌다. 그 결과, hepta-β-glucoside가 식물의 면역반응을 유도하는 핵심 유도체임을 밝혔다(Fellbrich 등, 2002; Kamoun, 2001; Mithöfer 등, 2000; Qutob 등, 2002; Veit 등, 2001). 하지만 아직까지 식물체의 β-1,3-glucan 수용체는 발견되지 않고 있다(Mithöfer 등, 1999; Umemoto 등, 1997; Sequeira, 1983).
β-glucan에 의한 식물 유도저항성에 대한 연구는 콩과식물뿐만 아니라 다른 식물에도 확대되었다. 담배의 경우 glucan 처리시 담배 연부병 군집이 14.4배까지 감소하는 활성을 보였다(Klarzynski 등, 2000; Klarzynski 등, 2003). Phytophthora colocasiae의 glucan 유도체를 이용하여 유도저항성을 일으키는 사례도 보고되었다(Misra와 Sriram, 2002). 난균강 이외에 진균류인 Magnaporthe grisea를 가지고 벼의 phytoalexin이 유도되는 것이 보고 되면서 난균강에 국한된 반응은 아닌 것이 증명되었다(Yamaguchi 등, 2000). 신호전달 관현하여 MAP kinase 신호전달 체계의 활성화와 신호 전달 물질인 ethylene 및 Ca2+의 생산이 급격하게 증가하는 것이 보고 되었다(Fliegmann 등, 2004).
LPS와 EPS
그람 음성 세균의 외피에 존재하는 lipopolysaccharide(LPS)와 lipooligosaccharide는 세균-식물 상호작용시 중요한 역할을 하며, 식물의 면역반응을 유도하는 것으로 알려졌다(Dow 등, 2000; Erbs와 Newman, 2003). 애기장대에서 LPS에 의해 활성 산소와 일산화질소(nitric oxide)의 합성을 촉진하고(Gerber 등, 2004; Meyer 등, 2001), 방어 기작 관련 유전자의 발현을 유도하며(Zeidler 등, 2004), salicylic acid가 축적된다(Newman 등, 2000). 벼에서도 활성 산소의 생산과 방어기작 관련 유전자의 발현이 촉진되며, 세포사멸이 유도되는 것이 밝혀졌다(Desaki 등, 2006). 또한 많은 비병원성 세균의 LPS가 Fusarium oxysporum 등의 토양성 병원균에 대한 저항성을 유도하여 병 발생을 33% 정도 경감시키는 것으로 나타났다(Coventry와 Dubery, 2001; van Peer와 Schippers, 1992). 최근에는 공생 세균인 Rhizobium leguminosarum의 LPS에 의해서 콩에서 Orobanche crenata에 대한 면역 유도(Mabrouk 등, 2014)와 일산화질소 생성을 효과적으로 유도하는 하였다(Zeidler 등, 2004). 병원 세균인 Xanthomonas sampestris pv. campestris의 lipid A가 애기장대의 대표적인 병저항성 지표 유전자인 PR1과 PR2의 발현을 촉진하였다(Silipo 등, 2005).
Exopolysaccharide(EPS)는 다양한 세균과 진균에서 분비되는 탄수화물이다(Choi 등, 2007; Leigh와 Coplin, 1992). Pantoea agglomerans의 EPS 처리시 밀 세포의 방어 프라이밍 효과(Ortmann와 Moerschbacher, 2006)를 보였으며, 근권 세균인 Burkholderia gladioli IN26의 EPS를 200 mg/ml 농도로 오이에 종자침지 방법으로 처리시 면역을 유도하여 오이 탄저병에 대한 병징발생을 59% 감소시켰다(Park 등, 2008). 비슷하게 Pseudomonas fluorescens, Bacillus amyloliquefaciens와 Paenibacillus polymyxa의 EPS를 200 µg/ml 농도로 처리시 흰가루병를 30.9%으로 방제하였다(Wafaa 등, 2014). 그러나 LPS와 EPS에 의한 식물 내 신호전달 시스템에 대한 연구는 아직 활발하게 연구되어 있지 않다.
미생물 분자 패턴(Microbe/pathogen-associated molecular pattern)
식물은 분자 패턴인식은 일반적인 미생물 유래 인자들을 인지하여 다양한 면역반응을 일으킨다(Jones와 Dangl, 2006). 미생물이 일반적으로 가지고 있는 패턴의 인식은 식물의 선천면역(innate immunity)를 인식하는데 중요한 기전으로 앞서 언급한 세균에서는 선모를 구성하는 물질인 flagellin과 유전자 발현시 중요한 인자인 EF-Tu가 대표적이다. 이러한 분자 패턴을 미생물/병원균 관련 분자패턴(microbe/pathogenassociated molecular pattern, MAMP/PAMP)이라고 칭하고, 식물 수용체를 패턴인식수용체(PRR)로 부른다(Chisholm 등, 2006, Dodds와 Rathjen 2010). 지금까지 식물의 PRR은 크게 식물의 세포막에 존재하는 것과 세포질에 존재하는 것 두 가지로 분류할 수 있다(Dodds와 Rathjen 2010; Zipfel, 2008). 수용체에 의한 인식 후 식물은 callose 축적, 활성산소 생성 및 방어 유전자 발현 등 일련의 방어 반응이 일어난다(Nürnberger 등, 2004). 앞서 언급한 바와 같이 세균선모 단백질인 flagellin을 조사하던 중 식물이 이 단백질의 특정 부분(22개의 단백질)을 인지한다는 사실을 알아내고 이를 flg22라고 명명하였다(Felix 등, 1999; Gomez-Gomez와 Boller, 2000). 나아가 애기장대 모델을 통해 이를 인지하는 식물의 수용체인 FLS2을 발견하였다. FLS2 수용체는 세포외 LRR[extracellular LRR(leucin rich repeat)] 도메인을 가지고 있어 초파리의 선천면역 수용체중 toll-like receptor와 유사한 구조를 가진다(Akira와 Takeda, 2004; Chinchilla 등, 2007; Felix 등, 1999). 식물이 flg22를 인지하게 되면 방어기작 관련 유전자들이 활성화되는 것으로 밝혀졌다(Nühse 등, 2000). 특히 BAK1이라는 단백질은 PRR의 on/off를 조절하는 조절인자(regulator)로 작용하는 것으로 알려져 있다(Schulze 등, 2010). BAK1은 FLS2와 같은 PRR과 복합체를 형성하여 이후의 신호전달 과정을 통하여 식물의 방어관련 유전자를 활성화하는 것으로 알려져 있다(Chinchilla 등, 2007; Dodds와 Rathjen, 2010; Gomez-Gomez와 Boller, 2000).
EF-Tu는 그람 음성 세균에서 유래되어 elongation factor의 N 말단 18개의 단백질로 구성되어 있는 elf18이 대표적이며 2006년 애기장대를 모델로 수용체인 EFL을 발견하였다(Zipfel와 Felix, 2005, Zipfel 등, 2006). EF-Tu 처리시 식물의 저항성 유도는 기존의 MAMP와 유사하게 다범성이면서 그 지속 시간이 오래되는 전형적인 면역 증진 효과를 보인다(Zipfel 등, 2006).
항생물질(Antibiotics)
주로 P. fluorescens나 P. putida에서 는 대사산물 중에 철이 부족한 상태에서 생산되는 siderophore가 식물 면역을 증진시키는 결정인자로 알려졌다(Leeman 등, 1996; Maurhofer 등, 1994; Maurhofer 등, 1998). 일련의 연구에서 이 철 조절 대사산물인 pseudobactin, N-alkylated benzylamine derivative, pyocyanin와 pyochelin, salicylic acid에 의해서 콩, 무, 애기장대, 토마토, 유칼립투스 등에 세균과 진균병에 대한 식물 면역 증진 효과가 보고되었다(Bakker 등, 2007; De Vleesschauwer 등, 2008). Pseudomonas 종 이외에도 Serratia marcescens 90-166의 경우도 오이 탄저병에 대한 저항성의 세균 결정인자 탐색을 위한 돌연변이 스크린을 통하여 catechol siderophore 생산 유전자를 발견함으로써 Pseudomonas 뿐만아니라 Serratia 종에서도 철 조절 대사산물이 오이 탄저병에 대해 대조군과 비교했을 때 유의미한 차이를 보여 식물면역의 결정인자로 보고되었다(Press 등, 1997; Press 등, 2001). Siderophore에 의한 식물면역 증진은 주로 식물 내 salicylic acid 의 존적인 신호 전달을 유도하기에 병원균에 의해서 유도되는 저항성 반응인 SAR과 비슷한 특징을 보인다(De Meyer 등, 1997; De Meyer 등, 1999; De Vleesschauwer 등, 2008; Maurhofer 등, 1998). Siderophore 이외에 면역 유도 항생물질로는 미국 동북부 밀에 발생하는 토양병이 자연적으로 발생하지 않는 억제토양(suppressive soil)의 P. fluorescens에서 생산되는 중요한 항생물질로 알려진 2,4-diacetylphloroglucinol(DAPG) 의해 Peronosepora parasitica의 포자형성이 32% 저해되는 효과를 보였고, 최근에는 P. syringae pv. tomato에 대한 유도저항성도 최근에 보고되었다(Iavicoli 등, 2003; Weller 등, 2002; Weller 등, 2012).
Cyclic lipopeptide는 Pseudomoans 종이 생산하여 Phytophthora infestance와 같은 난균강에 대한 생물적 방제 인자로(Tran 등, 2007)로 연구된 바가 있지만, 최근 연구를 통하여 많은 Bacillus 종도 생산하는 항생 물질로 알려져 있다(Kloepper 등, 2004). Bacillus 종이 생산하는 lipopeptide는 크게 iturin, surfactin, fengycin 3가지로 나누어 진다(Ongena와 Jacques, 2007). Lipopeptide는 원래 세균, 진균, 난균강, 바이러스에 대한 광범위하고 직접적인 길항능력을 가지는 것으로 알려져 있지만, 최근들어 이러한 물질을 식물에 처리시 식물면역 증진 반응이 보고되었다(Hass와 Defago, 2005; Ongena 등, 2005; Raaijmakers 등, 2010; Zahir 등, 2004). 일반적으로 길항 능력을 보이는 농도와 면역 유도를 보이는 농도는 큰 차이를 보이는 것이 대부분인데 높은 농도에서는 길항력을, 낮은 농도에서는 면역 증진 효과를 보였다(Ongena와 Jacques, 2007; Raaijmakers 등, 2010). 콩과 토마토를 이용한 실험에서 항생제를 생산하지 못하는 자연 돌연변이체인 B. subtilis 168에 외부에서 유전자를 도입하여 surfactin과 fengycin 생산을 회복해 주었을 때, 식물 면역증진으로 인해 Botrytis cinerea에 대한 병징이 현저하게 감소하는 것으로 미루어, 이 두 물질이 뿌리로 흡수되어 저항성을 유도하는 것으로 여겨진다(Ongena 등, 2007). 이러한 반응을 통해 토마토의 lipoxygenase(LOX)의 효소활성이 증가되는 것으로 미루어 jasmonic acid 신호전달 체계에 의해서 식물 면역 반응이 일어나는 것으로 생각된다. 벼/호밀-도열병 모델에서도 surfactin 처리 시, 병세가 30% 이상 현저히 감소하였고, 이를 통해 surfactin이 면역 유도의 결정인자인 것이 증명되었다(Rahman 등, 2014; Rahman 등, 2015).
유사 식물호르몬(Mimic-plant hormone)
병원균의 공격을 방어하기 위하여 식물은 대표적인 방어 호르몬인 jasmonic acid, salicylic acid, ethylene 의존적 신호 전달 체계를 가동시켜 자신을 보호한다(Sheard 등, 2010). 일반적으로 salicylic acid는 활물 병원균(biotroph)에 대한 저항성과 관련이 있고, jasmonic acid과 ethylene은 사물 병원균(necrotroph)과 곤충(herbivorous)에 대한 저항성에 중요한 역할을 한다(McDowell와 Dangl, 2000). SAR과 ISR은 대표적인 식물 면역반응으로 최근 연구에 따르면 SAR과 ISR을 조절하는 salicylic acid과 jasmonic acid의 신호전달 체계가 서로 길항적인 상호작용을 가지는 것이 알려져 있다. salicylic acid 신호 전달이 강화되면 jasmonic acid 신호 전달 체계가 줄어 드는 현상이다(Doares 등, 1995; Kloek 등, 2001; Laurie-Berry 등, 2006; Niki 등, 1998; Spoel 등, 2007; Thomma 등, 1999). 이 현상은 서론에서 언급한 식물체의 에너지보존이 론(allocation fitness cost)으로 설명이 되는데 식물이 가진 에너지의 한계를 극복하기 위하여 식물은 에너지 소비가 많은 두 가지의 저항성 반응을 모두 발현시키지 않고 한가지만 발현하여 폭발적인 에너지 소비를 피하는 쪽으로 발달된 것 같다.
식물 호르몬 별로 살펴보면, 먼저 salicylic acid은 대표적인 식물 방어관련 호르몬으로 국부적면역(LAR)과 전신면역(SAR) 모두 관여(An과 Mou, 2011, Pajerowska-Mukhtar 등, 2013)하며, SAR의 표지 단백질인 Pathogenesis-Related protein 1(PR1) 단백질의 발현 및 과민감반응(hypersensitive response)을 유도시키는 결정인자다(Brodersen 등, 2005; Raffaele 등, 2006). 일부 PGPR은 salicylic acid을 분비하여 식물의 면역을 유도하는 것으로 알려졌다(van Loon 등, 1998). 앞서 항생제 파트에서 언급한 예시와 같이 콩에서 P. aeruginosa 7NSK2가 합성한 salicylic acid에 의해 B. cinerea에 대한 방어 기작이 촉진되어 발병세를 낮추는 효과가 있으며(De Meyer와 Hofte, 1997), salicylic acid 합성 유전자 pchAB를 도입한 P. fluorescens P3에 의해 담배에서 Tobacco necrosis virus에 대한 ISR이 보고되었다(Maurhofer 등, 1998).
Jasmonic acid/jasmonate는 식물 세포막의 지방 유래 호르몬으로 식물의 면역과 발달 과정을 조절하는 식물 호르몬으로 알려져 있다(Balbi와 Devoto, 2008; Wasternack, 2007). 휘발성 물질인 methyl jasmonate을 애기장대에 처리시, 야생형에서는 토양병인 Pythium mastophorum 병에 대한 저항성이 보였지만, jasmonic acid을 인식하지 못하는 돌연변이 식물체인 coi1에서는 병징이 관찰되었다(Vijayan 등, 1998). 이 결과는 jasmonic acid 신호가 식물의 면역 유도에 중요한 역할을 한다는 것을 보여 주는 예이다. 최근 두 가지 연구에서 토마토와 애기장대를 공격할 수 있는 F. oxysporum이 jasmonic acid을 생산할 수 있는 것으로 알려졌다(Brodhun 등, 2013; Cole 등, 2014). 이 결과는 기존의 비병원성 F. oxysporum에 의한 jasmonic acid 의존적 신호전달 체계가 F. oxysporum에 의해서 직접적으로 생산된 jasmonic acid에 의한 가능성도 제시하는 새로운 결과이 다. 세균에서는 대표적으로 jasmonic acid의 유사 물질인 coronatine을 생성한다(Uppalapati 등, 2005). 지상부에 반점병(bacterial speck)을 내는 P. syringae pv. tomato에서 생산되는 독소로, 세균의 돌연변이 연구와 분리된 coronatine을 대상으로 한 연구에서 coronatine 자체적으로 식물의 jasmonic acid 신호전달 체계가 발현되는 것이 보고되었다(Ishiga 등, 2009; Uppalapati 등, 2005).
Ethylene은 대표적인 기체 형태의 호르몬으로 식물의 노화와 종자 발아와 같은 식물 생리와 함께 면역반응에 중요한 역할을 하는 것이 보고 되었다(Broekaert 등, 2006). 다양한 미생물에 의해서 ethylene의 생산이 보고되었다(Fukuda 등, 1993; Weinga와 Völksch, 1997). Ethylene을 생산하는 식물 생장조절제인 ethephon을 고추에 처리시 역병균인 Phytophthora capsici에 대한 저항성이 유도되었다(Núñez-Pastrana 등, 2011).
Ethylene 신호 전달 기작은 애기장대와 벼에서 jasmonic acid 와의 상승 작용을 통해서 Rhizoctonia solani와 같은 사물 병원 체 병원체에 대한 면역 증진이 보고되었다(Anderson 등, 2010; Thomma 등, 1999;). 토마토에서는 ethylene 신호 기작에 의해 서 P. syringae pv. tomato와 Xanthomoas campestris pv. vesicatoria에 대한 병징이 저해되는 것으로 나타났다(Lund 등, 1998).
정족수 인식(Quorum sensing) 신호물질
정족수 인식은 세균이 동종과 타종의 밀도를 인식하는 기전으로 이 정족수 인식을 통하여 병원성, 생물막 형성, 접합(conjugation), 물질생산 등 다양한 세균 생리에 영향을 주는 것으로 알려져 있다(Miller 와 Bassler 2001; Schuhegger 등, 2006). 세균의 종류에 따라 서로 다른 신호 물질을 사용하지만 그람 음성균에서 가장 많이 알려진 물질은 N-acyl homoserine lactones이라고 불리는 물질로 homoserine lactone 구조에 서로 다른 탄소 길이의 아실 체인이 달려 있는 모양을 하고 있다.
최근들어 이 AHL이 식물의 면역을 증가시키는 보고가 발표되면서 식물이 세균의 정족수 인식 과정 중에 세균의 존재를 미리 인식하여 면역을 증가시킨다는 새로운 시각을 제시하였다(Pierson 등, 1998). 예를 들어 Serratia liquefaciens MG1는 토마토에 처리시 잎에 발생하는 Alternaria alternata에 대한 면역을 유도하지만 AHL 돌연변이의 경우 면역 유도능력을 상실하는 것을 보고하였다. 비슷하게 AHL을 생산하지 못하는 돌연변이체인 P. putida F117은 야생균주에 비해 현저하게 면역 유도 능력이 감소된 것을 관찰하였다. 이러한 결과는 세균이 생산하는 AHL이 식물 면역 증진에 직접적인 역할을 대변한 것이다. 이후 의 연구에서 다양한 탄소 길이의 AHL를 토마토 뿌리에 직접 처리할 때에도 유사한 면역 유도반응을 관찰하였다. AHL을 생산하는 S. liquefaciens를 처리했을 때, A. alternata의 병징을 70% 줄이는 효과를 보였다(Schuhegger 등, 2006). 토마토 외에 보리와 애기장대에 처리한 14개의 서로 다른 AHL 직접 처리하여 저항성을 유도한 사례도 보고되었다(Schikora 등, 2011). 이 실험에서 식물의 MAP kinase와 전사인자인 WRKY22와 WRKY29의 발현이 면역유도에 중요한 역할을 한다는 것을 발표하였다.
비타민(Vitamin)
최근 연구에 따르면 알려진 많은 비타민이 장내 미생물에 의해 만들어 지고 장에서 흡수되어 인체에 다양한 역할이 밝혀졌다(LeBlanc 등, 2011). 장내 미생물뿐만 아니라 식물 상호작용 미생물에서도 비타민이 생산되고 이들 비타민에 의해 식물의 다양한 생리, 특히 면역에 영항을 주는 것이알려졌다. Vitamin B1(thiamine), vitamin B2(riboflavin), vitamin K3(menadione)를 처리 시에 콩, 벼, 담배, 토마토, 애기장대에서 식물 면역이 증진되어 진균, 세균, 바이러스병이 저해되는 것이 보고되었다(Ahn 등, 2005; Ahn 등, 2007; Dong와 Beer, 2000; Liu 등, 2010; Song 등, 2013; Taheri와 Tarighi, 2010; 2011). Thiamine은 락토바실러스, 대장균 등의 대부분의 세균에서 그 생산이 확인하였다(LeBlanc 등, 2011). Thiamine을 벼, 담배와 다양한 채소류에 적용 시 강력한 SAR유도 능력을 보였다(Ahn 등, 2005; Ahn 등, 2007). Riboflavin도 미생물에서 흔하게 생산되는 비타민으로(Demain, 1972) 식물 처리시 Tobacco mosaic virus, Phytophthora parasitica, Ralstonia solanacearum, B. cinerea에 대한 저항성이 보고되었다(Azami-Sardooei 등, 2010; Dong와 Beer, 2000; Liu 등, 2010; Taheri와 Tarighi, 2010; Taheri 와 Tarighi, 2011). 벼에 처리시 riboflavin은 입고병을 효과적으로 방제한 것을 보고하였다(Taheri와 Hofte, 2007). Menadione 도 일반적으로 미생물에 의해서 생산되며(Bentley와 Meganathan, 1982) 미리 처리하면 강력한 식물면역이 발현된다. 또한 vitamin Bx로 불리는 para-aminobenzoic acid(PABA)에 의한 고추의 면역 유도 반응이 보고되었다(Song 등, 2013). 원래 토양 세균인 Bacillus sp. BS107이 생산하는 ortho-aminobenzoic acid(OABA)가 담배에서 Pectobacterium carotovorum에 대한 저항성 반응을 일으킨다는 사실이 검정되었고, PABA는 그 유사체를 선발하던 중에 발견되었다(Song 등, 2013; Yang 등, 2010). 해당 논문에서는 100 mm PABA가 대조군에 비해 고추궤양병(Xanthomonas axonopodis pv. vesicatoria)을 35배나 저해하는 효과가 있으며, 오이모자익바이러스(Cucumber mosaic virus)를 55%나 저해하는 효과를 보여, 온실과 포장조건에서 성공적으로 방제하였다(Song 등, 2013).
단백질
세균유래 다양한 단백질에 의한 면역반응이 보고 되고 그 중에서 제3분비체계(type III secretion system)의 effector 로 알려진 다양한 단백질(McDowell와 Dangl, 2000)이 식물의 SAR을 일으키고 이를 이용한 식물병 방제법이 연구되었지만 가장 성공적인 예로 harpin이 알려져 있다. Harpin은 Erwinia amylovora의 병원성인자 탐색 중 처음 발견되었다(Wei 등, 1992). 식물의 과민감반응(HR)을 일으키는 세균 인자 탐색을 수행하여, E. amylovora의 유전자중에 HR과 저항성(R)을 모두 관여하는 것으로 생각되는 hrp(HR+P) 유전자를 분리하였고, 식물에 발현했을 때 강력한 과민감반응을 보이는 단백질을 분리하여 이를 hrp를 유도하는 단백질(-in))로 명명하였다. 이어진 연구에서 P. syringae pv. phaseolicola, X, campestris, R. solanacearum, Pantoea stewarti 등 다양한 병원성 세균에서 도 harpin이 발견되었다(Arlat 등, 1994; Bauer 등, 1995; Charkowski 등, 1998; Cui 등, 1996; He 등, 1993; Kim와 Beer 1998; Preston 등, 1995). 세균 내 harpin 단백질 생산을 담당하는 hrp 유전자 클러스터를 형성하는 hrp 오페론의 구성과 기능이 자세하게 밝혀졌다(Boller와 Felix 1996; Huang 등, 1995).
실용적인 측면에서 harpin을 분리하여 식물에 직접 처리시에 도 식물면역 증진 효과를 보였다(Dong 등, 1999; Jin 등, 2001; Lee 등, 2000). 이러한 연구를 바탕으로 미국의 이든바이오사이언스에서는 harpin을 상품화하여 Messenger®라는 상품명으로 미국전역에 대단위 포장 실험을 실시하여 식물 면역 유도를 통한 식물병 방제의 새로운 지평을 제공하였다(Wei 등, 1992). 하핀의 작용은 salicylic acid 살리실산 신호전달 기작과 밀접한 연관을 가지고 있어, SAR과 유사한 면역 기전을 보였다(Dong 등, 1999).
휘발성 물질(Volatile organic compound)
미생물 휘발성물질(volatile organic compound)에 의한 식물 면역 반응은 2004년도 Ryu 등의 연구에 의해 최초로 발견되면서 식물 면역 증진을 위한 새로운 미생물 결정인자로 관심을 받게 되었다(Ryu 등, 2004). 일반적으로 세균의 경우 적어도 30종의 서로 다른 휘발성물질을 생산하고(Farag 등, 2006) 이러한 물질은 식물-세균, 세균-세균, 진균-세균 상호작용에서 서로의 생리적 변화를 초래하는 것이 보고 되고 있다(Chung 등, 2015). 이러한 상호 작용 중에서 식물-미생물의 휘발성 물질 의존적 반응의 대표적인 예는 2,3-butanediol과 그 전구체인 acetoin으로 두 가지 물질을 식물에 처리 시 담배와 애기장대에서 진균병과 세균병의 발생을 현저하게 감소시키는 것이 보고되었다(Cortes-Barco 등, 2010a,b). 최근 연구에서는 내생세균인 Enterobacter aerogenes가 생산하는 2,3-butanediol이 옥수수의 지상부 진균병인 Setoshaeria turcica에 대한 저항성과 함께 옥수수 잎을 가해하는 해충의 천적인 Cotesia marginiventris을 유인하는 간접적 저항성(indirect defense)을 일으키는 것을 증명되었다(D’ Alessandro 등, 2014). 오이의 경우에도 세균 휘발성 물질인 2,3-butanedione 처리 시 진딧물의 천적인 무당벌레의 숫자가 증가하고 반대로 진딧물의 수를 100배 이상 현저하게 감소하여 결과적으로 식물이 해충의 피해로부터 자신을 보호받는 것을 밝혔다(Song과 Ryu, 2013). 이러한 면역 유도에서 식물의 자스몬산 신호전달 체계를 이용한다는 것을 전사체와 단백체 연구를 통하여 밝혔다(Kwon 등, 2010; Rudrappa 등, 2010; Zhang 등, 2006). 최근 식물근권세균인 S. marcescens 90-166을 이용한 실험에서 정족수 인식이 세균의 2,3-butanediol의 생산을 조절하고, 세균 내에서 생산된 2,3-butanediol 에 의해 식물의 면역이 유도된다는 사실이 보고되었다. 나아가 이러한 면역 유도가 CMV와 P. syringae pv. tabaci에 대한 방어 반응에 작용한다는 사실을 발표하였으며(Ryu 등, 2013), 병원균에 대한 식물면역 뿐만 아니라 가뭄, 염해 등 환경 저항성에 대한 저항성까지 증가시킨다는 보고를 했다(Cho 등, 2008; Han 등, 2006; Yang 등, 2009; Zhang 등, 2008; Zhang 등, 2009). 뿐만 아니라 진균에 의한 휘발성물질에 의한 식물 면역의 경우도 세균의 휘발성 물질의 경우와 비슷한 경향을 보인다(Kanchiswamy 등, 2015).
휘발성물질을 작물에 적용하기 위해서는 몇 가지 문제를 극복해야 한다. 그 중에 한가지는 “쉽게 증발되는 단점을 어떻게 극복할 수 있느냐?”라는 것이다(Farag 등, 2013). 최근 휘발성물질을 포장조건하의 고추와 오이에 적용한 결과들이 발표되었는데 이 결과에서 보면 초기에 식물면역을 프라이밍시키는 것만으로 수확기까지 그 효과가 보전되는 것을 관찰하였다(Choi 등, 2014; Song 등, 2013; Song과 Ryu, 2013). 병원균으로 사용한 CMV와 세균병인 고추궤양병에 대하여 무처리구에 비해 병징이 줄어 들었을 뿐만 아니라 수확량의 증가도 관찰하였다(Choi 등, 2014; Song과 Ryu, 2013). 덧붙여 세균의 휘발성 물질로 분류된 화합물들이 그 끊는점이 생각보다 낮지 않다는 것으로 미루어 포장에 관주 처리시에도 쉽게 공기 중으로 비산되지 않는 다는 것을 알 수 있다(Choi 등, 2014; Cortes-Barco 등, 2010a).
결언
지금까지 미생물 유래 결정인자에 의한 식물면역을 이용한 식물병 방제에 대해서 살펴 보았다. 생물적 방제의 한 부분으로 만 사용되었던 다양한 이러한 기술들이 최근 다양한 접근법으로 식물 면역 증진제로 사용이 가능하다는 것이 밝혀지고 있어 앞으로 농업에 적용할 가능성이 높아 보인다. 포장적용을 위해 서 미생물 결정인자 생산의 최적화와 품질 관리(quality control) 및 제형화 기술이 확보되어야 할 것이다. 이와 더불어 장기 보관중에서 방제능을 유지할 수 있는 안정화 기술도 확보되어야한다. 휘발성 물질의 포장 적용 사례와 같이 앞으로 다양한 미생물 결정인자들의 최적화 단계와 포장적용 기술을 발전시킨 다면 앞으로 안전한 농산물 생산의 새로운 기술로 각광받을 것으로 확신한다.



 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






